解题方法
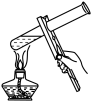
1 . 下列装置或操作正确且对应的实验能达到实验目的的是
 |  | 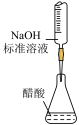 |  |
| A.检查装置的气密性 | B.加热胆矾晶体 | C.测定醋酸浓度 | D.稀释浓硫酸 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
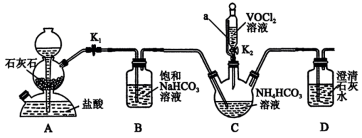
2 . 氧钒(IV)碱式碳酸铵晶体{(NH4)5[(VO)6(CO3)4(OH)9]·10H2O}是制备多种含钒产品和催化剂的基础原料和前驱体。利用纯净的VOCl2制备氧钒(IV)碱式碳酸铵晶体{(NH4)5[(VO)6(CO3)4(OH)9]·10H2O}的装置如图:
(1)装置A中的仪器名称是_____ ,装置C中a玻璃导管的作用是_____ 。
(2)装置B中反应的离子方程式_____ 。
(3)实验开始先关闭K2,_____ (填实验现象),关闭K1、打开K2进行实验。
(4)写出装置C中发生反应的化学方程式_____ 。
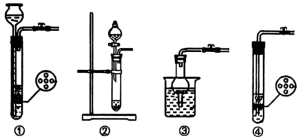
(5)下列装置不能代替装置A的是_____ 。_____ ,仪器c的作用是______ 。
(7)测定粗产品中钒的含量,称取2.0g粗产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解,滴入几滴亚铁氰化钾K4[Fe(CN)6]溶液,用0.2mol/L的Fe2(SO4)3标准溶液进行滴定,滴定终点消耗标准溶液的体积为20.00mL。(假设杂质中不含钒,杂质也不参与反应,滴定反应为:VO2++Fe3++H2O=VO +Fe2++2H+。)
+Fe2++2H+。)
①滴定终点时的现象为_____ 。
②粗产品中钒的质量分数为_____ 。
(1)装置A中的仪器名称是
(2)装置B中反应的离子方程式
(3)实验开始先关闭K2,
(4)写出装置C中发生反应的化学方程式
(5)下列装置不能代替装置A的是

(7)测定粗产品中钒的含量,称取2.0g粗产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解,滴入几滴亚铁氰化钾K4[Fe(CN)6]溶液,用0.2mol/L的Fe2(SO4)3标准溶液进行滴定,滴定终点消耗标准溶液的体积为20.00mL。(假设杂质中不含钒,杂质也不参与反应,滴定反应为:VO2++Fe3++H2O=VO
 +Fe2++2H+。)
+Fe2++2H+。)①滴定终点时的现象为
②粗产品中钒的质量分数为
您最近半年使用:0次
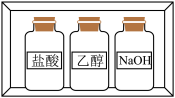
3 . 用下列实验装置进行相应实验,能达到实验目的的是
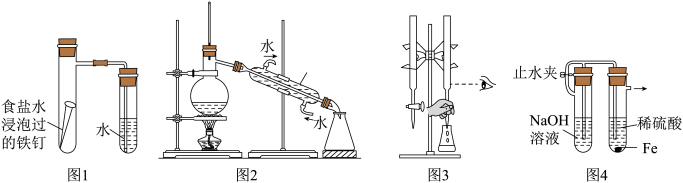

| A.图1证明铁发生了吸氧腐蚀 | B.图2向含少量水的乙醇中加入沸石,蒸馏可得到无水乙醇 |
C.图3用标准 溶液滴定锥形瓶中的盐酸 溶液滴定锥形瓶中的盐酸 | D.图4制备氢氧化亚铁沉淀 |
您最近半年使用:0次
名校
4 . 亚硫酰氯(SOCl2)又名氯化亚砜,是一种无色或淡黄色发烟液体,有强烈刺激性气味,常用作脱水剂,主要用于制造酰基氯化物,还用于医药、农药、染料等的生产。某实验小组设计实验制备氯化亚砜并探究其性质。
已知:①实验室制备原理为 。
。
②资料卡片:
实验一:制备并探究SOCl2的性质,制备SOCl2的装置如图(夹持装置已略去)。
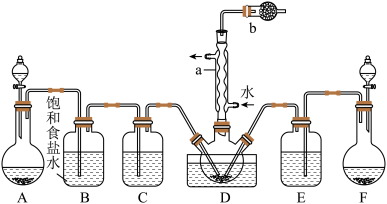
(1)a仪器的名称为_______ ,b装置的作用是_______ 。
(2) 可通过
可通过 固体与70%浓
固体与70%浓 反应制取,
反应制取, 可通过
可通过 固体与浓盐酸反应制取,则上图中制取
固体与浓盐酸反应制取,则上图中制取 的装置为
的装置为_______ (填字母)。
(3)将上述装置制得的SOCl2通过蒸馏方法提取出来(加热及夹持装置略),装置安装顺序为①⑨⑧_______ (填序号)。

(4)甲同学认为SOCl2可用作热分解 制取无水
制取无水 的脱水剂,反应的化学方程式为
的脱水剂,反应的化学方程式为_______ ;但乙同学认为该实验可能发生副反应使产品不纯,所以乙同学取少量 在不断通入SOCl2蒸气的条件下加热,充分反应后通入N2,加水溶解,取溶解后的溶液少许,加入
在不断通入SOCl2蒸气的条件下加热,充分反应后通入N2,加水溶解,取溶解后的溶液少许,加入_______ (填写试剂和实验现象),说明发生了副反应。
实验二:测定某SOCl2样品中SOCl2的纯度。
①准确称量称量瓶和盖的总质量 ,迅速加入
,迅速加入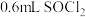 样品,立即盖紧,称量,质量为
样品,立即盖紧,称量,质量为 。
。
②连同称量瓶一起放入盛有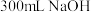 溶液的密封水解瓶中,盖紧并用蒸馏水封口,轻轻摇动,待称量瓶盖打开,将水解瓶放入冰水浴,浸泡水解1h后,将水解瓶中的溶液全部转移到
溶液的密封水解瓶中,盖紧并用蒸馏水封口,轻轻摇动,待称量瓶盖打开,将水解瓶放入冰水浴,浸泡水解1h后,将水解瓶中的溶液全部转移到 容量瓶中,洗涤水解瓶2~3次,洗涤液一并转入容量瓶中,静置至室温,定容,摇匀,得到溶液M。
容量瓶中,洗涤水解瓶2~3次,洗涤液一并转入容量瓶中,静置至室温,定容,摇匀,得到溶液M。
③准确量取 溶液M于
溶液M于 碘量瓶中,加入两滴指示剂,用
碘量瓶中,加入两滴指示剂,用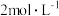 的盐酸中和过量的
的盐酸中和过量的 溶液至恰好完全。
溶液至恰好完全。
④准确加入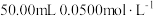 碘标准溶液,充分反应后,用淀粉溶液作指示剂,用
碘标准溶液,充分反应后,用淀粉溶液作指示剂,用 的
的 溶液滴定过量的碘,反应为
溶液滴定过量的碘,反应为 。平行测定两次,反应消耗
。平行测定两次,反应消耗 溶液的平均体积为
溶液的平均体积为 。
。
(5)判断滴定终点的方法为_______ ,样品中SOCl2的质量分数为_______ ;下列情况会导致测定的SOCl2的质量分数偏高的是_______ (填标号)。
A.实际碘标准溶液浓度偏低
B.实际 溶液浓度偏低
溶液浓度偏低
C.水解过程,气体吸收不充分,有部分气体逸出
D.滴定达终点时发现滴定管尖嘴内有气泡生成
已知:①实验室制备原理为
 。
。②资料卡片:
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
 |  | 76.1 | 137.5 | 遇水剧烈水解,易与 反应 反应 |
 | 1.25 | 105.8 | 153.5 | 遇水剧烈水解,能溶于 |
 | 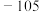 | 78.8 | 119 | 遇水剧烈水解,受热易分解 |

(1)a仪器的名称为
(2)
 可通过
可通过 固体与70%浓
固体与70%浓 反应制取,
反应制取, 可通过
可通过 固体与浓盐酸反应制取,则上图中制取
固体与浓盐酸反应制取,则上图中制取 的装置为
的装置为(3)将上述装置制得的SOCl2通过蒸馏方法提取出来(加热及夹持装置略),装置安装顺序为①⑨⑧

(4)甲同学认为SOCl2可用作热分解
 制取无水
制取无水 的脱水剂,反应的化学方程式为
的脱水剂,反应的化学方程式为 在不断通入SOCl2蒸气的条件下加热,充分反应后通入N2,加水溶解,取溶解后的溶液少许,加入
在不断通入SOCl2蒸气的条件下加热,充分反应后通入N2,加水溶解,取溶解后的溶液少许,加入实验二:测定某SOCl2样品中SOCl2的纯度。
①准确称量称量瓶和盖的总质量
 ,迅速加入
,迅速加入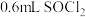 样品,立即盖紧,称量,质量为
样品,立即盖紧,称量,质量为 。
。②连同称量瓶一起放入盛有
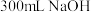 溶液的密封水解瓶中,盖紧并用蒸馏水封口,轻轻摇动,待称量瓶盖打开,将水解瓶放入冰水浴,浸泡水解1h后,将水解瓶中的溶液全部转移到
溶液的密封水解瓶中,盖紧并用蒸馏水封口,轻轻摇动,待称量瓶盖打开,将水解瓶放入冰水浴,浸泡水解1h后,将水解瓶中的溶液全部转移到 容量瓶中,洗涤水解瓶2~3次,洗涤液一并转入容量瓶中,静置至室温,定容,摇匀,得到溶液M。
容量瓶中,洗涤水解瓶2~3次,洗涤液一并转入容量瓶中,静置至室温,定容,摇匀,得到溶液M。③准确量取
 溶液M于
溶液M于 碘量瓶中,加入两滴指示剂,用
碘量瓶中,加入两滴指示剂,用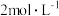 的盐酸中和过量的
的盐酸中和过量的 溶液至恰好完全。
溶液至恰好完全。④准确加入
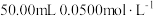 碘标准溶液,充分反应后,用淀粉溶液作指示剂,用
碘标准溶液,充分反应后,用淀粉溶液作指示剂,用 的
的 溶液滴定过量的碘,反应为
溶液滴定过量的碘,反应为 。平行测定两次,反应消耗
。平行测定两次,反应消耗 溶液的平均体积为
溶液的平均体积为 。
。(5)判断滴定终点的方法为
A.实际碘标准溶液浓度偏低
B.实际
 溶液浓度偏低
溶液浓度偏低C.水解过程,气体吸收不充分,有部分气体逸出
D.滴定达终点时发现滴定管尖嘴内有气泡生成
您最近半年使用:0次
2022-10-08更新
|
390次组卷
|
5卷引用:河北省沧州市青县等5地八校联盟2022-2023学年高三上学期11月期中考试化学试题
名校
5 . 电子晶体是原子或离子在同一平面上整齐排列的二维晶体,也称为维格纳晶体,通常用于制造新型半导体。氮化钙(Ca3N2)是一种电子晶体,具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于新型半导体陶瓷工业等领域。氮化钙在空气中会被氧化,遇水强烈水解,产生刺激性气味气体。实验室设计如图装置用Ca与N2反应制备Ca3N2,并对Ca3N2纯度进行测定。回答下列问题:
I.Ca3N2的制备

(1)仪器a的名称为_____ ,E装置的主要作用是____ 。
(2)实验开始时应首先点燃____ (填“A”或“C”)处酒精灯,当观察到_____ 时点燃另一处酒精灯。
II.Ca3N2纯度的测定(已知所含的杂质只有单质钙)
(3)方案一:①按图1所示连接装置,检查装置气密性后加入试剂,打开K1,K2,通入N2,将装置内空气排尽;②测定虚线框内装置及试剂的质量m1;③____ ,用分液漏斗加入足量的水,至不再产生气体;④____ ;⑤再次测定虚线框内装置及试剂的质量m2。则产品中Ca3N2的质量分数表达式为____ 。

(4)方案二:按图2所示连接装置,检查装置气密性后加入试剂。打开分液漏斗活塞向三颈烧瓶中加入蒸馏水,打开K持续通入水蒸气,将产生的氨气全部蒸出,并用100mL1.00mol•L-1稀硫酸标准液完全吸收(液体体积变化忽略不计)。从烧杯中量取10.00mL吸收液注入锥形瓶中,用1.00mol•L-1的NaOH标准溶液滴定过量的稀硫酸,到终点时消耗12.20mLNaOH溶液。则产品中Ca3N2的质量分数为____ 。
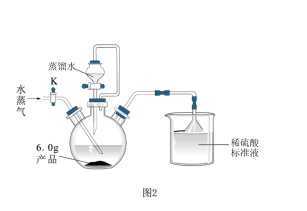
I.Ca3N2的制备

(1)仪器a的名称为
(2)实验开始时应首先点燃
II.Ca3N2纯度的测定(已知所含的杂质只有单质钙)
(3)方案一:①按图1所示连接装置,检查装置气密性后加入试剂,打开K1,K2,通入N2,将装置内空气排尽;②测定虚线框内装置及试剂的质量m1;③

(4)方案二:按图2所示连接装置,检查装置气密性后加入试剂。打开分液漏斗活塞向三颈烧瓶中加入蒸馏水,打开K持续通入水蒸气,将产生的氨气全部蒸出,并用100mL1.00mol•L-1稀硫酸标准液完全吸收(液体体积变化忽略不计)。从烧杯中量取10.00mL吸收液注入锥形瓶中,用1.00mol•L-1的NaOH标准溶液滴定过量的稀硫酸,到终点时消耗12.20mLNaOH溶液。则产品中Ca3N2的质量分数为

您最近半年使用:0次
2022-10-01更新
|
180次组卷
|
4卷引用:河北省保定市2022-2023学年高三上学期9月份考试化学试题
名校
解题方法
6 . 下列实验操作或装置正确的是
A.蒸发除去苯甲酸中的乙醇 | B.除去水中的苯酚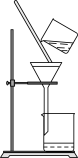 |
C.实验室纯化工业乙酸乙酯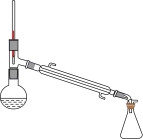 | D.用氢氧化钠溶液滴定醋酸溶液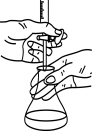 |
您最近半年使用:0次
2022-08-18更新
|
446次组卷
|
12卷引用:河北正定中学2020-2021学年高三下学期开学考试化学试题
河北正定中学2020-2021学年高三下学期开学考试化学试题湖北省2021年普通高中学业水平选择考适应性测试化学试题重庆市重点中学2021届高三下学期开学考试(新高考)化学试题(已下线)重点1 仪器组合型实验方案的设计与评价-2021年高考化学【热点·重点·难点】专练(新高考)安徽师范大学附属中学2020-2021学年高二下学期6月考试化学试题(已下线)考向35 实验的方案设计与评价-备战2022年高考化学一轮复习考点微专题(已下线)考向34 物质的检验、分离和提纯-备战2022年高考化学一轮复习考点微专题(已下线)专题16 基础化学实验-2022年高考化学二轮复习重点专题常考点突破练重庆市石柱中学校2021-2022学年高三上学期第四次月考化学试题(已下线)专题24 实验分析设计型选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第2讲 物质的分离与提纯2024届重庆市乌江新高考协作体高三下学期模拟预测化学试题
真题
名校
7 . 化学实验操作是进行科学实验的基础。下列操作符合规范的是
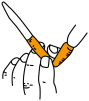 |  |  |  |
| A.碱式滴定管排气泡 | B.溶液加热 | C.试剂存放 | D.溶液滴加 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2022-06-10更新
|
9628次组卷
|
32卷引用:河北省衡水市武强中学2021-2022学年高二下学期期末考试化学试题
河北省衡水市武强中学2021-2022学年高二下学期期末考试化学试题河北省衡水市武强中学2023-2024学年高二上学期期中考试化学试题2022年新高考湖南化学高考真题(已下线)2022年湖南卷高考真题变式题(1-10)(已下线)专题11 化学实验基础-2022年高考真题模拟题分项汇编(已下线)专题11 化学实验基础-三年(2020-2022)高考真题分项汇编(已下线)考点49 化学实验基础-备战2023年高考化学一轮复习考点帮(全国通用)河南省南阳一中2022-2023学年高三上学期第一次阶段性考试化学试题河南省项城市第三高级中学2021-2022学年高二下学期期末考试化学试题(已下线)第27讲 化学实验基础知识和技能(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第25讲 常见仪器使用和实验基本操作 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点31 化学实验常用仪器-备战2023年高考化学考试易错题(已下线)易错点24 水的电离平衡-备战2023年高考化学考试易错题福建省厦门外国语学校石狮分校2022-2023学年高二上学期期中考试化学试题天津市第一中学2022-2023学年高三上学期期末考试(第三次月考)化学试题(已下线)专题11 化学实验基础(讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题23 化学实验基础性选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 专题17 典型实验装置及化学实验基本操作(已下线)专题05 突破化学实验基础(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)题型170 以装置图为载体考查实验基本操作 山东省青岛第二中学2022-2023学年高三上学期第二次月考化学试题(已下线)专题13 化学实验基础(已下线)专题13 化学实验基础(已下线)第08练 实验仪器的选用与基本操作 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题11 化学实验(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)专题05 化学实验基础-2023年高考化学真题题源解密(全国通用)天津市第一中学2022-2023学年高三上学期1月期末质量检测化学试题(已下线)考点44 化学实验基础(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点1 常见仪器使用和实验基本操作(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)第1讲 常用的仪器及基本操作(已下线)题型07 化学实验基础(选择题)-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)新疆兵团第三师图木舒克市鸿德实验学校2023-2024学年高二上学期期中考试化学试卷
名校
8 . 根据要求,回答下列问题:
I.硝酸银(AgNO3)标准溶液可用作测定卤素含量的滴定剂,实验室要配制480mL 0.1000mol/LAgNO3标准溶液,回答下列问题:
(1)配制该溶液所需仪器除天平、烧杯、量筒、玻璃棒外,还必须用到的玻璃仪器有_______
(2)用分析天平(读数精度为0.0001g)称取硝酸银(AgNO3)固体质量为___________ g
(3)称量后,按如下实验步骤进行实验,A~E正确的实验顺序为___________ (填字母)
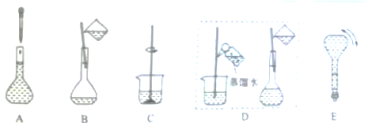
(4)配制过程中,下列情况会使配制结果偏低的是___________ (填序号)
①转移前,容量瓶内有蒸馏水
②移液时,未洗涤烧杯和玻璃棒
③移液时,烧杯中的溶液不慎洒到容量瓶外
④定容后经振荡、摇匀,静置,发现液面低于刻度线,再补加蒸馏水至度线
⑤定容时俯视刻度线
II.通过佛尔哈德返滴定法,用上述配制的 标准溶液测定磷化钠待测液中I元素的含量,实验步骤如下:
标准溶液测定磷化钠待测液中I元素的含量,实验步骤如下:
①取10mL碘化钠待测液于形瓶中,加稀硝酸至溶液显酸性;
②向锥形瓶中加入0.1000mol/L的 溶液50.00mL,使
溶液50.00mL,使 完全沉淀;
完全沉淀;
③滤去AgI沉淀,并用稀 洗涤沉淀,洗涤液并滤液中:
洗涤沉淀,洗涤液并滤液中:
④加入2~3滴铁铵矾[ ]指示剂,用0.2000mol/L
]指示剂,用0.2000mol/L  标准溶液返滴定过量
标准溶液返滴定过量 至终点,记下所用体积为10.00mL。
至终点,记下所用体积为10.00mL。
已知:i.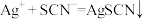 (白色沉淀)
(白色沉淀)
ii.达到化学计量点时,微过量的 与
与 生成红色
生成红色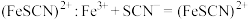 (红色)
(红色)
(5)步骤④中指示剂必须在加入过量的 后加入的原因是:
后加入的原因是:___________ (用离子方程式表示)
(6)碘化钠待测液中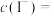
___________ mol/L。
I.硝酸银(AgNO3)标准溶液可用作测定卤素含量的滴定剂,实验室要配制480mL 0.1000mol/LAgNO3标准溶液,回答下列问题:
(1)配制该溶液所需仪器除天平、烧杯、量筒、玻璃棒外,还必须用到的玻璃仪器有
(2)用分析天平(读数精度为0.0001g)称取硝酸银(AgNO3)固体质量为
(3)称量后,按如下实验步骤进行实验,A~E正确的实验顺序为

(4)配制过程中,下列情况会使配制结果偏低的是
①转移前,容量瓶内有蒸馏水
②移液时,未洗涤烧杯和玻璃棒
③移液时,烧杯中的溶液不慎洒到容量瓶外
④定容后经振荡、摇匀,静置,发现液面低于刻度线,再补加蒸馏水至度线
⑤定容时俯视刻度线
II.通过佛尔哈德返滴定法,用上述配制的
 标准溶液测定磷化钠待测液中I元素的含量,实验步骤如下:
标准溶液测定磷化钠待测液中I元素的含量,实验步骤如下:①取10mL碘化钠待测液于形瓶中,加稀硝酸至溶液显酸性;
②向锥形瓶中加入0.1000mol/L的
 溶液50.00mL,使
溶液50.00mL,使 完全沉淀;
完全沉淀;③滤去AgI沉淀,并用稀
 洗涤沉淀,洗涤液并滤液中:
洗涤沉淀,洗涤液并滤液中:④加入2~3滴铁铵矾[
 ]指示剂,用0.2000mol/L
]指示剂,用0.2000mol/L  标准溶液返滴定过量
标准溶液返滴定过量 至终点,记下所用体积为10.00mL。
至终点,记下所用体积为10.00mL。已知:i.
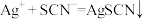 (白色沉淀)
(白色沉淀)ii.达到化学计量点时,微过量的
 与
与 生成红色
生成红色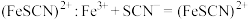 (红色)
(红色)(5)步骤④中指示剂必须在加入过量的
 后加入的原因是:
后加入的原因是:(6)碘化钠待测液中
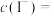
您最近半年使用:0次
2021-10-17更新
|
286次组卷
|
2卷引用:河北省秦皇岛市昌黎汇文二中2022届高三9月月考化学试卷
名校
解题方法
9 . 环境问题是广大群众关注的热点话题之一,化工厂排放的废水、废渣一般利用化学原理可以进行排放物达标检测与无害化处理。某皮革厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如图:

已知:①酸浸后的溶液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
(1)如需配制480mL酸浸环节所需的硫酸,需要用量筒量取18.4mol·L-1的浓硫酸__________ mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需哪些仪器:__________ 。
(2)经氧化环节滤液I中的Cr3+转化为Cr2O ,写出此反应的离子方程式:
,写出此反应的离子方程式:__________ 。
(3)调pH=8环节,既可以将溶液中某些杂质离子转化为沉淀,同时又可以将Cr2O 转化为某种含铬元素微粒,溶液颜色由橙色变为黄色,请解释该颜色变化的原因
转化为某种含铬元素微粒,溶液颜色由橙色变为黄色,请解释该颜色变化的原因__________ 。
(4)钠离子交换树脂的反应原理为Mn++nNaR⇌MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有__________ 。
(5)请写出流程中用SO2进行还原时发生反应的离子方程式:__________ 。
(6)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN—的浓度,可用标准AgNO3溶液滴定待测液,已知:
滴定时可选为滴定指示剂的是_____ (填编号),
A.NaCl B.K2CrO4 C.KI D.NaCN
如何确定该滴定过程的终点:__________ 。

已知:①酸浸后的溶液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
| 阳离子 | Fe3+ | Mg2+ | Аl3+ | Cr3+ |
| 沉淀完全时的pH | 3.7 | 11.1 | 5.4 | 9 |
| 沉淀溶解时的pH | — | — | >8溶解 | >9溶解 |
(1)如需配制480mL酸浸环节所需的硫酸,需要用量筒量取18.4mol·L-1的浓硫酸
(2)经氧化环节滤液I中的Cr3+转化为Cr2O
 ,写出此反应的离子方程式:
,写出此反应的离子方程式:(3)调pH=8环节,既可以将溶液中某些杂质离子转化为沉淀,同时又可以将Cr2O
 转化为某种含铬元素微粒,溶液颜色由橙色变为黄色,请解释该颜色变化的原因
转化为某种含铬元素微粒,溶液颜色由橙色变为黄色,请解释该颜色变化的原因(4)钠离子交换树脂的反应原理为Mn++nNaR⇌MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有
(5)请写出流程中用SO2进行还原时发生反应的离子方程式:
(6)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN—的浓度,可用标准AgNO3溶液滴定待测液,已知:
| 银盐性质 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 黄 | 白 | 砖红 | 白 |
| Ksp | 1.8×10-10 | 8.3×10-17 | 1.2×10-16 | 3.5×10-11 | 1.0×10-12 |
滴定时可选为滴定指示剂的是
A.NaCl B.K2CrO4 C.KI D.NaCN
如何确定该滴定过程的终点:
您最近半年使用:0次
2021-07-14更新
|
502次组卷
|
5卷引用:2021年河北省高考化学试卷变式题10-18题
10 . 新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测定某橙汁中维生素C的含量,其化学方程式如图:

下列说法正确的是

下列说法正确的是
| A.上述反应为取代反应 |
| B.维生素C的分子式为C6H10O6 |
| C.维生素C在酸性条件下水解只得到1种产物 |
| D.滴定时碘水应放在碱式滴定管中 |
您最近半年使用:0次



