名校
1 . 电子晶体是原子或离子在同一平面上整齐排列的二维晶体,也称为维格纳晶体,通常用于制造新型半导体。氮化钙(Ca3N2)是一种电子晶体,具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于新型半导体陶瓷工业等领域。氮化钙在空气中会被氧化,遇水强烈水解,产生刺激性气味气体。实验室设计如图装置用Ca与N2反应制备Ca3N2,并对Ca3N2纯度进行测定。回答下列问题:
I.Ca3N2的制备

(1)仪器a的名称为_____ ,E装置的主要作用是____ 。
(2)实验开始时应首先点燃____ (填“A”或“C”)处酒精灯,当观察到_____ 时点燃另一处酒精灯。
II.Ca3N2纯度的测定(已知所含的杂质只有单质钙)
(3)方案一:①按图1所示连接装置,检查装置气密性后加入试剂,打开K1,K2,通入N2,将装置内空气排尽;②测定虚线框内装置及试剂的质量m1;③____ ,用分液漏斗加入足量的水,至不再产生气体;④____ ;⑤再次测定虚线框内装置及试剂的质量m2。则产品中Ca3N2的质量分数表达式为____ 。

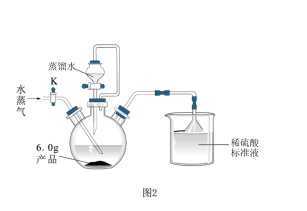
(4)方案二:按图2所示连接装置,检查装置气密性后加入试剂。打开分液漏斗活塞向三颈烧瓶中加入蒸馏水,打开K持续通入水蒸气,将产生的氨气全部蒸出,并用100mL1.00mol•L-1稀硫酸标准液完全吸收(液体体积变化忽略不计)。从烧杯中量取10.00mL吸收液注入锥形瓶中,用1.00mol•L-1的NaOH标准溶液滴定过量的稀硫酸,到终点时消耗12.20mLNaOH溶液。则产品中Ca3N2的质量分数为____ 。
I.Ca3N2的制备

(1)仪器a的名称为
(2)实验开始时应首先点燃
II.Ca3N2纯度的测定(已知所含的杂质只有单质钙)
(3)方案一:①按图1所示连接装置,检查装置气密性后加入试剂,打开K1,K2,通入N2,将装置内空气排尽;②测定虚线框内装置及试剂的质量m1;③

(4)方案二:按图2所示连接装置,检查装置气密性后加入试剂。打开分液漏斗活塞向三颈烧瓶中加入蒸馏水,打开K持续通入水蒸气,将产生的氨气全部蒸出,并用100mL1.00mol•L-1稀硫酸标准液完全吸收(液体体积变化忽略不计)。从烧杯中量取10.00mL吸收液注入锥形瓶中,用1.00mol•L-1的NaOH标准溶液滴定过量的稀硫酸,到终点时消耗12.20mLNaOH溶液。则产品中Ca3N2的质量分数为

您最近半年使用:0次
2022-10-01更新
|
180次组卷
|
4卷引用:内蒙古自治区部分学校2023届高三上学期9月联考化学试题
名校
解题方法
2 . 滴定是一种定量分析的手段,也是一种重要的化学实验操作。
I.酸碱中和滴定是最基本的滴定方法。现用0.1000mol·L-1NaOH标准溶液来测定某盐酸的浓度。有以下实验操作:
①向润洗过的碱式滴定管中加入0.1000mol·L-1的NaOH标准溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”刻度或“0”刻度以下的某刻度,并记录读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液;
⑤用NaOH标准溶液滴定至终点,记下滴定管液面读数;
⑥重复以上滴定操作2~3次。
请回答下列问题:
(1)在使用滴定管前首先要进行的操作是_______ ,滴定管盛装好NaOH溶液后排气泡,图1中排气泡正确的操作是_______ (填序号)。

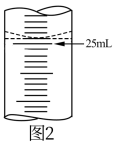
(2)①若甲学生在实验过程中,记录滴定前碱式滴定管内液面读数为4.80mL,滴定后液面如图2,则此时消耗标准溶液的体积为_______ 。
②乙学生做了三组平行实验,滴定并记录V(NaOH)的初、终读数,数据记录如表所示:
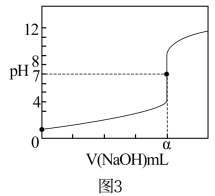
利用手持技术测得滴定过程中溶液pH随加入氢氧化钠溶液体积的变化曲线如图3所示,则a_______ (填“>”、“<”或“=”)20.02。
II.氧化还原滴定实验(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)与酸碱中和滴定类似。测血钙的含量时,进行如下实验:
①将2.00mL血液用蒸馏水稀释后,向其中加入足量草酸铵[(NH4)2C2O4]晶体,反应生成CaC2O4沉淀,过滤后,将沉淀用足量稀硫酸处理得H2C2O4溶液;
②将①得到的H2C2O4溶液装入锥形瓶内,再用1.0×10-4mol·L-1酸性KMnO4溶液滴定,达到终点时用去KMnO4溶液的体积为20.00mL。
(3)用酸性KMnO4溶液滴定H2C2O4的反应的离子方程式为_______ 。
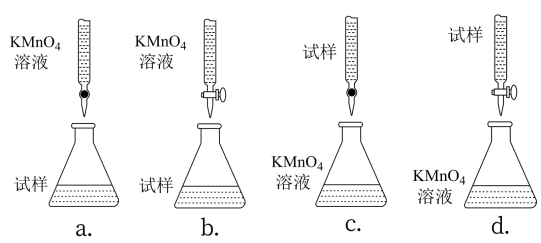
(4)实验中选用的滴定方式合理的是_______ (填字母序号)。(夹持部分略去)
(5)用酸性KMnO4溶液滴定所得H2C2O4溶液,是否需要加入指示剂?_______ (填“是”或“否”),若是,请说明理由;若否请说明判断滴定终点的方法:_______ 。
(6)通过计算可得,该血液中钙的含量为_______ mg·mL-1。
I.酸碱中和滴定是最基本的滴定方法。现用0.1000mol·L-1NaOH标准溶液来测定某盐酸的浓度。有以下实验操作:
①向润洗过的碱式滴定管中加入0.1000mol·L-1的NaOH标准溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”刻度或“0”刻度以下的某刻度,并记录读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液;
⑤用NaOH标准溶液滴定至终点,记下滴定管液面读数;
⑥重复以上滴定操作2~3次。
请回答下列问题:
(1)在使用滴定管前首先要进行的操作是



(2)①若甲学生在实验过程中,记录滴定前碱式滴定管内液面读数为4.80mL,滴定后液面如图2,则此时消耗标准溶液的体积为
②乙学生做了三组平行实验,滴定并记录V(NaOH)的初、终读数,数据记录如表所示:
| 滴定次数 | 1 | 2 | 3 |
| V(HCl)/mL | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.20 |
| V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.22 |
II.氧化还原滴定实验(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)与酸碱中和滴定类似。测血钙的含量时,进行如下实验:
①将2.00mL血液用蒸馏水稀释后,向其中加入足量草酸铵[(NH4)2C2O4]晶体,反应生成CaC2O4沉淀,过滤后,将沉淀用足量稀硫酸处理得H2C2O4溶液;
②将①得到的H2C2O4溶液装入锥形瓶内,再用1.0×10-4mol·L-1酸性KMnO4溶液滴定,达到终点时用去KMnO4溶液的体积为20.00mL。
(3)用酸性KMnO4溶液滴定H2C2O4的反应的离子方程式为
(4)实验中选用的滴定方式合理的是

(5)用酸性KMnO4溶液滴定所得H2C2O4溶液,是否需要加入指示剂?
(6)通过计算可得,该血液中钙的含量为
您最近半年使用:0次
2022-01-15更新
|
168次组卷
|
2卷引用:内蒙古兴安盟乌兰浩特市第一中学2022-2023学年高二上学期期中考试化学试题
3 . NOx含量的测定,是将气体样品通入适量酸化的H2O2溶液中,使NOx完全被氧化成NO3-,加水稀释,量取该溶液,加入FeSO4标准溶液(过量),充分反应后,用K2Cr2O7标准溶液滴定剩余的Fe2+下列说法不正确的是
A.NO被H2O2氧化为 的离子方程式为2NO+3H2O2=2H++2 的离子方程式为2NO+3H2O2=2H++2 +2H2O +2H2O |
| B.滴定操作使用的玻璃仪器有酸式滴定管 |
| C.若FeSO4标准溶液部分变质,会使测定结果偏高 |
| D.气体样品中混有空气,测定结果会偏高 |
您最近半年使用:0次
名校
解题方法
4 . 化工原料水合肼(N2H4·H2O)是一种强还原性的碱性液体。
Ⅰ.实验室用下图装置制备水合肼(N2H4·H2O)。
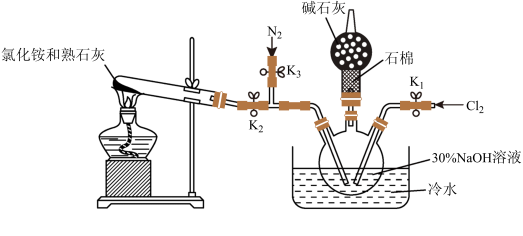
实验步骤:关闭K2、K3,打开K1,制备 NaClO;关闭K1、K2,打开K3,通入N2一段时间;关闭K3,打开K2,点燃酒精灯。回答下列问题:
(1)盛放碱石灰的仪器的名称为___________________ 。
(2)配制30%NaOH溶液时,所需玻璃仪器有烧杯、玻璃棒、胶头滴管和_________ 。
(3)步骤2中通入N2一段时间的原因是____________________________________ 。
(4)水槽中放入冷水的目的是_____________________________________________ 。
(5)NH3与 NaClO反应生成N2H4·H2O的化学方程式为_______________________ 。
Ⅱ.已知:N2H4·H2O+2I2=N2↑+4HI+H2O,测定水合肼粗产品的纯度步骤如下:
a.称取N2H4·H2O粗产品(其它杂质不与I2反应)2.000g。
b.加水配成250.00mL溶液。
c.移出25.00mL置于锥形瓶中,滴加几滴淀粉溶液。
d.用0.3000mol·L-1的碘标准溶液进行滴定。
e.重复上述操作两次。三次测定数据如下表:
f.数据处理。
(6)碘标准溶液盛放在____________ (填“酸式”或“碱式”)滴定管中。在滴定管中装入碘标准溶的前一步,应进行的操作为_________ ,达到终点的现象是__________ 。
(7)消耗的碘标准溶平均体积为______ mL,粗产品中水合肼的质量分数为______ 。
(8)判断下列操作对测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①若在配制碘标准溶液时,烧杯中的溶液有少量溅出,则测定结果___________ 。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果___________ 。
Ⅰ.实验室用下图装置制备水合肼(N2H4·H2O)。

实验步骤:关闭K2、K3,打开K1,制备 NaClO;关闭K1、K2,打开K3,通入N2一段时间;关闭K3,打开K2,点燃酒精灯。回答下列问题:
(1)盛放碱石灰的仪器的名称为
(2)配制30%NaOH溶液时,所需玻璃仪器有烧杯、玻璃棒、胶头滴管和
(3)步骤2中通入N2一段时间的原因是
(4)水槽中放入冷水的目的是
(5)NH3与 NaClO反应生成N2H4·H2O的化学方程式为
Ⅱ.已知:N2H4·H2O+2I2=N2↑+4HI+H2O,测定水合肼粗产品的纯度步骤如下:
a.称取N2H4·H2O粗产品(其它杂质不与I2反应)2.000g。
b.加水配成250.00mL溶液。
c.移出25.00mL置于锥形瓶中,滴加几滴淀粉溶液。
d.用0.3000mol·L-1的碘标准溶液进行滴定。
e.重复上述操作两次。三次测定数据如下表:
| 实验序号 | 1 | 2 | 3 |
| 消耗碘标准溶体积/mL | 20.24 | 20.02 | 19.98 |
f.数据处理。
(6)碘标准溶液盛放在
(7)消耗的碘标准溶平均体积为
(8)判断下列操作对测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①若在配制碘标准溶液时,烧杯中的溶液有少量溅出,则测定结果
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果
您最近半年使用:0次
2020-06-03更新
|
334次组卷
|
5卷引用:内蒙古赤峰第二实验中学2021届高三模拟考试(一)化学试题
内蒙古赤峰第二实验中学2021届高三模拟考试(一)化学试题天津市和平区2020届高三一模化学试题(已下线)第25讲 常用的实验仪器-2021年高考化学一轮复习名师精讲练(已下线)2021年秋季高三化学开学摸底考试卷01(山东专用)山东省潍坊市临朐县第一中学2021-2022学年高三上学期10月月考化学试题
名校
解题方法
5 . (1)氢氧化钡是一种使用广泛的化学试剂。某课外小组通过下列实验测定某试样中Ba(OH)2·8H2O的含量。称取3.50g试样溶于蒸馏水配成100mL溶液,从中取出10.00mL溶液于锥形瓶中,加2滴指示剂,用0.1000mol/LHCl标准溶液滴定至终点,共消耗标准液20.00mL(杂质不与酸反应),求试样中氢氧化钡的物质的量为___ ;试样中Ba(OH)2·8H2O的质量分数为___ 。
(2)维尔纳配合物M是一种橙黄色单斜晶体,该晶体以浓氨水、双氧水、CoCl2·6H2O、NH4Cl为原料在加热条件下通过活性炭的催化来合成。为探究该晶体的组成,设计了如下图实验:
有一个步骤是氮的测定:准确称取一定量橙黄色晶体,加入适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品中的氨全部蒸出,用500.00mL7.0mol/L的盐酸溶液吸收,吸收结束后量取吸收液25.00mL,用2.00mol/L的NaOH溶液滴定过量的盐酸,终点消耗NaOH溶液12.50mL。
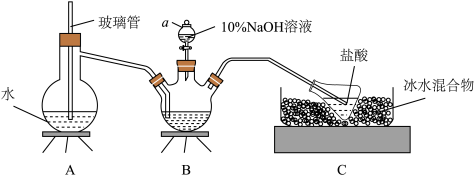
①上述装置A中,玻璃管的作用是__ ;
②装置A、B三脚架处应放置一个酒精灯作为热源,酒精灯应放置在__ (填“A”或“B”)处。
③步骤一所称取的样品中含氮的质量为__ g(计算结果保留2位有效数字)
④有同学提出装置C中所用盐酸的浓度过大易挥发,会造成测得氮的含量结果将__ (填“偏高”“偏低”或“无影响”)。
(2)维尔纳配合物M是一种橙黄色单斜晶体,该晶体以浓氨水、双氧水、CoCl2·6H2O、NH4Cl为原料在加热条件下通过活性炭的催化来合成。为探究该晶体的组成,设计了如下图实验:
有一个步骤是氮的测定:准确称取一定量橙黄色晶体,加入适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品中的氨全部蒸出,用500.00mL7.0mol/L的盐酸溶液吸收,吸收结束后量取吸收液25.00mL,用2.00mol/L的NaOH溶液滴定过量的盐酸,终点消耗NaOH溶液12.50mL。

①上述装置A中,玻璃管的作用是
②装置A、B三脚架处应放置一个酒精灯作为热源,酒精灯应放置在
③步骤一所称取的样品中含氮的质量为
④有同学提出装置C中所用盐酸的浓度过大易挥发,会造成测得氮的含量结果将
您最近半年使用:0次
名校
解题方法
6 . “中和滴定”原理在实际生产生活中应用广泛。用 可定量测定CO的含量,该反应原理为
可定量测定CO的含量,该反应原理为 ,其实验步骤如下:
,其实验步骤如下:
①取200 mL(标准状况)含有CO的某气体样品通过盛有足量 的硬质玻璃管中在170℃下充分反应:
的硬质玻璃管中在170℃下充分反应:
②用酒精溶液充分溶解产物 ,配制100 mL溶液;
,配制100 mL溶液;
③量取步骤②中溶液20.00 mL于锥形瓶中,然后用 的
的 标准溶液滴定,发生反应为
标准溶液滴定,发生反应为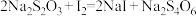 。消耗标准
。消耗标准 溶液的体积如表所示。
溶液的体积如表所示。
(1)步骤②中配制100 mL待测液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和________ 。
(2) 标准液应装在
标准液应装在________ (填“酸式”“碱式”)滴定管中。
(3)指示剂应选用________ ,判断达到滴定终点的现象是________ 。
(4)气体样品中CO的体积分数为________ (已知气体样品中其他成分不与 反应)
反应)
(5)下列操作会造成所测CO的体积分数偏大的是________ (填字母)。
a.滴定终点时仰视读数
b.滴定前尖嘴外无气泡,滴定后有气泡
C.配制100 mL待测溶液时,有少量溅出。
d.锥形瓶用待测溶液润洗
 可定量测定CO的含量,该反应原理为
可定量测定CO的含量,该反应原理为 ,其实验步骤如下:
,其实验步骤如下:①取200 mL(标准状况)含有CO的某气体样品通过盛有足量
 的硬质玻璃管中在170℃下充分反应:
的硬质玻璃管中在170℃下充分反应:②用酒精溶液充分溶解产物
 ,配制100 mL溶液;
,配制100 mL溶液;③量取步骤②中溶液20.00 mL于锥形瓶中,然后用
 的
的 标准溶液滴定,发生反应为
标准溶液滴定,发生反应为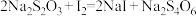 。消耗标准
。消耗标准 溶液的体积如表所示。
溶液的体积如表所示。| 第一次 | 第二次 | 第三次 | |
| 滴定前读数/mL | 1.10 | 1.50 | 2.40 |
| 滴定后读数/mL | 21.00 | 21.50 | 22.50 |
(2)
 标准液应装在
标准液应装在(3)指示剂应选用
(4)气体样品中CO的体积分数为
 反应)
反应)(5)下列操作会造成所测CO的体积分数偏大的是
a.滴定终点时仰视读数
b.滴定前尖嘴外无气泡,滴定后有气泡
C.配制100 mL待测溶液时,有少量溅出。
d.锥形瓶用待测溶液润洗
您最近半年使用:0次
2020-02-26更新
|
214次组卷
|
2卷引用:内蒙古通辽市开鲁县第一中学2020-2021学年高二上学期第一次月考化学试题
名校
7 . 用沉淀滴定法快速测定NaI等碘化物溶液中c(I-),实验过程包括准备标准溶液和滴定待测溶液。
Ⅰ.准备标准溶液
a.准确称取AgNO3基准物4.2468g(0.0250mol)后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100mL0.1000mol·L-1NH4SCN标准溶液,备用。
Ⅱ.滴定的主要步骤
a.取待测NaI溶液25.00mL于锥形瓶中。
b.加入25.00mL0.1000mol·L-1AgNO3溶液(过量),使I-完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示剂。
d.用0.1000mol·L-1NH4SCN溶液滴定过量的Ag+,已知AgSCN为白色沉淀。
e.重复上述操作两次到三次测定数据如下表:
f.数据处理。
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有________ 。制得AgNO3溶液的浓度为__________________ ;
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是________________________ 。
(3)滴定应在pH<0.5的条件下进行,其原因是________ 。
(4)过程Ⅱ中b和c两步操作是否可以颠倒________ ,说明理由:___________ 。
(5)达到滴定终点时的现象________________________ 。
(6)由上述实验数据测得c(I-)=________ mol·L-1。
(7)若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则对c(I-)测定结果的影响________ (填“偏高”“偏低”或“无影响”)。
Ⅰ.准备标准溶液
a.准确称取AgNO3基准物4.2468g(0.0250mol)后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100mL0.1000mol·L-1NH4SCN标准溶液,备用。
Ⅱ.滴定的主要步骤
a.取待测NaI溶液25.00mL于锥形瓶中。
b.加入25.00mL0.1000mol·L-1AgNO3溶液(过量),使I-完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示剂。
d.用0.1000mol·L-1NH4SCN溶液滴定过量的Ag+,已知AgSCN为白色沉淀。
e.重复上述操作两次到三次测定数据如下表:
| 实验序号 | 1 | 2 | 3 |
| 消耗NH4SCN标准溶液体积/mL | 10.24 | 10.02 | 9.98 |
f.数据处理。
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有
(2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是
(3)滴定应在pH<0.5的条件下进行,其原因是
(4)过程Ⅱ中b和c两步操作是否可以颠倒
(5)达到滴定终点时的现象
(6)由上述实验数据测得c(I-)=
(7)若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则对c(I-)测定结果的影响
您最近半年使用:0次
2019-04-25更新
|
370次组卷
|
2卷引用:内蒙古集宁一中(西校区)2020届高三上学期第二次月考理综化学试题
真题
名校
8 . 下列实验装置(固定装置略去)和操作正确的是
A.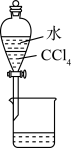 分离CCl4和水 分离CCl4和水 | B.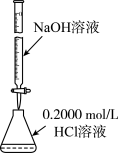 酸碱中和滴定 酸碱中和滴定 |
C.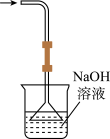 吸收HCl尾气 吸收HCl尾气 | D. 中和热的测定 中和热的测定 |
您最近半年使用:0次
2019-01-30更新
|
1692次组卷
|
14卷引用:内蒙古阿拉善盟2020届高三上学期月考化学试题
内蒙古阿拉善盟2020届高三上学期月考化学试题2010年普通高等学校招生全国统一考试理综化学部分(重庆卷)2010年高考化学试题分项专题十五 化学实验(已下线)2010年云南省玉溪一中高二下学期期末考试化学试题(已下线)2010-2011学年浙江省瑞安中学高二下学期期中考试化学试卷(已下线)2010-2011学年江西省吉安一中高二下学期第二次段考化学试卷(已下线)2012年鲁科版高中化学选修6 1从茶叶中撮咖啡因练习卷2017届宁夏育才中学高三上月考四化学试卷黑龙江省哈尔滨师范大学附属中学2017届高三第三次模拟考试化学试题宁夏银川市第二中学2017届高三下学期第三次模拟考试理综化学试题黑龙江省哈尔滨师范大学附属中学2017届高三第三次模拟考试理科综合化学试题【全国百强校】广西壮族自治区桂林市第十八中学2019届高三上学期第一次月考化学试题陕西省榆林市第十二中学2021届高三上学期第二次月考化学试题广东省江门市第二中学2020-2021学年高二上学期第二次考试(期中)化学试题
名校
9 . HIn在水溶液中存在以下电离平衡:HIn(红色) H+ + In-(黄色),故可用作酸碱指示剂。浓度为0.02 mol/L的下列各溶液:①盐酸,②石灰水,③NaCl溶液,④NaHSO4溶液,⑤Na2CO3溶液,⑥氨水,其中能使指示剂显红色的是
H+ + In-(黄色),故可用作酸碱指示剂。浓度为0.02 mol/L的下列各溶液:①盐酸,②石灰水,③NaCl溶液,④NaHSO4溶液,⑤Na2CO3溶液,⑥氨水,其中能使指示剂显红色的是
 H+ + In-(黄色),故可用作酸碱指示剂。浓度为0.02 mol/L的下列各溶液:①盐酸,②石灰水,③NaCl溶液,④NaHSO4溶液,⑤Na2CO3溶液,⑥氨水,其中能使指示剂显红色的是
H+ + In-(黄色),故可用作酸碱指示剂。浓度为0.02 mol/L的下列各溶液:①盐酸,②石灰水,③NaCl溶液,④NaHSO4溶液,⑤Na2CO3溶液,⑥氨水,其中能使指示剂显红色的是| A.①④⑤ | B.②⑤⑥ | C.①④ | D.②③⑥ |
您最近半年使用:0次
2018-12-22更新
|
247次组卷
|
11卷引用:内蒙古杭锦后旗奋斗中学2016-2017学年高二下学期期中考试化学试题
内蒙古杭锦后旗奋斗中学2016-2017学年高二下学期期中考试化学试题内蒙古自治区包头市第六中学2018-2019学年高二上学期期中考试化学试题(已下线)2010—2011年福建安溪一中、惠安一中、养正中学高二上学期期末联考化学卷(已下线)2011-2012学年江西省新余九中高二上学期期中考试化学试卷(已下线)2012-2013学年陕西省宝鸡中学高二第一次月考化学试卷(已下线)2014届四川省雅安中学高二下学期4月月考化学试卷(已下线)2013-2014四川省雅安中学高二4月月考化学试卷2015-2016学年宁夏中卫一中高二上第四次月考化学试卷河北省唐山市开滦第二中学2017-2018学年高二上学期期中考试化学试题陕西省黄陵中学2018-2019学年高二(普通班)上学期期末考试化学试题黑龙江省绥化市青冈县第一中学2019-2020学年高二上学期(A)班月考化学试题
10 . 实验是化学学习中非常重要的内容,根据下面两个实验回答问题。
(一)某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
(查阅资料)25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
(实验探究)向2支均盛有1mL0.1mol/LMgCl2溶液的试管中分别加入2滴2mol/L NaOH溶液,制得等量Mg(OH)2沉淀。
(1)分别向两支试管中加入不同试剂,记录实验现象如表:(表中填空填下列选项中字母代号)
A.白色沉淀转化为红褐色沉淀 B.白色沉淀不发生改变
C.红褐色沉淀转化为白色沉淀 D.白色沉淀溶解,得无色溶液
(2)同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的溶解平衡正向移动。
猜想2:____________________________________________________________ 。
(3)为验证猜想,同学们取少量相同质量的氢氧化镁盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解。该实验证明猜想正确的是____ (填 “1”或“2”)。
(二)测定某品牌的碘盐(含有碘酸钾)中碘元素的百分含量。准确称取5.000 0 g该碘盐,溶于蒸馏水,然后与足量的KI溶液在酸性条件下混合(发生的反应为KIO3+3H2SO4+5KI===3K2SO4+3I2+3H2O),充分反应后将混合溶液稀释至250 mL,然后取25.00 mL用5.0×10-4 mol·L-1的Na2S2O3标准溶液进行滴定(用淀粉作指示剂,反应为I2+2S2O32-===2I-+S4O62-)。有关实验数值如下表所示。
该碘盐中碘元素的百分含量为________ 。(保留三位有效数字)下列操作中,会导致所测得的碘元素的百分含量偏大的是________ 。
a.滴定终点时,俯视刻度
b.没有用Na2S2O3标准溶液润洗相应的滴定管
c.锥形瓶中有少量的蒸馏水
(一)某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
(查阅资料)25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
(实验探究)向2支均盛有1mL0.1mol/LMgCl2溶液的试管中分别加入2滴2mol/L NaOH溶液,制得等量Mg(OH)2沉淀。
(1)分别向两支试管中加入不同试剂,记录实验现象如表:(表中填空填下列选项中字母代号)
| 试管编号 | 加入试剂 | 实验现象 |
| Ⅰ | 2滴0.1mol/LFeCl3溶液 | ① |
| Ⅱ | 4mL2mol/LNH4Cl溶液 | ② |
A.白色沉淀转化为红褐色沉淀 B.白色沉淀不发生改变
C.红褐色沉淀转化为白色沉淀 D.白色沉淀溶解,得无色溶液
(2)同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的溶解平衡正向移动。
猜想2:
(3)为验证猜想,同学们取少量相同质量的氢氧化镁盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解。该实验证明猜想正确的是
(二)测定某品牌的碘盐(含有碘酸钾)中碘元素的百分含量。准确称取5.000 0 g该碘盐,溶于蒸馏水,然后与足量的KI溶液在酸性条件下混合(发生的反应为KIO3+3H2SO4+5KI===3K2SO4+3I2+3H2O),充分反应后将混合溶液稀释至250 mL,然后取25.00 mL用5.0×10-4 mol·L-1的Na2S2O3标准溶液进行滴定(用淀粉作指示剂,反应为I2+2S2O32-===2I-+S4O62-)。有关实验数值如下表所示。
| 滴定次数 | 待测液的体积(mL) | 滴定前的读数(mL) | 滴定后的读数(mL) |
| 第一次 | 25.00 | 0.00 | 15.90 |
| 第二次 | 25.00 | 0.00 | 14.99 |
| 第三次 | 25.00 | 0.00 | 15.01 |
该碘盐中碘元素的百分含量为
a.滴定终点时,俯视刻度
b.没有用Na2S2O3标准溶液润洗相应的滴定管
c.锥形瓶中有少量的蒸馏水
您最近半年使用:0次
2018-11-12更新
|
330次组卷
|
2卷引用:内蒙古通辽实验中学2018-2019学年高二上学期期中考试化学试题



