1 . 过氧化钙(CaO2)广泛应用于水产养殖、污水处理,是优良的供氧剂。
实验探究一:过氧化钙与水反应除生成氧气外,还生成什么物质?
(1)进行实验:取适量过氧化钙放入试管中加适量水,向试管中滴加酚酞溶液,液体变成红色,说明生成了Ca(OH)2,写出该反应的化学方程式:______________ 。
(2)此供氧剂长期暴露在空气中,会变质生成CaCO3,为检验此供氧剂是否变质,可向其中加入稀盐酸,若观察到有气泡生成,则判断此供氧剂已变质。有同学不认同上述方案的理由是_______________________ 。
实验探究二:测定久置过氧化钙纯度。
方案一:通过测定产生氧气的体积,最终计算出供氧剂中过氧化钙的含量。
(3)取一定质量的供氧剂溶于水,按照图1装置进行装配。读出体积时要注意:①该反应为放热反应,待气体恢复至室温再读数;②____________________________ ;③视线和凹液面最低处保持水平再读数。
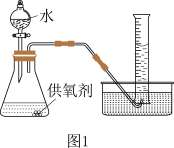
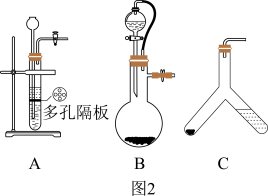
(4)用此装置测得的含量会偏大,原因是________________ ,为了避免此误差可将发生装置换成图2中的装置B或C。
方案二:把样品中的过氧化钙转化为碳酸钙,通过测定碳酸钙沉淀的质量,根据钙元素守恒,求得过氧化钙的质量,具体流程如图3。
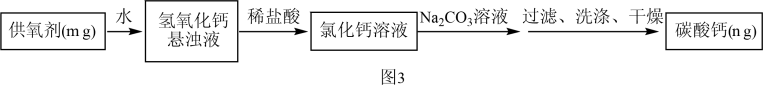
(5)滴加的Na2CO3溶液要过量的原因是_________________________ 。
实验探究一:过氧化钙与水反应除生成氧气外,还生成什么物质?
(1)进行实验:取适量过氧化钙放入试管中加适量水,向试管中滴加酚酞溶液,液体变成红色,说明生成了Ca(OH)2,写出该反应的化学方程式:
(2)此供氧剂长期暴露在空气中,会变质生成CaCO3,为检验此供氧剂是否变质,可向其中加入稀盐酸,若观察到有气泡生成,则判断此供氧剂已变质。有同学不认同上述方案的理由是
实验探究二:测定久置过氧化钙纯度。
方案一:通过测定产生氧气的体积,最终计算出供氧剂中过氧化钙的含量。
(3)取一定质量的供氧剂溶于水,按照图1装置进行装配。读出体积时要注意:①该反应为放热反应,待气体恢复至室温再读数;②

(4)用此装置测得的含量会偏大,原因是

方案二:把样品中的过氧化钙转化为碳酸钙,通过测定碳酸钙沉淀的质量,根据钙元素守恒,求得过氧化钙的质量,具体流程如图3。

(5)滴加的Na2CO3溶液要过量的原因是
您最近一年使用:0次
2 . 为检验某漂白粉是否变质,进行下列探究实验:
实验1:取5g漂白粉样品于烧杯中,加足量蒸馏水并搅拌,观察到有固体不溶解。
实验2:静置,取少量实验1的上层清液于试管中。放入红色花瓣,观察到花瓣褪色。
实验3:另取5g漂白粉样品于试管中,滴加浓盐酸,观察到有气体产生。
下列说法正确的是
实验1:取5g漂白粉样品于烧杯中,加足量蒸馏水并搅拌,观察到有固体不溶解。
实验2:静置,取少量实验1的上层清液于试管中。放入红色花瓣,观察到花瓣褪色。
实验3:另取5g漂白粉样品于试管中,滴加浓盐酸,观察到有气体产生。
下列说法正确的是
| A.工业上用氯气和澄清石灰水制取漂白粉 |
| B.实验1和实验2说明漂白粉没有变质 |
| C.实验3中产生的气体只有氯气 |
D.实验3中下列反应的电子转移可表示为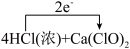 =CaCl2+2Cl2↑+2H2O =CaCl2+2Cl2↑+2H2O |
您最近一年使用:0次
2023-02-15更新
|
816次组卷
|
9卷引用:江苏省南京市2022-2023学年高一上学期期末学情调研测试化学试题
江苏省南京市2022-2023学年高一上学期期末学情调研测试化学试题(已下线)第07讲 氯气的性质和次氯酸-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)(已下线)专题05 氯及其化合物【考点清单】(讲+练)-2023-2024学年高一化学上学期期中考点大串讲(人教版2019必修第一册)(已下线)专题05 氯及其化合物【考题猜想】(10大题型)-2023-2024学年高一化学上学期期中考点大串讲(人教版2019必修第一册)辽宁省丹东市凤城市第一中学2023-2024学年高三上学期10月测试化学试题(已下线)专题04 氯气及氯的化合物-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)江苏省江都区大桥中学2023-2024学年高一上学期期末复习模拟测试化学试题安徽省六安市舒城晓天中学2023-2024学年高一上学期期中考试化学试卷贵州省遵义市桐梓县荣兴高级中学2023-2024学年高一上学期第四次月考化学试题
名校
解题方法
3 . 为探究H2O2、SO2、Br2的性质,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。

(1)在滴入浓硫酸之前要通入N2一段时间的目的是__________________________ 。
(2)该实验可以证明SO2具有_________ 性;H2O2的氧化性_________ Br2(填“强于”“弱于”)。
(3)B中红棕色褪去的原因_______________________________ ,B中重新变成红棕色的原因____________________________________ (均用离子方程式表示)。
(4)C中产生的白色沉淀是______ 。
(5)甲同学通过C中产生白色沉淀,得出结论:SO2能与BaCl2反应产生沉淀。乙同学认为不能得出此结论,并对实验进行了改进:在B和C之间增加盛放_________ 的洗气瓶。再次进行实验时,则C中未产生沉淀。
(6)为进一步研究SO2的性质,分别用煮沸和未煮沸过的蒸馏水配制Ba(NO3)2和BaCl2溶液,进行如下实验:
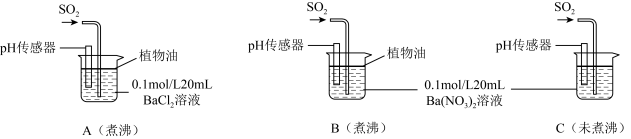
①实验A中,没有观察到白色沉淀,但pH传感器显示溶液呈酸性,原因是__________________ 。(用化学方程式表示)
②实验C中出现白色沉淀比实验B快很多。由此得出的结论是__________________ 。若实验B、C中通入足量的SO2后,溶液酸性:B_________ C(填“强于”“弱于”“等于”)。
(7)Na2SO3固体因贮放不慎发生变质。现取样品1.8克溶于水得溶液A,在A中加入足量BaCl2溶液,过滤得沉淀B,将沉淀B加入足量的稀硫酸后,沉淀不仅不消失,反而增加了0.16g(假如沉淀完全转化)。样品中Na2SO3的质量分数是___________________ 。

| 实验操作 | 实验现象 |
| i.打开弹簧夹,通入N2一段时间,关闭弹簧夹,打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
| ⅱ.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
| ⅲ.打开B中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(2)该实验可以证明SO2具有
(3)B中红棕色褪去的原因
(4)C中产生的白色沉淀是
(5)甲同学通过C中产生白色沉淀,得出结论:SO2能与BaCl2反应产生沉淀。乙同学认为不能得出此结论,并对实验进行了改进:在B和C之间增加盛放
(6)为进一步研究SO2的性质,分别用煮沸和未煮沸过的蒸馏水配制Ba(NO3)2和BaCl2溶液,进行如下实验:

①实验A中,没有观察到白色沉淀,但pH传感器显示溶液呈酸性,原因是
②实验C中出现白色沉淀比实验B快很多。由此得出的结论是
(7)Na2SO3固体因贮放不慎发生变质。现取样品1.8克溶于水得溶液A,在A中加入足量BaCl2溶液,过滤得沉淀B,将沉淀B加入足量的稀硫酸后,沉淀不仅不消失,反而增加了0.16g(假如沉淀完全转化)。样品中Na2SO3的质量分数是
您最近一年使用:0次
2020-01-18更新
|
649次组卷
|
3卷引用:广东省汕头市金山中学2019-2020学年高一上学期期末考试化学试题
4 . 小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”。
(1)实验前小明预测Fe2+既有还原性又有氧化性。你认为他预测的依据是_______________ 。
(2)小明欲用实验证明他的预测。实验室提供了下列试剂:3%的过氧化氢溶液、锌粒、铜片、0.1 mol·L-1氯化亚铁溶液、硫氰化钾溶液、新制氯水。
①若小明计划在0.1 mol·L-1氯化亚铁溶液滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应的离子方程式是______________________________ ,可能观察到的现象是溶液由浅绿色变为________ 色。
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选_________ 滴入小明所得的混合液中,并通过溶液出现______ 色的现象,证明小明的观点和实验方案都是正确的。
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入氯化亚铁溶液中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为__________ (填化学式)。
④实际上Fe2+的还原性较强,实验室的氯化亚铁溶液常因氧化而变质,除去杂质的方法是______ ,相关反应的离子方程式是_____________ 。
(1)实验前小明预测Fe2+既有还原性又有氧化性。你认为他预测的依据是
(2)小明欲用实验证明他的预测。实验室提供了下列试剂:3%的过氧化氢溶液、锌粒、铜片、0.1 mol·L-1氯化亚铁溶液、硫氰化钾溶液、新制氯水。
①若小明计划在0.1 mol·L-1氯化亚铁溶液滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应的离子方程式是
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入氯化亚铁溶液中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为
④实际上Fe2+的还原性较强,实验室的氯化亚铁溶液常因氧化而变质,除去杂质的方法是
您最近一年使用:0次
2018-05-06更新
|
434次组卷
|
7卷引用:贵州省遵义航天高级中学2017-2018学年高一下学期期中考试理科综合化学试题
贵州省遵义航天高级中学2017-2018学年高一下学期期中考试理科综合化学试题云南省彝良县民中2018-2019学年高一上学期12月份考试化学试题(已下线)专题10 性质探究类综合实验-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)陕西省渭南市华州区咸林中学2021-2022学年高一上学期第三阶段质量检测化学试题陕西省铜川市耀州中学2022-2023学年高一上学期期末考试化学试题作业(十八) 铁盐和亚铁盐河南省南阳市六校2023-2024学年高一上学期12月月考化学试题
解题方法
5 . 小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”。
(1)实验前小明预测说:Fe2+肯定既有还原性又有氧化性。你认为他预测的依据是:_____________ 。
(2)小明欲用实验证明他的预测。实验室提供了下列试剂:3%的H2O2溶液、锌粒、铜片、0.1mol·L-1FeCl2溶液、KSCN溶液、新制氯水。
①若小明计划在0.1mol·L-1FeCl2溶液滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应和现象是:_________________ 写离子方程式)、溶液由浅绿色变 ___________ 色。
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选__________ 滴入小明所得的混合液中,并通过溶液出现___________ 色的现象,证明小明的观点和实验方案都是正确的。
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入FeCl2溶液中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为:__________________ 。
(3)小明分析H2O2中氧元素显-1价(中间价),并提出疑问:H2O2与FeCl2的反应时,Fe2+还作氧化剂吗?
①请你为小明梳理相关问题:若Fe2+在反应中表现出氧化性应转化成_______ (填微粒符号,下同),若Fe2+在反应中表现出还原性应转化成__________ 。
②实际上Fe2+的还原性较强,实验室的FeCl2溶液常因氧化而变质。除杂的方法是:______________ ,相关反应的离子方程式:_______________ 。
(1)实验前小明预测说:Fe2+肯定既有还原性又有氧化性。你认为他预测的依据是:
(2)小明欲用实验证明他的预测。实验室提供了下列试剂:3%的H2O2溶液、锌粒、铜片、0.1mol·L-1FeCl2溶液、KSCN溶液、新制氯水。
①若小明计划在0.1mol·L-1FeCl2溶液滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应和现象是:
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入FeCl2溶液中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为:
(3)小明分析H2O2中氧元素显-1价(中间价),并提出疑问:H2O2与FeCl2的反应时,Fe2+还作氧化剂吗?
①请你为小明梳理相关问题:若Fe2+在反应中表现出氧化性应转化成
②实际上Fe2+的还原性较强,实验室的FeCl2溶液常因氧化而变质。除杂的方法是:
您最近一年使用:0次
2016-12-09更新
|
560次组卷
|
3卷引用:2015-2016学年四川省雅安市天全中学高一上学期12月月考化学试卷
2015-2016学年四川省雅安市天全中学高一上学期12月月考化学试卷(已下线)第03章 铁 金属材料(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)陕西省榆林市第十二中学2021届高三上学期第一次月考化学试题
解题方法
6 . 为实现金属钠在隔绝空气条件下与水反应并收集生成的气体,某研究性学习小组设计了如图所示的发生装置。

(1)Y可以选用______________ (填序号)。
A.苯 B.饱和食盐水 C.四氯化碳
(2)实验前检验该装置气密性的方法是____________________________________ 。
(3)钠能在 气体中燃烧。他们对钠在
气体中燃烧。他们对钠在 气体中燃烧后的产物中的自色物质进行了如下探究:
气体中燃烧后的产物中的自色物质进行了如下探究:
【实验】将燃烧的钠迅速伸入盛满 的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上附着白色物质。
的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上附着白色物质。
【提出假设】
假设1:白色物质是 ,
,
假设2:白色物质是 ,
,
假设3:白色物质是_________________ 。
(4)【设计实验方案·验证假设】该小组对燃烧后的自色产物进行如下探究:
【思考与交流】
①甲同学认为白色物质有可能是氢氧化钠,你是否同意丙同学的观点?并简述理由:___________________ 。
②乙同学认为方案1得到的结论不正确,其理由是_________________ 。钠在二氧化碳中燃烧的化学方程式为____________________________________ 。

(1)Y可以选用
A.苯 B.饱和食盐水 C.四氯化碳
(2)实验前检验该装置气密性的方法是
(3)钠能在
 气体中燃烧。他们对钠在
气体中燃烧。他们对钠在 气体中燃烧后的产物中的自色物质进行了如下探究:
气体中燃烧后的产物中的自色物质进行了如下探究:【实验】将燃烧的钠迅速伸入盛满
 的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上附着白色物质。
的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上附着白色物质。【提出假设】
假设1:白色物质是
 ,
,假设2:白色物质是
 ,
,假设3:白色物质是
(4)【设计实验方案·验证假设】该小组对燃烧后的自色产物进行如下探究:
实验操作 | 实验现象 | 结论 | |
方案1 | 取少量白色产物于试管中,加入适量水,振荡,样品全部溶于水,向其中加入酚酞试液 | 溶液变成红色 | 白色物质为 |
方案2 | ①取少量白色产物于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的 溶液 溶液 | 出现白色沉淀 | |
| ②静置片刻,取上层清液于试管中,滴加酚酞试液 | 无明显现象 |
【思考与交流】
①甲同学认为白色物质有可能是氢氧化钠,你是否同意丙同学的观点?并简述理由:
②乙同学认为方案1得到的结论不正确,其理由是
您最近一年使用:0次
7 .  (三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。某小组为探究三草酸合铁酸钾的热分解产物,按如图所示装置进行实验。
(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。某小组为探究三草酸合铁酸钾的热分解产物,按如图所示装置进行实验。
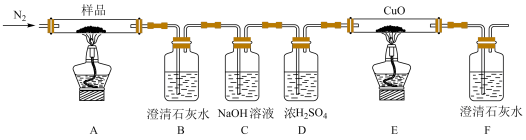
(1)通入氮气的目的是__________________________________________ 。
(2)实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有____________ 、____________ 。
(3)为防止倒吸,停止实验时应进行的操作是__________________________________________ 。
(4)样品完全分解后,装置A中的残留物含有FeO和 ,检验
,检验 存在的方法是:
存在的方法是:___________________________________________________ 。
 (三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。某小组为探究三草酸合铁酸钾的热分解产物,按如图所示装置进行实验。
(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。某小组为探究三草酸合铁酸钾的热分解产物,按如图所示装置进行实验。
(1)通入氮气的目的是
(2)实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有
(3)为防止倒吸,停止实验时应进行的操作是
(4)样品完全分解后,装置A中的残留物含有FeO和
 ,检验
,检验 存在的方法是:
存在的方法是:
您最近一年使用:0次
2020-09-15更新
|
527次组卷
|
5卷引用:鲁科版(2019)高一必修第一册第三章C 高考挑战区 过高考 3年真题强化闯关
鲁科版(2019)高一必修第一册第三章C 高考挑战区 过高考 3年真题强化闯关高一必修第一册(鲁科2019)第3章 第1节 铁的多样性 高考帮人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物(已下线)专题讲座(九) 化学实验中规范答题(精讲)-2022年一轮复习讲练测(已下线)第3讲 铁盐及其亚铁盐
2020高三·全国·专题练习
名校
解题方法
8 . K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]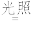 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为___ 。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按如图所示装置进行实验。

①通入氮气的目的是____ 。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有____ 、___ 。
③为防止倒吸,停止实验时应进行的操作是___ 。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是____ 。
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]
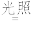 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为(2)某小组为探究三草酸合铁酸钾的热分解产物,按如图所示装置进行实验。

①通入氮气的目的是
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有
③为防止倒吸,停止实验时应进行的操作是
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是
您最近一年使用:0次
2020-12-09更新
|
638次组卷
|
5卷引用:专题讲座(九) 热点实验综合探究 (精讲)-2021年高考化学一轮复习讲练测
(已下线)专题讲座(九) 热点实验综合探究 (精讲)-2021年高考化学一轮复习讲练测专题9 第一~三单元综合拔高练-高中化学必修第二册苏教版2019四川省绵阳市南山中学实验学校2022届高三上学学期开学考试化学试题四川省泸县第四中学2021-2022学年高三上学期第二次月考理综化学试题(已下线)专题讲座(十)化学实验设计与探究(练) — 2022年高考化学一轮复习讲练测(新教材新高考)



