1 . 二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。某研究小组拟用下图装置测定SO2转化为SO3的转化率。(已知SO3熔点为16.8oC,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)】

(1)仪器a的名称是___________ 。
(2)B装置的作用是干燥SO2和O2、使SO2和O2两种气体混合均匀、___________ 。
(3)D中烧杯装的液体是___________ (填“热水”或“冰水”),其作用是___________ 。
(4)当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是___________ 。
(5)写出E中反应的离子方程式___________ 。
(6)实验结束后,若装置D增加的质量为72g,装置E中产生白色沉淀的质量为23.3 g,则此条件下二氧化硫的转化率是___________ 。
(7)为达同样目的,E中的Ba(NO3)2也可以用___________代替

(1)仪器a的名称是
(2)B装置的作用是干燥SO2和O2、使SO2和O2两种气体混合均匀、
(3)D中烧杯装的液体是
(4)当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是
(5)写出E中反应的离子方程式
(6)实验结束后,若装置D增加的质量为72g,装置E中产生白色沉淀的质量为23.3 g,则此条件下二氧化硫的转化率是
(7)为达同样目的,E中的Ba(NO3)2也可以用___________代替
| A.足量的饱和食盐水 |
| B.足量的BaCl2溶液 |
| C.足量的Ba(OH)2溶液 |
| D.足量的BaCl2和H2O2混合溶液 |
您最近一年使用:0次
2022-03-30更新
|
461次组卷
|
3卷引用:重庆市主城区六校2018-2019学年高一下学期期末联考化学试题
名校
解题方法
2 . 为探究SO2与Fe3+间是否发生氧化还原反应,按如图所示装置进行实验(夹持、加热仪器略),下列说法正确的是


| A.A中的反应仅体现了浓硫酸的氧化性 |
| B.试剂a为饱和NaHCO3溶液 |
| C.C中溶液pH降低,证明Fe3+氧化了SO2 |
| D.检验C中的溶液含有Fe2+,证明Fe3+氧化了SO2 |
您最近一年使用:0次
2022-02-22更新
|
651次组卷
|
10卷引用:北京市朝阳区六校2020届高三四月联考化学(B卷)试题
北京市朝阳区六校2020届高三四月联考化学(B卷)试题(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编 选择题:化学与生活 氧化还原反应 阿伏加德罗常数重庆市南开中学2020-2021学年高一下学期期中考试化学试题上海市静安区2021届高三一模化学试题(已下线)重点1 仪器组合型实验方案的设计与评价-2021年高考化学【热点·重点·难点】专练(新高考)(已下线)考向35 实验的方案设计与评价-备战2022年高考化学一轮复习考点微专题上海市杨浦高级中学2021-2022学年高一上学期期末考试化学试题贵州省贵阳市五校2021-2022学年高三下学期联考(五)理科综合化学试题湖南省株洲市第二中学2022届高三下学期期中考试化学试题 上海市大同中学2021-2022学年高一下学期期中考试化学试题
13-14高一上·河北石家庄·期中
名校
解题方法
3 . 如表是某城市场上销售的一种“加碘盐”包装上的部分文字说明。
回答下列问题:
(1)结合物质分类中的树状分类法,根据物质的组成对物质进行分类。在下列五种___ (填“混合物”“化合物”“盐”或“氧化物”)中与碘酸钾(KIO3)属于同类物质的是__ (填序号)。
①HIO3②NaIO3③KOH④I2O5⑤NaCl
(2)推测碘酸钾(KIO3)的物理性质:碘酸钾(KIO3)___ (填“能”或“不能”)溶于水;化学性质:碘酸钾(KIO3)在受热时___ (填“易分解”或“不易分解”)。
| 配料表 | 精制海盐、碘酸钾(KIO3) |
| 含碘量 | 20~40mg·kg-1 |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹调时待食品熟后加入碘盐 |
回答下列问题:
(1)结合物质分类中的树状分类法,根据物质的组成对物质进行分类。在下列五种
①HIO3②NaIO3③KOH④I2O5⑤NaCl
(2)推测碘酸钾(KIO3)的物理性质:碘酸钾(KIO3)
您最近一年使用:0次
2021-10-20更新
|
335次组卷
|
13卷引用:2012-2013学年河北省石家庄市第二实验中学高一上学期期中考化学卷
(已下线)2012-2013学年河北省石家庄市第二实验中学高一上学期期中考化学卷(已下线)2013-2014学年甘肃省嘉峪关市一中高一上学期期中考试化学试卷(已下线)2014-2015学年甘肃省天水市秦安县二中高一上学期期中考试化学试卷(已下线)2014-2015学年甘肃省天水市秦安县二中高一上学期期中考试化学试卷2015-2016学年福建省莆田二十五中高一上学期期中测试化学试卷2015-2016学年吉林松原油田高中高一下期初考试化学试卷江苏省宿迁市泗阳县桃州中学2020-2021学年高一上学期第一次调研测试化学试题黑龙江省漠河市高级中学2020-2021学年高一上学期12月考化学试题重庆市求精中学2021-2022学年高一上学期第二次月考化学试题吉林省辉南县第六中学2021-2022学年高一上学期第一次月考化学试题安徽省池州市第一中学2021-2022学年高一上学期10月月考化学试题山东省德州市临邑县第一中学2021-2022学年高一10月月考化学试题四川省雅安中学2021-2022学年高一上学期10月月考化学试题
名校
解题方法
4 . 为了预防传染性疾病,不少地方都采用了“84”消毒液进行消毒。“84”消毒液(有效成分为NaClO)可用于消毒和漂白。下列对相关实验现象的分析,不正确 的是


| 实验 | I | II | III |
| 滴管中的液体 | 1mL的蒸馏水 | 1mL0.0002mol•L-1的H2SO4 | 1mL2mol•L-1的H2SO4 |
| 实验现象 | 混合后溶液的pH=9.9,短时间内未褪色,一段时间后蓝色褪去 | 混合后溶液的pH=5.0,蓝色迅速褪去,无气体产生 | 混合后溶液的pH=3.2,蓝色迅速褪去,并产生大量气体,使湿润的淀粉碘化钾试纸变蓝 |
| A.对比实验I和II,II中蓝色迅速褪去的原因是发生了反应:ClO-+H+=HClO |
| B.对比实验II和III,溶液的pH可能会影响ClO-的氧化性或Cl-的还原性 |
| C.实验III中产生的气体是Cl2,由HClO分解得到:2HClO=Cl2↑+H2O |
| D.加酸可以提高“84”消毒液的漂白效果,但需合适的pH才能安全使用 |
您最近一年使用:0次
5 . 某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验Ⅰ:将Fe3+转化为Fe2+
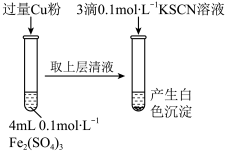
(1)Fe3+与Cu粉发生反应的离子方程式为__________________________________ 。
(2)探究白色沉淀产生的原因,请填写实验方案:
查阅资料:
已知:①SCN-的化学性质与I-相似;②2Cu2++4I-=2CuI↓+I2。
Cu2+与SCN-反应的离子方程式为________________________________ 。
实验Ⅱ:将Fe2+转化为Fe3+
探究上述现象出现的原因:
查阅资料:Fe2++NO⇌Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因_____________________________ 。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应;
反应Ⅱ:Fe2+与NO反应
①依据实验现象,可推知反应Ⅰ的速率比反应Ⅱ的____ (填“快”或“慢”)。
②反应Ⅰ是一个不可逆反应,设计实验方案加以证明:___________________ 。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因:_______________ 。
实验Ⅰ:将Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为
(2)探究白色沉淀产生的原因,请填写实验方案:
| 实验方案 | 现象 | 结论 |
| 步骤1:取4 mL | 产生白色沉淀 | CuSO4溶液与KSCN溶液反应产生了白色沉淀 |
| 步骤2:取 | 无明显现象 |
已知:①SCN-的化学性质与I-相似;②2Cu2++4I-=2CuI↓+I2。
Cu2+与SCN-反应的离子方程式为
实验Ⅱ:将Fe2+转化为Fe3+
| 实验方案 | 现象 |
| 向3 mL 0.1 mol·L-1 FeSO4溶液中加入1 mL稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
查阅资料:Fe2++NO⇌Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应;
反应Ⅱ:Fe2+与NO反应
①依据实验现象,可推知反应Ⅰ的速率比反应Ⅱ的
②反应Ⅰ是一个不可逆反应,设计实验方案加以证明:
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因:
您最近一年使用:0次
2021-08-09更新
|
965次组卷
|
15卷引用:重庆市第一中学2017届高三下学期考前热身考试理科综合化学试题
重庆市第一中学2017届高三下学期考前热身考试理科综合化学试题湖北省武汉市2018届高三毕业生二月调研理综化学试题【全国校级联考】江西省景德镇市第一中学等盟校2018届高三第二次联考理综化学试题(已下线)《考前20天终极攻略》-5月27日 综合实验设计、探究和评价【全国百强校】宁夏回族自治区石嘴山市第三中学2019届高三下学期一模考试理科综合化学试题2020届高三化学二轮复习实验题必练-化学平衡的移动及影响因素四川省成都市双流棠湖中学2020届高三下学期第三次月考理综化学试题(已下线)考点32 化学实验方案设计与评价-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题讲座(十)化学实验设计与探究(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)北京市北京一零一中学2022-2023学年高二上学期期中考试化学试题(已下线)02 物质性质、实验原理的探究型综合实验 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)题型32 原因描述型实验(已下线)实验探究题
解题方法
6 . 两组同学分别通过实验验证氮和硫的氧化物性质。
Ⅰ.甲组同学用图示装置制备一氧化氮并验证其还原性。
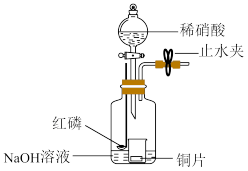
(1)铜与稀硝酸反应的离子方程式是__________ 。
(2)滴入稀硝酸前,先关闭止水夹,点燃红磷并伸入瓶中,塞好胶塞。这样操作的目的是__________ 。
(3)滴入稀硝酸后,烧杯中的现象是__________ 。
(4)烧杯中的反应停止后,打开止水夹,通入__________ 可验证 NO 的还原性。
Ⅱ.乙组同学为了探究二氧化硫的性质,将二氧化硫分别通入下列三种溶液中。

(5)试管 a 中观察到的现象是__________ 。
(6)试管 b 中观察到紫色褪去,能证明 SO2具有的性质是__________ 。
(7)试管 c 中产生白色沉淀,该白色沉淀是__________ (填化学式)。
Ⅰ.甲组同学用图示装置制备一氧化氮并验证其还原性。

(1)铜与稀硝酸反应的离子方程式是
(2)滴入稀硝酸前,先关闭止水夹,点燃红磷并伸入瓶中,塞好胶塞。这样操作的目的是
(3)滴入稀硝酸后,烧杯中的现象是
(4)烧杯中的反应停止后,打开止水夹,通入
Ⅱ.乙组同学为了探究二氧化硫的性质,将二氧化硫分别通入下列三种溶液中。

(5)试管 a 中观察到的现象是
(6)试管 b 中观察到紫色褪去,能证明 SO2具有的性质是
(7)试管 c 中产生白色沉淀,该白色沉淀是
您最近一年使用:0次
7 . 如图所示是一套检验气体性质的实验装置。向装置中缓慢通入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红溶液褪色。据此判断气体X和洗气瓶内的溶液Y分别可能为

① | ② | ③ | ④ | |
X |
|
|
|
|
Y | 饱和的 | 浓硫酸 |
|
|
| A.①④ | B.①② | C.②③ | D.③④ |
您最近一年使用:0次
2020-09-01更新
|
626次组卷
|
10卷引用:苏教版(2020)高一必修第一册专题4第一单元课时1 硫、二氧化硫和三氧化硫
苏教版(2020)高一必修第一册专题4第一单元课时1 硫、二氧化硫和三氧化硫鲁科版(2019)高一必修第一册第3章 物质的性质与转化 第2节 硫的转化 课时1 硫、二氧化硫和三氧化硫高一必修第二册(人教2019版)第五章 第一节 硫及其化合物 课时1 硫和二氧化硫重庆市南开中学校2021-2022学年高一下学期3月月考化学试题(已下线)4.1.1 二氧化硫的性质和应用(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)哈尔滨市第九中学校2021-2022学年高一下学期4月阶段性验收考试化学试题湖南省祁东县育贤中学2021-2022学年高一下学期第一次月考化学试题四川省成都市树德中学2022-2023学年高一下学期4月月考化学试题 作业(二十一) 实验室里研究不同价态硫元素之间的转化甘肃省酒泉市四校联考2023-2024学年高一下学期5月期中考试化学试题
8 . 草酸亚铁晶体受热易分解,难溶于水,是一种浅黄色晶体。某化学兴趣小组查文献得出其热分解方程式为FeC2O4•2H2O=FeO+CO↑+CO2↑+2H2O,然后根据文献设计如图装置,探究草酸亚铁晶体(FeC2O4•2H2O)的分解反应。

(1)实验装置图中间部分为B、C、D、E装置,其正确连接顺序是___ 。其中检验并保证除尽CO的装置是___ (填正确答案的序号)。
(2)设计实验步骤如下:
①检查装置的气密性;
②打开活塞X,通入一段时间的N2,再关闭活塞X;
③先点燃___ 处(填A或B)的酒精灯,再点燃___ 处(填A或B)的酒精灯。
(3)实验过程中,证明草酸亚铁晶体分解生成CO2的现象是___ 。证明分解生成CO的现象是___ 。
(4)停止加热后,打开X,又通入一段时间的N2,使装置A中分解产生的气体全部通入后面的装置中,并将装置E、F中的沉淀过滤、洗涤、干燥、称量,测得E中沉淀质量大约是F中的4倍,重新实验,得出的实验结果不变。小组成员提出两个假设:
a.使用的草酸亚铁试剂变质,有部分CO被分解过程中产生的Fe2O3氧化为CO2
b.草酸亚铁分解时,有部分CO被FeO氧化为CO2
小组成员于是设计如下方案验证:
①验证假设a:取少量草酸亚铁晶体溶液于盐酸,再加入适量的___ (填化学式)溶液,无明显现象,证明草酸亚铁晶体没有变质,说明假设a不成立。
②验证假设b:取实验A中固体溶于盐酸,产生___ ,证明假设b成立。
③实验时同时测出下列有关数据:FeC2O4•2H2O的质量为3.6g,A中剩余固体的质量为1.28g,根据实验分析,分解反应理论上生成n(CO2)是n(CO)的___ 倍。
兴趣小组经过讨论,发现原实验步骤有问题,略作改动后,再次进行实验,得出与文献基本一致的结论,改动方法是___ 。

(1)实验装置图中间部分为B、C、D、E装置,其正确连接顺序是
(2)设计实验步骤如下:
①检查装置的气密性;
②打开活塞X,通入一段时间的N2,再关闭活塞X;
③先点燃
(3)实验过程中,证明草酸亚铁晶体分解生成CO2的现象是
(4)停止加热后,打开X,又通入一段时间的N2,使装置A中分解产生的气体全部通入后面的装置中,并将装置E、F中的沉淀过滤、洗涤、干燥、称量,测得E中沉淀质量大约是F中的4倍,重新实验,得出的实验结果不变。小组成员提出两个假设:
a.使用的草酸亚铁试剂变质,有部分CO被分解过程中产生的Fe2O3氧化为CO2
b.草酸亚铁分解时,有部分CO被FeO氧化为CO2
小组成员于是设计如下方案验证:
①验证假设a:取少量草酸亚铁晶体溶液于盐酸,再加入适量的
②验证假设b:取实验A中固体溶于盐酸,产生
③实验时同时测出下列有关数据:FeC2O4•2H2O的质量为3.6g,A中剩余固体的质量为1.28g,根据实验分析,分解反应理论上生成n(CO2)是n(CO)的
兴趣小组经过讨论,发现原实验步骤有问题,略作改动后,再次进行实验,得出与文献基本一致的结论,改动方法是
您最近一年使用:0次
名校
解题方法
9 . 超氧化钾(KO2)是一种黄色晶体,可作为宇宙飞船舱的氧源。巴蜀中学化学兴趣小组设计了以下实验探究KO2的性质,请回答相关问题:
Ⅰ. 探究KO2与水的反应
Ⅱ. 探究KO2与SO2的反应
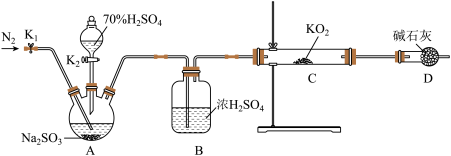
(1)正确的操作依次是______ 。
①打开K1通入N2,排尽装置内原来的气体后关闭 ②拆卸装置,实验完成 ③检查装置气密性,然后装入药品 ④打开分液漏斗活塞K2
(2)A装置发生的化学方程式为___________ 。
(3)D装置的作用是_______________ 。
(4)KO2与SO2反应的产物有O2,K2SO3和K2SO4,为检验是否有K2SO4生成,他们设计了如下方案:
将C中反应后的固体溶解于水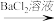 白色沉淀
白色沉淀 仍有部分白色沉淀不溶解,证明有K2SO4生成。
仍有部分白色沉淀不溶解,证明有K2SO4生成。
上述方案是否合理?__ 。(填“是”或“否”)请简要说明两点理由:
①_________ ;
②___________ 。
Ⅰ. 探究KO2与水的反应
| 实验操作 | 现象 | 结论与解释 |
| (1)取少量KO2固体于试管中,滴加少量水,将带火星的木条靠近试管口,反应结束后,溶液分成两份 | 快速产生气泡,木条复燃 | 产生的气体是 |
| (2)一份滴加酚酞试液 | 先变红后褪色 | 可能的产物是 |
| (3)另一份滴加FeCl3溶液 | 观察到 |

(1)正确的操作依次是
①打开K1通入N2,排尽装置内原来的气体后关闭 ②拆卸装置,实验完成 ③检查装置气密性,然后装入药品 ④打开分液漏斗活塞K2
(2)A装置发生的化学方程式为
(3)D装置的作用是
(4)KO2与SO2反应的产物有O2,K2SO3和K2SO4,为检验是否有K2SO4生成,他们设计了如下方案:
将C中反应后的固体溶解于水
 白色沉淀
白色沉淀 仍有部分白色沉淀不溶解,证明有K2SO4生成。
仍有部分白色沉淀不溶解,证明有K2SO4生成。上述方案是否合理?
①
②
您最近一年使用:0次
10 . 已知三氯化铁的熔点为306℃,沸点为315℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验。
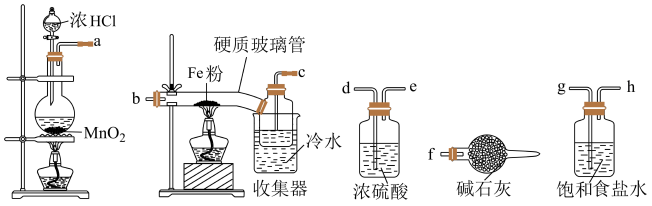
(1)装置的连接顺序为___ 。
(2)饱和食盐水的作用是___ 。
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
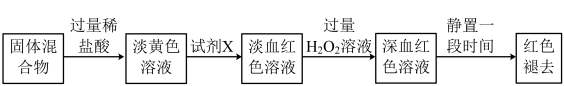
①淡黄色溶液中加入试剂X生成淡血红色溶液的离子方程式为__ 。
②淡血红色溶液中加入过量H2O2后溶液血红色加深的原因是__ 。
(4)已知血红色褪去的同时有气体生成,经检验为O2。该小组同学对血红色褪去的原因进行探究。
①取褪色后溶液三份,第一份滴加FeCl3溶液无明显变化;第二份滴加试剂X,溶液出现血红色;第三份滴加稀盐酸和BaCl2溶液,产生白色沉淀。
②另取同物质的量浓度的FeCl3溶液滴加2滴试剂X,溶液变血红,再通入O2,无明显变化。
实验①说明___ ;
实验②的目的是__ ;得出结论:___ 。

(1)装置的连接顺序为
(2)饱和食盐水的作用是
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

①淡黄色溶液中加入试剂X生成淡血红色溶液的离子方程式为
②淡血红色溶液中加入过量H2O2后溶液血红色加深的原因是
(4)已知血红色褪去的同时有气体生成,经检验为O2。该小组同学对血红色褪去的原因进行探究。
①取褪色后溶液三份,第一份滴加FeCl3溶液无明显变化;第二份滴加试剂X,溶液出现血红色;第三份滴加稀盐酸和BaCl2溶液,产生白色沉淀。
②另取同物质的量浓度的FeCl3溶液滴加2滴试剂X,溶液变血红,再通入O2,无明显变化。
实验①说明
实验②的目的是
您最近一年使用:0次
2020-08-27更新
|
644次组卷
|
10卷引用:2015届重庆市部分学校高三下学期第二次质量检测理综化学试卷
2015届重庆市部分学校高三下学期第二次质量检测理综化学试卷2015届四川省眉山市高三第一次诊断性考试理综化学试卷2015届四川省雅安中学高三开学考试理综化学试卷河北省衡水中学2018届高三上学期一调考试化学试题河南省新乡市辉县市第一高级中学2018-2019学年高一上学期第二次阶段性考试化学试题【全国百强校】河北省武邑中学2019届高三上学期期末考试化学试题(已下线)《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(九)(已下线)专题讲座(三)“铁三角”综合实验题解题策略(精练)——2021年高考化学一轮复习讲练测山西省临汾市县底中学校2020-2021学年高三上学期开学考试化学试题(已下线)考点10 铁及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)





 溶液
溶液 溶液
溶液 溶液
溶液

