名校
解题方法
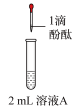
1 . 研究小组探究 与水反应。取
与水反应。取 粉末加入到
粉末加入到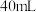 水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。
水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。
下列说法不正确的是
 与水反应。取
与水反应。取 粉末加入到
粉末加入到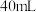 水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。
水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。编号 | ① | ② | ③ | ④ |
操作 |
|
|
|
|
现象 | 溶液变红色,20秒后褪色 | ⅰ.产生大量能使带火星木条复燃的气体 ⅱ.溶液变红色,10分钟后褪色 | ⅰ.溶液变红色,10分钟后溶液褪色 ⅱ.变红色 | 溶液变红色,2小时后无明显变化 |
A.由②中现象ⅰ可知, 与水反应有 与水反应有 生成 生成 |
B.由③、④可知,②中溶液红色褪去是因为 大 大 |
C.由②、③、④可知,①中溶液红色褪去的主要原因不是 大 大 |
D.向①中褪色后的溶液中滴加5滴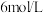 盐酸,溶液最终变成红色 盐酸,溶液最终变成红色 |
您最近一年使用:0次
2023-12-15更新
|
147次组卷
|
21卷引用:北京师范大学附属实验中学2020-2021学年高一上学期期末考试化学试题
北京师范大学附属实验中学2020-2021学年高一上学期期末考试化学试题北京一零一中学2021-2022学年高三上学期 9月开学练习化学试题北京交通大学附属中学2021-2022学年高一上学期期中考试化学试题北京师范大学附属实验中学2021-2022学年高一上学期1月期末测试化学试题北京市第八中学2022-2023学年高一下学期期末考试化学试题北京市海淀区2021届高三上学期期中考试化学试题四川省德阳市德阳五中2021-2022学年高一上学期期末考试化学试题(已下线)北京市第四中学2022-2023学年高一上学期期中考试化学试题北京市首都师范大学附属中学2022-2023学年高一上学期12月月考化学试题北京市清华大学附属中学2023-2024学年高三上学期开学考试化学(A)试题北京市第二十中学2023-2024学年高一上学期期中考试化学试题北京市第一○一中学2023-2024学年高二上学期12月统练四化学试题北京市日坛中学2023-2024学年高一上学期期中考试化学试题北京市第一○一中学2023-2024学年高二上学期12月统练四化学试题北京师范大学燕化附属中学2023-2024学年高一上学期期中考试化学试卷北京市第一五九中学2023-2024学年高一上学期期中考试化学试题安徽省示范高中培优联盟2020-2021学年高一上学期冬季联赛化学试题福建省厦门外国语学校2023-2024学年高一上学期10月第一次月考化学试题天津市第一中学2023-2024学年高一上学期11月期中化学试题河南省唐河县鸿唐高级中学2023-2024学年高三上学期9月月考化学试题山东省菏泽市郓城县第一中学2023-2024学年高一上学期9月月考化学试题
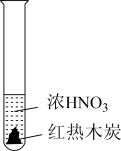
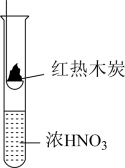
2 . 下述实验中均有红棕色气体产生,对比分析所得结论不正确的是
|
|
|
| ① | ② | ③ |
| A.由①中的红棕色气体,推断产生的气体一定是混合气体 |
| B.由②中的红棕色气体不能表明木炭与浓硝酸发生了反应 |
| C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物 |
| D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应 |
您最近一年使用:0次
2022-06-29更新
|
3788次组卷
|
82卷引用:北京市中国农业大学附属中学2020-2021学年高一上学期期末学业水平调研化学试题
北京市中国农业大学附属中学2020-2021学年高一上学期期末学业水平调研化学试题安徽省芜湖市2020-2021学年高一下学期期末质量检测联考化学试题2017年全国普通高等学校招生统一考试理综化学(北京卷精编版)北京市清华大学附属中学2018届高三10月月考化学试题北京市一零一中学2018届高三10月月考化学试题宁夏银川一中2017-2018学年高一上学期期末考试化学试题云南省峨山彝族自治县第一中学2018届高三上学期期末考试仿真化学试题黑龙江省伊春中学2017-2018学年高一化学上学期期末考试题河南省三门峡市2017-2018学年高一上学期期末考试化学试题【全国百强校】陕西省西安市长安区第一中学2018-2019学年高一上学期期末考试化学试题贵州省黔南布依族苗族自治州龙里中学2019-2020学年高三上学期期末考试理综化学试题贵州省长顺县二中2019-2020学年高三上学期期末考试理综化学试题贵州省施秉县一中2019-2020学年高三上学期期末考试化学试题北京一零一中2021届高三上学期第三次统练化学试题陕西省西安市长安区第一中学2019-2020学年高一上学期期末考试化学试题专题7 第一~二单元 综合拔高练-高中化学必修第二册苏教版2019(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 第二节 氮及其化合物(已下线)【浙江新东方】高中化学20210304-015黑龙江省哈尔滨市阿城区龙涤中学2020-2021学年高一4月月考化学试题黑龙江省哈尔滨市第一六二中学校2020-2021学年高一下学期4月月考化学试题浙江省诸暨市2021届高三5月适应性考试化学试题福建省泉州科技中学2020-2021学年高一下学期期中考试化学试题(苏教版2019)必修第二册专题7 氮与社会可持续发展 C 高考挑战区(已下线)课时23 氮及其化合物-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点12 氮及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点12 氮及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第12讲 氮及其化合物(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)河南部分学校2022届新高三8月份摸底联考化学试题(已下线)专题07 常见非金属及其化合物-备战2022年高考化学学霸纠错(全国通用)江西省吉安市2021-2022学年高二下学期期末检测化学试题北京市首师附密云中学2021-2022学年高一下学期等级考化学试题山东省菏泽市单县第二中学2021-2022学年高一上学期(实验班)12月段考化学试题北京市第九中学2023-2024学年高一下学期期中考试化学试题河南省洛阳市第一高级中学2016-2017学年高一6月月考化学试题河北省衡水中学2018届高三上学期一调考试化学试题山东省淄博第一中学2018届高三上学期开学考试化学试题四川省德阳市三校2018届高三联合测试化学试题(已下线)黄金30题系列 高一化学 小题好拿分【提升版】广西陆川县中学2018届高三12月月考化学试题广西陆川县中学2018届高三3月月考化学试题云南省玉溪第一中学2017-2018学年高一下学期4月月考化学试题云南省玉溪市玉溪一中2017-2018学年高一下学期4月月考化学试题(已下线)解密06 非金属及其化合物(教师版)——备战2018年高考化学之高频考点解密(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第4讲 氮及其化合物【教学案】云南省玉溪市峨山一中2019届高三9月月考化学试题江苏省常州市第一中学2019届高三第一学期期初(8月)考试化学试题【全国百强校】山西省山西大学附属中学2018-2019学年高一下学期2月模块诊断化学试题福建省泉州市泉港区第一中学2018-2019学年高一下学期期中考试化学试题百所名校联考-非金属及其化合物内蒙古包头稀土高新区二中2020届高三10月月考理综化学试题四川省绵阳市南山中学2020届高三10月月考化学试题(已下线)2019年12月11日 《每日一题》化学人教版(必修1)——硝酸的强氧化性2020届高三化学二轮冲刺新题专练——硝酸的性质及应用(提升练)(已下线)专题3.5 氮及其化合物 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》福建省福州市第一中学2020年高一在线自测自评质检化学试题贵州省贵阳市第一中学2020届高三教学质量监测理科综合化学试题安徽省池州市第一中学2019-2020学年高一下学期期中教学质量检测化学试题云南省昆明市寻甸县民族中学2019-2020学年高一下学期第一次月考化学试题湖南省长沙市雅礼中学2020届高三5月高考化学模拟试卷安徽省六安市舒城中学2019-2020学年高一下学期第一次月考化学试题(已下线)专题05 元素及其化合物-2020年高考真题和模拟题化学分项汇编(已下线)第12讲 氮及其化合物-2021年高考化学一轮复习名师精讲练2019年上海市高中生化学竞赛初赛试题(“华理一化工杯”)初赛试题鲁科版(2019)高一必修第一册第三章C 高考挑战区 过高考 3年真题强化闯关高一必修第一册(鲁科2019)第3章 第3节 氮的循环 高考帮(已下线)小题必刷20 氮及其化合物——2021年高考化学一轮复习小题必刷(通用版)湖南省长沙市雅礼中学2021届高三上学期第一次月考化学试题(已下线)【浙江新东方】48安徽省滁州市定远县重点中学2021届高三上学期11月质量检测化学试题(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP406】【化学】课后-5.2.3 硝酸 酸雨及防治-人教2019必修第二册云南省瑞丽市第一民族中学2021-2022学年高三下学期3月月考化学试题辽宁省沈阳市第二十中学2019-2020学年高一下学期第一次月考化学试题(已下线)考点11 氮及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第14讲 氮及其化合物(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第13练 氮及其化合物-2023年高考化学一轮复习小题多维练(全国通用)广东省揭阳华侨高级中学2021-2022学年高一下学期第一次阶段化学试题第四章 非金属及其化合物 第23讲 硝酸 含氮化合物的转化关系巩固训练12(已下线)题型61 硝酸、硝酸盐的性质安徽省合肥市第一中学2022-2023学年高一下学期第4次月考化学试题(已下线)考点11 氮及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
3 . 化学小组实验探究FeCl3溶液与Na2S溶液的反应。
已知:Fe2S3是一种固体黑色粉末;FeS为黑色难溶于水固体;硫单质为黄色固体;(空气中氧气的影响忽略不计)。
(1)提出假设
假设1:FeCl3与Na2S可以发生复分解反应生成黑色Fe2S3沉淀,离子方程式为___ 。
假设2:Fe3+具有氧化性,S2—可能具有还原性,Fe3+与S2—可能发生氧化还原反应,生成黄色的硫单质,离子方程式为:2Fe3++S2—=2Fe2++S↓。(如果S2—过量,生成的Fe2+与S2-可以继续反应生成黑色的FeS沉淀)
(2)设计方案
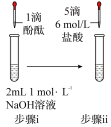
方案1:向2mL氯化铁饱和溶液中滴加2滴硫化钠饱和溶液(FeCl3过量)
方案2:向2mL硫化钠饱和溶液中滴加2滴氯化铁饱和溶液(Na2S过量)
(3)收集证据
方案1实验现象:开始生成的黑色沉淀逐渐消失,试管底部沉积少量淡黄色沉淀(经检验为硫单质)。
方案2实验现象:试管底部沉积大量的黑色沉淀。
(2)分析解释
①证明Fe3+与S2—发生氧化还原反应的实验现象是___ 。
②理论分析确认方案2中生成的黑色沉淀有Fe2S3,进一步实验发现方案2中生成的黑色沉淀中还有硫单质,该小组结合相关知识确认黑色沉淀中也有FeS,简述确认依据___ 。
③该小组讨论后认为:方案1中黑色沉淀消失的原因是Fe2S3、FeS沉淀中负二价的硫元素被溶液中过量的Fe3+氧化所致,并通过进一步实验证明了自己的想法:将方案2中的沉淀过滤、洗涤,加入___ ,黑色沉淀逐步转变成淡黄色的硫沉淀。
(3)形成结论
通过上述实验,你认为化学反应的发生和___ 有关。
已知:Fe2S3是一种固体黑色粉末;FeS为黑色难溶于水固体;硫单质为黄色固体;(空气中氧气的影响忽略不计)。
(1)提出假设
假设1:FeCl3与Na2S可以发生复分解反应生成黑色Fe2S3沉淀,离子方程式为
假设2:Fe3+具有氧化性,S2—可能具有还原性,Fe3+与S2—可能发生氧化还原反应,生成黄色的硫单质,离子方程式为:2Fe3++S2—=2Fe2++S↓。(如果S2—过量,生成的Fe2+与S2-可以继续反应生成黑色的FeS沉淀)
(2)设计方案
方案1:向2mL氯化铁饱和溶液中滴加2滴硫化钠饱和溶液(FeCl3过量)
方案2:向2mL硫化钠饱和溶液中滴加2滴氯化铁饱和溶液(Na2S过量)
(3)收集证据
方案1实验现象:开始生成的黑色沉淀逐渐消失,试管底部沉积少量淡黄色沉淀(经检验为硫单质)。
方案2实验现象:试管底部沉积大量的黑色沉淀。
(2)分析解释
①证明Fe3+与S2—发生氧化还原反应的实验现象是
②理论分析确认方案2中生成的黑色沉淀有Fe2S3,进一步实验发现方案2中生成的黑色沉淀中还有硫单质,该小组结合相关知识确认黑色沉淀中也有FeS,简述确认依据
③该小组讨论后认为:方案1中黑色沉淀消失的原因是Fe2S3、FeS沉淀中负二价的硫元素被溶液中过量的Fe3+氧化所致,并通过进一步实验证明了自己的想法:将方案2中的沉淀过滤、洗涤,加入
(3)形成结论
通过上述实验,你认为化学反应的发生和
您最近一年使用:0次
4 . 某小组研究铁与水蒸气的反应,两位同学分别进行了如图实验。
请回答:
(1)实验I中湿棉花的作用是___ 。
(2)实验I中反应的化学方程式是___ 。
甲同学观察到实验I中持续产生肥皂泡,实验Ⅱ中溶液B呈现红色。说明溶液A中含有Fe3+。
(3)乙同学观察到实验I中持续产生肥皂泡,但实验Ⅱ中溶液B未呈现红色。溶液B未呈现红色的原因是___ ,此时向溶液B中加入过量氢氧化钠溶液观察到的实验现象是___ ,写出发生反应的化学或离子方程式___ 、___ 。
实验I | 实验II |
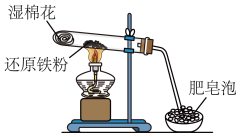 |  |
(1)实验I中湿棉花的作用是
(2)实验I中反应的化学方程式是
甲同学观察到实验I中持续产生肥皂泡,实验Ⅱ中溶液B呈现红色。说明溶液A中含有Fe3+。
(3)乙同学观察到实验I中持续产生肥皂泡,但实验Ⅱ中溶液B未呈现红色。溶液B未呈现红色的原因是
您最近一年使用:0次
2021-10-22更新
|
434次组卷
|
3卷引用:北京市中国农业大学附属中学2020-2021学年高一上学期期末学业水平调研化学试题
解题方法
5 . 某小组同学为研究有机物的官能团以及化学键的活性,完成下列对比实验。
(1)实验I、实验II使用到的两种有机物的关系是_______ 。
(2)实验I中发生反应的化学方程式是_______ 。
(3)对比分析实验I和实验II,从结构角度解释发生不同现象的原因_______ 。
(4)该小组同学欲验证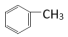

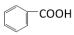 ,进一步探究有机化合物基团之间的相互影响。完成下表实验,请将实验方案和实验现象补充完整。
,进一步探究有机化合物基团之间的相互影响。完成下表实验,请将实验方案和实验现象补充完整。
实验结论:_______ 。
| 实验I | 实验II | |
| 实验方案与 现象 | 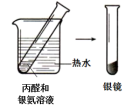 | 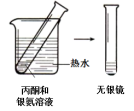 |
(2)实验I中发生反应的化学方程式是
(3)对比分析实验I和实验II,从结构角度解释发生不同现象的原因
(4)该小组同学欲验证


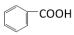 ,进一步探究有机化合物基团之间的相互影响。完成下表实验,请将实验方案和实验现象补充完整。
,进一步探究有机化合物基团之间的相互影响。完成下表实验,请将实验方案和实验现象补充完整。| 实验方案 | 实验现象 |
| ①将过量CH4气体通入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液不褪色 |
| ②向盛有2mL甲苯的试管中加入5滴酸性高锰酸钾溶液,用力振荡,静置 | |
| ③ | 酸性高锰酸钾溶液不褪色 |
您最近一年使用:0次
2021-08-13更新
|
207次组卷
|
2卷引用:北京市延庆区2020-2021学年高二下学期期末考试化学试题
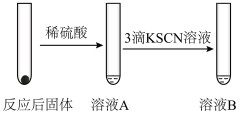
6 . 某同学为研究浓硝酸与 溶液的反应,进行如下实验:
溶液的反应,进行如下实验:
资料: 能被氧化为
能被氧化为 ,
, 迅速聚合为红色的
迅速聚合为红色的 。
。
(1) 中,
中, 、
、 元素的化合价分别为+4价和-3价,则
元素的化合价分别为+4价和-3价,则 元素的化合价为
元素的化合价为_______ 。
(2)Ⅰ中溶液立即变红是因为生成了_______ (填化学式)。
(3)研究 的最终转化产物。
的最终转化产物。
①取少量Ⅱ中试管内的溶液,_______ (填操作和现象),证明 中
中 元素的转化产物是
元素的转化产物是 。
。
②经检验Ⅱ中“红棕色气体”含有 ,但不能说明
,但不能说明 一定是
一定是 中
中 元素的转化产物,原因是
元素的转化产物,原因是_______ 。
③Ⅲ中, 转化为
转化为 、
、 ,离子方程式是
,离子方程式是_______ 。
④将Ⅲ中沉淀过滤、洗涤,取少量于试管中,加入过量的稀硝酸,沉淀完全溶解,再滴加少量 溶液,不褪色。证明了红棕色气体中不含
溶液,不褪色。证明了红棕色气体中不含 。
。
综合上述实验, 的最终转化产物中一定有
的最终转化产物中一定有_______ 。
(4)Ⅱ中,“静置一段时间后,突然剧烈反应”的可能原因是_______ (写出一条即可)。
 溶液的反应,进行如下实验:
溶液的反应,进行如下实验:| 实验操作 | 实验现象 |
Ⅰ.取1支试管,加入 浓硝酸,滴加5滴 浓硝酸,滴加5滴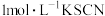 溶液 溶液 | 溶液立即变红 |
| Ⅱ.将试管静置一段时间 | 突然剧烈反应,红色迅速褪去,放出大量红棕色气体 |
Ⅲ. 将Ⅱ中的气体通入 和 和 的混合溶液中 的混合溶液中 | 有白色沉淀生成 |
 能被氧化为
能被氧化为 ,
, 迅速聚合为红色的
迅速聚合为红色的 。
。(1)
 中,
中, 、
、 元素的化合价分别为+4价和-3价,则
元素的化合价分别为+4价和-3价,则 元素的化合价为
元素的化合价为(2)Ⅰ中溶液立即变红是因为生成了
(3)研究
 的最终转化产物。
的最终转化产物。①取少量Ⅱ中试管内的溶液,
 中
中 元素的转化产物是
元素的转化产物是 。
。②经检验Ⅱ中“红棕色气体”含有
 ,但不能说明
,但不能说明 一定是
一定是 中
中 元素的转化产物,原因是
元素的转化产物,原因是③Ⅲ中,
 转化为
转化为 、
、 ,离子方程式是
,离子方程式是④将Ⅲ中沉淀过滤、洗涤,取少量于试管中,加入过量的稀硝酸,沉淀完全溶解,再滴加少量
 溶液,不褪色。证明了红棕色气体中不含
溶液,不褪色。证明了红棕色气体中不含 。
。综合上述实验,
 的最终转化产物中一定有
的最终转化产物中一定有(4)Ⅱ中,“静置一段时间后,突然剧烈反应”的可能原因是
您最近一年使用:0次
2021-07-10更新
|
232次组卷
|
4卷引用:北京市西城区2020-2021学年高一下学期期末联考化学试题
北京市西城区2020-2021学年高一下学期期末联考化学试题(已下线)重难点04 硫和氮综合题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(北京专用)北京市第三中学2022-2023学年高一下学期期中考试化学试题北京市回民学校2022-2023学年高一下学期期中考试化学试题
7 . 某化学小组利用下图装置进行实验(夹持仪器略去,气密性已检查),对比 通入浓、稀硝酸的现象,探究浓、稀硝酸氧化性的相对强弱。
通入浓、稀硝酸的现象,探究浓、稀硝酸氧化性的相对强弱。
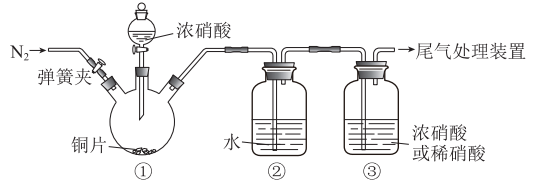
(1)铜与浓硝酸反应的化学方程式是_______ 。
(2)装置②中发生反应的化学方程式是_______ 。
(3)滴加浓硝酸前需先通入 ,目的是
,目的是_______ 。
(4)滴加浓硝酸后,当③中为稀硝酸时,其液面上方气体仍为无色;当③中为浓硝酸时,其液面上方气体由无色变为红棕色。由此得出的结论是_______ 。
 通入浓、稀硝酸的现象,探究浓、稀硝酸氧化性的相对强弱。
通入浓、稀硝酸的现象,探究浓、稀硝酸氧化性的相对强弱。
(1)铜与浓硝酸反应的化学方程式是
(2)装置②中发生反应的化学方程式是
(3)滴加浓硝酸前需先通入
 ,目的是
,目的是(4)滴加浓硝酸后,当③中为稀硝酸时,其液面上方气体仍为无色;当③中为浓硝酸时,其液面上方气体由无色变为红棕色。由此得出的结论是
您最近一年使用:0次
2021-07-10更新
|
232次组卷
|
3卷引用:北京市西城区2020-2021学年高一下学期期末联考化学试题
8 . 用下图所示装置探究铜丝与过量浓硫酸的反应。下列说法中,不正确 的是
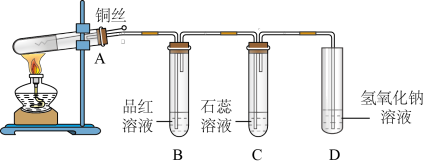
| A.向外拉铜丝可终止反应 |
B. 中品红溶液褪色, 中品红溶液褪色, 中石蕊溶液变红 中石蕊溶液变红 |
C. 中 中 溶液可以吸收多余的 溶液可以吸收多余的 |
D.为确认生成 ,向试管 ,向试管 中加水,观察颜色 中加水,观察颜色 |
您最近一年使用:0次
2021-07-10更新
|
300次组卷
|
4卷引用:北京市西城区2020-2021学年高一下学期期末联考化学试题
名校
解题方法
9 . 为了探究铁与水的反应。某同学设计并进行了下列实验,虚线框处用来检验生成的气体。下列说法正确的是


| A.实验后,装置B中生成红棕色固体 |
| B.虚线框C处应该选择装置甲,试管中是灼热的铜丝 |
| C.虚线框C处应该选择装置乙,试管中是灼热的表面覆盖氧化铜的铜丝 |
| D.实验后,将装置B中的固体溶于足量稀硫酸,所得溶液中一定含有Fe3+ |
您最近一年使用:0次
2021-05-06更新
|
403次组卷
|
4卷引用:北京市中国农业大学附属中学2020-2021学年高一上学期期末学业水平调研化学试题
北京市中国农业大学附属中学2020-2021学年高一上学期期末学业水平调研化学试题北京市中国农业大学附属中学2019-2020学年高一上学期期末考试化学试题河北省石家庄二中2019-2020学年高一上学期期末考试化学试题(已下线)专题六 铁及其化合物(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)
解题方法
10 . 某小组在做铜与浓硫酸反应时发现产生黑色固体。于是他们对黑色固体进行探究,实验步骤如下:
I.将光亮铜丝插入浓硫酸,加热;
II.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
III.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用。
(1)步骤II产生的气体是___________ 。
(2)该同学假设黑色沉淀是CuO。检验过程如下:
查阅文献:检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+。
①将CuO放入稀硫酸中,一段时间后,未见明显现象,再滴加K4[Fe(CN)6]溶液,产生红褐色沉淀。
②将黑色沉淀放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,未见红褐色沉淀。由该检验过程所得结论是___________ 。
(3)再次假设,黑色沉淀是铜的硫化物。实验如下:
①现象2说明黑色沉淀具有___________ 性。
②产生红棕色气体的化学方程式是___________ 。
③能确认黑色沉淀中含有S元素的现象是___________ 。
④为确认黑色沉淀是“铜的硫化物”,还需进行的实验是___________ 。
(4)以上实验说明,黑色沉淀中存在铜的硫化物。进一步实验后证明黑色沉淀是CuS与Cu2S的混合物。将黑色沉淀放入足量浓硫酸中加热一段时间后,黑色沉淀完全溶解,得到澄清溶液,其中CuS溶解的化学方程式是___________ 。
I.将光亮铜丝插入浓硫酸,加热;
II.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
III.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用。
(1)步骤II产生的气体是
(2)该同学假设黑色沉淀是CuO。检验过程如下:
查阅文献:检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+。
①将CuO放入稀硫酸中,一段时间后,未见明显现象,再滴加K4[Fe(CN)6]溶液,产生红褐色沉淀。
②将黑色沉淀放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,未见红褐色沉淀。由该检验过程所得结论是
(3)再次假设,黑色沉淀是铜的硫化物。实验如下:
| 实验装置 | 现象 |
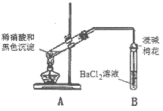 | 1.A试管中黑色沉淀逐渐溶解 2.A试管内上方出现红棕色气体 3.B试管中出现白色沉淀 |
②产生红棕色气体的化学方程式是
③能确认黑色沉淀中含有S元素的现象是
④为确认黑色沉淀是“铜的硫化物”,还需进行的实验是
(4)以上实验说明,黑色沉淀中存在铜的硫化物。进一步实验后证明黑色沉淀是CuS与Cu2S的混合物。将黑色沉淀放入足量浓硫酸中加热一段时间后,黑色沉淀完全溶解,得到澄清溶液,其中CuS溶解的化学方程式是
您最近一年使用:0次