名校
1 . 完成下列小题
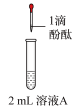
(1)钠及其化合物在人类生产生活中有着重大的作用。金属钠要隔绝空气密封保存,请用化学方程式表示原因(Na参与的反应)______ 、______ 。
(2)加热条件下,Na可以在氧气中燃烧,反应的化学方程式为______ ;现象是______ 。某课外活动小组设计了下列装置,证实二氧化碳跟过氧化钠反应时需要与水接触。

(3)装置分析
装置①中反应的离子方程式是______ 。
装置②中的试剂是为了除去CO2中混有的HCl,则可选用的试剂为______ 。
A.饱和NaOH溶液 B.饱和Na2CO3溶液 C.和NaHCO3溶液
装置③中的试剂是______ 。
(4)(进行实验)
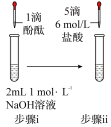
步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的大条放在a处。
步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火量的大条放在a外。
步骤1和步骤2中,a处带火星的木条产生的实验现象______ 。
(5)过氧化钠跟二氧化碳反应的化学方程式并用双线桥标出电子转移______ 。
(6)若要证明CO2和Na2O2,发生了反应,需要取出少量反应后的固体,______ (请补全实验方案)。
(7)面粉发酵时会产生有机酸(用HA表示其化学式,HA酸性强于碳酸),影响口感。我们可以加入膨松剂(主要含NaHCO3),那么蒸出来的馒头蓬松柔软,目口感好。若加入过量的膨松剂,请写出蒸馒头时反应的化学方程式______ 。
(1)钠及其化合物在人类生产生活中有着重大的作用。金属钠要隔绝空气密封保存,请用化学方程式表示原因(Na参与的反应)
(2)加热条件下,Na可以在氧气中燃烧,反应的化学方程式为

(3)装置分析
装置①中反应的离子方程式是
装置②中的试剂是为了除去CO2中混有的HCl,则可选用的试剂为
A.饱和NaOH溶液 B.饱和Na2CO3溶液 C.和NaHCO3溶液
装置③中的试剂是
(4)(进行实验)
步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的大条放在a处。
步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火量的大条放在a外。
步骤1和步骤2中,a处带火星的木条产生的实验现象
(5)过氧化钠跟二氧化碳反应的化学方程式并用双线桥标出电子转移
(6)若要证明CO2和Na2O2,发生了反应,需要取出少量反应后的固体,
(7)面粉发酵时会产生有机酸(用HA表示其化学式,HA酸性强于碳酸),影响口感。我们可以加入膨松剂(主要含NaHCO3),那么蒸出来的馒头蓬松柔软,目口感好。若加入过量的膨松剂,请写出蒸馒头时反应的化学方程式
您最近一年使用:0次
名校
解题方法
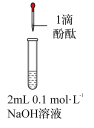
2 . 研究小组探究 与水反应。取
与水反应。取 粉末加入到
粉末加入到 水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。
水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。
下列说法不正确的是
 与水反应。取
与水反应。取 粉末加入到
粉末加入到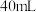 水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。
水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。编号 | ① | ② | ③ | ④ |
操作 |
|
|
|
|
现象 | 溶液变红色,20秒后褪色 | ⅰ.产生大量能使带火星木条复燃的气体 ⅱ.溶液变红色,10分钟后褪色 | ⅰ.溶液变红色,10分钟后溶液褪色 ⅱ.变红色 | 溶液变红色,2小时后无明显变化 |
A.由②中现象ⅰ可知, 与水反应有 与水反应有 生成 生成 |
B.由③、④可知,②中溶液红色褪去是因为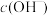 大 大 |
C.由②、③、④可知,①中溶液红色褪去的主要原因不是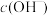 大 大 |
D.向①中褪色后的溶液中滴加5滴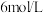 盐酸,溶液最终变成红色 盐酸,溶液最终变成红色 |
您最近一年使用:0次
2023-12-15更新
|
105次组卷
|
21卷引用:北京师范大学附属实验中学2020-2021学年高一上学期期末考试化学试题
北京师范大学附属实验中学2020-2021学年高一上学期期末考试化学试题北京一零一中学2021-2022学年高三上学期 9月开学练习化学试题北京交通大学附属中学2021-2022学年高一上学期期中考试化学试题北京市海淀区2021届高三上学期期中考试化学试题(已下线)北京市第四中学2022-2023学年高一上学期期中考试化学试题北京市首都师范大学附属中学2022-2023学年高一上学期12月月考化学试题北京师范大学附属实验中学2021-2022学年高一上学期1月期末测试化学试题北京市第八中学2022-2023学年高一下学期期末考试化学试题北京市清华大学附属中学2023-2024学年高三上学期开学考试化学(A)试题北京市第二十中学2023-2024学年高一上学期期中考试化学试题北京市第一○一中学2023-2024学年高二上学期12月统练四化学试题北京市日坛中学2023-2024学年高一上学期期中考试化学试题北京市第一○一中学2023-2024学年高二上学期12月统练四化学试题北京师范大学燕化附属中学2023-2024学年高一上学期期中考试化学试卷北京市第一五九中学2023-2024学年高一上学期期中考试化学试题安徽省示范高中培优联盟2020-2021学年高一上学期冬季联赛化学试题四川省德阳市德阳五中2021-2022学年高一上学期期末考试化学试题福建省厦门外国语学校2023-2024学年高一上学期10月第一次月考化学试题天津市第一中学2023-2024学年高一上学期11月期中化学试题河南省唐河县鸿唐高级中学2023-2024学年高三上学期9月月考化学试题山东省菏泽市郓城县第一中学2023-2024学年高一上学期9月月考化学试题
3 . 84消毒液是一种常见的含氯消毒剂。如图1为某品牌84消毒液的说明书中的部分内容。

(1)84消毒液的主要成分为 _______ (用化学式表示)。
(2)常温,将氯气通入NaOH溶液中可制得84消毒液的主要成分。写出离子方程式:_______ 。
(3)某同学研究84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有ClO﹣、Cl﹣、HClO;相同浓度时,HClO的氧化性强于ClO﹣;ORP是反映水溶液中所有物质表现出来的氧化﹣还原性,ORP值越大,氧化性越强。
Ⅰ.将2mL84消毒液中加2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.将2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
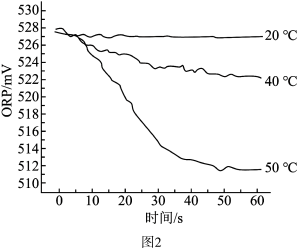
Ⅲ.测得84消毒液在不同温度时ORP随时间的变化曲线如图2。
①已知白醋显酸性,不具有漂白性。实验Ⅰ、Ⅱ现象不同的原因是_______ 。
②实验表明,向84消毒液中加入较多硫酸时会产生氯气,生成氯气的离子方程式是_______ 。
③由实验Ⅲ可得出的结论是_______ 。ORP值不同的原因可能是 _______ 。

| 产品特点 本品是以次氯酸钠为主要成分的液体消毒剂。可杀灭肠道致病菌、化脓性球菌、致病性酵母菌,并能灭活病毒。 注意事项 (1)本品易使有色衣脱色,禁止用于丝、毛、麻织物的消毒。 (2)不得将本品与酸性产品(如洁厕类清洁产品)同时使用。 (3)置于避光、阴凉处保存。 (4)需稀释后使用,勿口服。 |
(2)常温,将氯气通入NaOH溶液中可制得84消毒液的主要成分。写出离子方程式:
(3)某同学研究84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有ClO﹣、Cl﹣、HClO;相同浓度时,HClO的氧化性强于ClO﹣;ORP是反映水溶液中所有物质表现出来的氧化﹣还原性,ORP值越大,氧化性越强。
Ⅰ.将2mL84消毒液中加2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.将2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.测得84消毒液在不同温度时ORP随时间的变化曲线如图2。

①已知白醋显酸性,不具有漂白性。实验Ⅰ、Ⅱ现象不同的原因是
②实验表明,向84消毒液中加入较多硫酸时会产生氯气,生成氯气的离子方程式是
③由实验Ⅲ可得出的结论是
您最近一年使用:0次
2022-12-05更新
|
173次组卷
|
2卷引用:北京市第五十七中学2021-2022学年高一上学期期中考试化学试题
名校
解题方法
4 . 实验小组利用传感器探究Na2CO3和NaHCO3的性质。
【查阅资料】pH越小,c(OH-)越小,溶液碱性越弱
【实验过程】
【分析与解释】
(1)实验I中,溶解时吸收热量的物质是_______ 。
(2)实验II中,Na2CO3溶液和澄清石灰水反应的离子方程式为_______ ,OH-未参与该反应的实验证据是_______ 。
(3)实验II中,滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,造成这种差异是由于滴加NaHCO3溶液的烧杯中有_______ (填写离子符号)参与反应。
【查阅资料】pH越小,c(OH-)越小,溶液碱性越弱
【实验过程】
| 编号 | 实验操作 | 实验数据 |
| 实验I | 测量下述实验过程的温度变化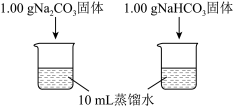 | 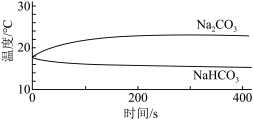 |
| 实验II | 测量下述实验过程的pH变化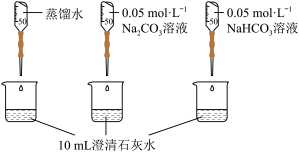 |  |
(1)实验I中,溶解时吸收热量的物质是
(2)实验II中,Na2CO3溶液和澄清石灰水反应的离子方程式为
(3)实验II中,滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,造成这种差异是由于滴加NaHCO3溶液的烧杯中有
您最近一年使用:0次
2022-11-30更新
|
294次组卷
|
13卷引用:北京市第三十一中学2020—2021学年度高一下学期期中考试化学试题
北京市第三十一中学2020—2021学年度高一下学期期中考试化学试题北京第七中学2020-2021学年高一下学期期中考试化学试题北京市2020年普通高中学业水平合格性模拟考试化学试题2020年北京市第一次普通高中学业水平合格性考试化学试题北京市回民学校2020-2021学年高一上学期期中考试化学试题天津市红桥区2020-2021学年高一下学期期末考试化学试题(已下线)北京市第四中学2022-2023学年高一上学期期中考试化学试题北京市第四十三中学2022-2023学年高一上学期期中考试化学试题北京市第八中学2022-2023学年高一下学期期末考试化学试题北京市第十一中学2023-2024学年高一上学期期中考试化学试题北京市月坛中学2023-2024学年高一上学期期中考试化学试题高一必修第一册(苏教2019)专题3 第二单元 金属钠及钠的化合物4(已下线)专题八 钠及其化合物
名校
解题方法
5 . 某小组研究Na2CO3和NaHCO3的性质,实验如下。
(1)室温下,Na2CO3的溶解度大于NaHCO3的实验证据是_______ 。
(2)根据两试管中的温度变化情况,可得出的结论是_______ 。
(3)该实验不能 说明Na2CO3溶液的碱性强于NaHCO3溶液,理由是_______ 。
| 序号 | 操作 | 现象 | |
| Na2CO3 | NaHCO3 | ||
| ① | 在两支试管中加入1g Na2CO3或1g NaHCO3,再加入5mL水,振荡;将温度计分别插入其中 | 温度由17.6℃变为23.2℃;放置至室温时,试管内无固体 | 温度由17.6℃变为17.2℃;放置至室温时,试管内有少量固体残留 |
| ② | 室温时,分别向①所得溶液中滴入2滴酚酞溶液 | 溶液变红 | 溶液微红 |
(2)根据两试管中的温度变化情况,可得出的结论是
(3)该实验
您最近一年使用:0次
名校
解题方法
6 . 为了验证Na2CO3和NaHCO3的热稳定性,按如图所示装置进行实验。相关说法不合理的是
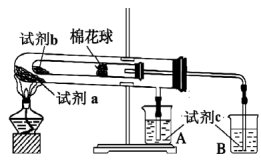

| A.试剂a为NaHCO3 | B.实验中,试剂a比试剂b的受热温度高 |
| C.试剂c为澄清石灰水 | D.一段时间后烧杯B中溶液变浑浊,A中不变浑浊。 |
您最近一年使用:0次
7 . 铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物(见如图)。该药品不溶于水但能溶于人体中的胃酸(主要成分:稀盐酸),服用时同维生素 C一起服用效果会更好。某学习小组为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
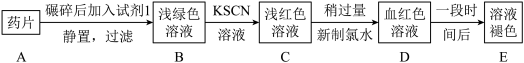
请回答下列问题:
(1)试剂1是_______ 。
(2)取少量B溶液于试管中,向其滴加NaOH溶液。最初观察到白色沉淀,一会灰变为灰绿色,最终变为红褐色,沉淀颜色变化的原因是_______ (用化学方程式表示)。
(3)B溶液中加入KSCN溶液后,溶液中也产生了红色,其可能的原因是_____
(4)在上述实验中,同学们发现血红色溶液放置一段时间后,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙两位同学首先对此进行了猜想:
①你认为甲同学的猜想合理吗?_______ (填合理或不合理);请说明你的理由_______ 。
②基于乙同学的猜想,请设计一个简单的实验加以验证_______ 。

请回答下列问题:
(1)试剂1是
(2)取少量B溶液于试管中,向其滴加NaOH溶液。最初观察到白色沉淀,一会灰变为灰绿色,最终变为红褐色,沉淀颜色变化的原因是
(3)B溶液中加入KSCN溶液后,溶液中也产生了红色,其可能的原因是
(4)在上述实验中,同学们发现血红色溶液放置一段时间后,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙两位同学首先对此进行了猜想:
| 编号 | 猜想 |
| 甲 | 溶液中的+3价Fe又被还原成+2价铁 |
| 乙 | 溶液中的SCN-被过量的新制氯水氧化 |
②基于乙同学的猜想,请设计一个简单的实验加以验证
您最近一年使用:0次
2022-10-23更新
|
367次组卷
|
2卷引用:北京市首师附密云中学2021-2022学年高一上学期期中考试化学试题
解题方法
8 . 某研究性学习小组欲探究氯气的化学性质,设计如图所示的实验装置。
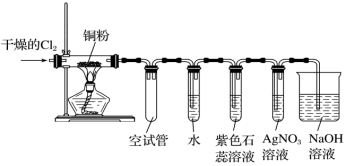
已知:该装置气密性良好;铜粉放在耐高温托盘内(防止硬质玻璃管炸裂)。请回答下列问题:
(1)为防止铜与空气中的氧气反应,在加热之前应该进行的操作为_____ 。
(2)当观察到AgNO3溶液中出现白色沉淀时,点燃酒精灯加热,写出生成白色沉淀的离子方程式:______ 。
(3)硬质玻璃管中的反应现象为______ 。
(4)实验进行一段时间后,盛有水的试管中溶液呈浅黄绿色,说明该溶液中含有的一种物质是_____ (填化学式),写出试管中反应的化学方程式 ______ 。
(5)实验中,观察到紫色石蕊溶液颜色的变化为_______ ,说明氯水具有的性质是_______ 、____ 。
(6)烧杯中氢氧化钠溶液中发生反应的化学方程式为_____ 。

已知:该装置气密性良好;铜粉放在耐高温托盘内(防止硬质玻璃管炸裂)。请回答下列问题:
(1)为防止铜与空气中的氧气反应,在加热之前应该进行的操作为
(2)当观察到AgNO3溶液中出现白色沉淀时,点燃酒精灯加热,写出生成白色沉淀的离子方程式:
(3)硬质玻璃管中的反应现象为
(4)实验进行一段时间后,盛有水的试管中溶液呈浅黄绿色,说明该溶液中含有的一种物质是
(5)实验中,观察到紫色石蕊溶液颜色的变化为
(6)烧杯中氢氧化钠溶液中发生反应的化学方程式为
您最近一年使用:0次
名校
解题方法
9 . 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示:
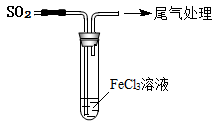
(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,发生反应的离子方程式为_______ 。
(2)按上图所示开始实验:
FeCl3溶液显酸性的原因是(用离子方程式表示)_______ 。
(3)当SO2通入到FeCl3溶液中,同学们观察到的现象是溶液立即由棕黄色变成红棕色。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】 Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成Fe(HSO3)2+离子的反应为可逆反应。
①请用化学用语表示SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子过程:_______ 。
②写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:_______ 。
③请应用反应速率和反应限度知识解释产生上述实验现象的原因:_______ 。
(4)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验。综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
II.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
III._______ 。

(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,发生反应的离子方程式为
(2)按上图所示开始实验:
| 步骤ⅰ | 配制1 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管中。然后缓缓通入SO2气体。 |
| 步骤ⅱ | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
| 步骤ⅲ | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
(3)当SO2通入到FeCl3溶液中,同学们观察到的现象是溶液立即由棕黄色变成红棕色。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】 Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。生成Fe(HSO3)2+离子的反应为可逆反应。
①请用化学用语表示SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子过程:
②写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:
③请应用反应速率和反应限度知识解释产生上述实验现象的原因:
(4)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验。综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
II.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
III.
您最近一年使用:0次
10 . 下述实验中均有红棕色气体产生,对比分析所得结论不正确的是
 | 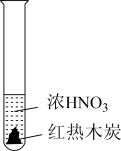 | 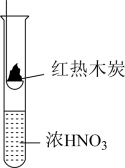 |
| ① | ② | ③ |
| A.由①中的红棕色气体,推断产生的气体一定是混合气体 |
| B.由②中的红棕色气体不能表明木炭与浓硝酸发生了反应 |
| C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物 |
| D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应 |
您最近一年使用:0次
2022-06-29更新
|
3711次组卷
|
81卷引用:北京市中国农业大学附属中学2020-2021学年高一上学期期末学业水平调研化学试题
北京市中国农业大学附属中学2020-2021学年高一上学期期末学业水平调研化学试题2017年全国普通高等学校招生统一考试理综化学(北京卷精编版)北京市清华大学附属中学2018届高三10月月考化学试题北京市一零一中学2018届高三10月月考化学试题北京一零一中2021届高三上学期第三次统练化学试题专题7 第一~二单元 综合拔高练-高中化学必修第二册苏教版2019(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 第二节 氮及其化合物(已下线)【浙江新东方】高中化学20210304-015黑龙江省哈尔滨市阿城区龙涤中学2020-2021学年高一4月月考化学试题黑龙江省哈尔滨市第一六二中学校2020-2021学年高一下学期4月月考化学试题浙江省诸暨市2021届高三5月适应性考试化学试题福建省泉州科技中学2020-2021学年高一下学期期中考试化学试题(苏教版2019)必修第二册专题7 氮与社会可持续发展 C 高考挑战区安徽省芜湖市2020-2021学年高一下学期期末质量检测联考化学试题(已下线)课时23 氮及其化合物-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点12 氮及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点12 氮及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第12讲 氮及其化合物(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)河南部分学校2022届新高三8月份摸底联考化学试题(已下线)专题07 常见非金属及其化合物-备战2022年高考化学学霸纠错(全国通用)北京市首师附密云中学2021-2022学年高一下学期等级考化学试题山东省菏泽市单县第二中学2021-2022学年高一上学期(实验班)12月段考化学试题河南省洛阳市第一高级中学2016-2017学年高一6月月考化学试题河北省衡水中学2018届高三上学期一调考试化学试题山东省淄博第一中学2018届高三上学期开学考试化学试题四川省德阳市三校2018届高三联合测试化学试题(已下线)黄金30题系列 高一化学 小题好拿分【提升版】广西陆川县中学2018届高三12月月考化学试题宁夏银川一中2017-2018学年高一上学期期末考试化学试题云南省峨山彝族自治县第一中学2018届高三上学期期末考试仿真化学试题黑龙江省伊春中学2017-2018学年高一化学上学期期末考试题河南省三门峡市2017-2018学年高一上学期期末考试化学试题广西陆川县中学2018届高三3月月考化学试题云南省玉溪第一中学2017-2018学年高一下学期4月月考化学试题云南省玉溪市玉溪一中2017-2018学年高一下学期4月月考化学试题(已下线)解密06 非金属及其化合物(教师版)——备战2018年高考化学之高频考点解密(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第4讲 氮及其化合物【教学案】云南省玉溪市峨山一中2019届高三9月月考化学试题江苏省常州市第一中学2019届高三第一学期期初(8月)考试化学试题【全国百强校】陕西省西安市长安区第一中学2018-2019学年高一上学期期末考试化学试题【全国百强校】山西省山西大学附属中学2018-2019学年高一下学期2月模块诊断化学试题福建省泉州市泉港区第一中学2018-2019学年高一下学期期中考试化学试题百所名校联考-非金属及其化合物内蒙古包头稀土高新区二中2020届高三10月月考理综化学试题四川省绵阳市南山中学2020届高三10月月考化学试题(已下线)2019年12月11日 《每日一题》化学人教版(必修1)——硝酸的强氧化性2020届高三化学二轮冲刺新题专练——硝酸的性质及应用(提升练)贵州省黔南布依族苗族自治州龙里中学2019-2020学年高三上学期期末考试理综化学试题贵州省长顺县二中2019-2020学年高三上学期期末考试理综化学试题贵州省施秉县一中2019-2020学年高三上学期期末考试化学试题(已下线)专题3.5 氮及其化合物 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》福建省福州市第一中学2020年高一在线自测自评质检化学试题贵州省贵阳市第一中学2020届高三教学质量监测理科综合化学试题安徽省池州市第一中学2019-2020学年高一下学期期中教学质量检测化学试题云南省昆明市寻甸县民族中学2019-2020学年高一下学期第一次月考化学试题湖南省长沙市雅礼中学2020届高三5月高考化学模拟试卷安徽省六安市舒城中学2019-2020学年高一下学期第一次月考化学试题(已下线)专题05 元素及其化合物-2020年高考真题和模拟题化学分项汇编(已下线)第12讲 氮及其化合物-2021年高考化学一轮复习名师精讲练2019年上海市高中生化学竞赛初赛试题(“华理一化工杯”)初赛试题鲁科版(2019)高一必修第一册第三章C 高考挑战区 过高考 3年真题强化闯关高一必修第一册(鲁科2019)第3章 第3节 氮的循环 高考帮(已下线)小题必刷20 氮及其化合物——2021年高考化学一轮复习小题必刷(通用版)湖南省长沙市雅礼中学2021届高三上学期第一次月考化学试题(已下线)【浙江新东方】48安徽省滁州市定远县重点中学2021届高三上学期11月质量检测化学试题(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP406】【化学】陕西省西安市长安区第一中学2019-2020学年高一上学期期末考试化学试题课后-5.2.3 硝酸 酸雨及防治-人教2019必修第二册云南省瑞丽市第一民族中学2021-2022学年高三下学期3月月考化学试题辽宁省沈阳市第二十中学2019-2020学年高一下学期第一次月考化学试题江西省吉安市2021-2022学年高二下学期期末检测化学试题(已下线)考点11 氮及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第14讲 氮及其化合物(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第13练 氮及其化合物-2023年高考化学一轮复习小题多维练(全国通用)广东省揭阳华侨高级中学2021-2022学年高一下学期第一次阶段化学试题第四章 非金属及其化合物 第23讲 硝酸 含氮化合物的转化关系巩固训练12(已下线)题型61 硝酸、硝酸盐的性质安徽省合肥市第一中学2022-2023学年高一下学期第4次月考化学试题(已下线)考点11 氮及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)