名校
解题方法
1 . 某课外小组探究Cu(Ⅱ)盐与Na2S2O3溶液的反应。
【查阅资料】
ⅰ. 2 +Cu2+
+Cu2+ [Cu(S2O3)2]2-(绿色),2
[Cu(S2O3)2]2-(绿色),2 +Cu+
+Cu+ [Cu(S2O3)2]3-(无色):
[Cu(S2O3)2]3-(无色):
ⅱ. 2NH3+Cu+ [Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+ (蓝色);
[Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+ (蓝色);
ⅲ. 易被氧化为
易被氧化为 或
或 。
。
【猜想假设】
同学们根据资料认为Cu(Ⅱ)盐与Na2S2O3可能会发生两种反应:
假设1:Cu2+与 在溶液中发生配合反应生成[Cu(S2O3)2]2-;
在溶液中发生配合反应生成[Cu(S2O3)2]2-;
假设2:Cu(Ⅱ)有氧化性,Cu2+与 在溶液中发生氧化还原反应。
在溶液中发生氧化还原反应。
【实验操作及现象分析】
实验一:探究CuSO4与Na2S2O3溶液的反应。
(1)根据实验a的现象可推测溶液中生成的含Cu微粒是___________ (填化学式)。
(2)甲同学认为实验一可证明假设2成立,他的理由是___________ 。
实验二:探究CuCl2与Na2S2O3的反应。___________ (补全实验方案),则说明含Cu(Ⅰ)。
(4)经检验白色沉淀中含CuCl,请写出继续加Na2S2O3溶液后CuCl沉淀溶解的离子方程式:___________ 。
(5)经检验氧化产物以 形式存在,写出Cu2+与
形式存在,写出Cu2+与 发生氧化还原反应得到无色溶液的离子方程式:
发生氧化还原反应得到无色溶液的离子方程式:___________ 。
【获得结论】
(6)综合以上实验,同学们认为Cu(Ⅱ)盐与Na2S2O3在溶液中的反应与多种因素有关,得到实验结论,选择合适的选项填入下面的横线中。
A配合反应 B.氧化还原反应 C.置换反应 D.复分解反应
①随n( ):n(Cu2+)的增大,二者发生
):n(Cu2+)的增大,二者发生___________ 的趋势减弱;
②Cu(Ⅱ)盐的阴离子为Cl-时能增大Cu2+和 发生
发生___________ 的趋势。
【查阅资料】
ⅰ. 2
 +Cu2+
+Cu2+ [Cu(S2O3)2]2-(绿色),2
[Cu(S2O3)2]2-(绿色),2 +Cu+
+Cu+ [Cu(S2O3)2]3-(无色):
[Cu(S2O3)2]3-(无色):ⅱ. 2NH3+Cu+
 [Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+ (蓝色);
[Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+ (蓝色);ⅲ.
 易被氧化为
易被氧化为 或
或 。
。【猜想假设】
同学们根据资料认为Cu(Ⅱ)盐与Na2S2O3可能会发生两种反应:
假设1:Cu2+与
 在溶液中发生配合反应生成[Cu(S2O3)2]2-;
在溶液中发生配合反应生成[Cu(S2O3)2]2-;假设2:Cu(Ⅱ)有氧化性,Cu2+与
 在溶液中发生氧化还原反应。
在溶液中发生氧化还原反应。【实验操作及现象分析】
实验一:探究CuSO4与Na2S2O3溶液的反应。
| 实验操作 | 实验序号 | V1(mL) | V2(mL) | 逐滴加入Na2S2O3溶液时的实验现象 |
| a | 1.5 | 0.5 | 溶液逐渐变为绿色,静置无变化 |
| b | 1.0 | 1.0 | 溶液先变为绿色,后逐渐变成浅绿色,静置无变化 | |
| c | 0 | 2.0 | 溶液先变为绿色,后逐渐变浅至无色,静置无变化 |
(1)根据实验a的现象可推测溶液中生成的含Cu微粒是
(2)甲同学认为实验一可证明假设2成立,他的理由是
实验二:探究CuCl2与Na2S2O3的反应。
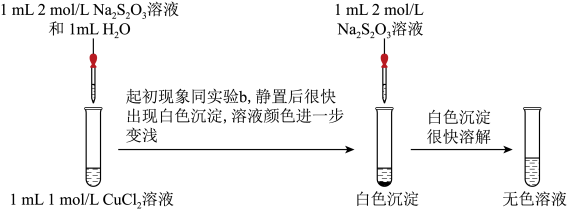
(4)经检验白色沉淀中含CuCl,请写出继续加Na2S2O3溶液后CuCl沉淀溶解的离子方程式:
(5)经检验氧化产物以
 形式存在,写出Cu2+与
形式存在,写出Cu2+与 发生氧化还原反应得到无色溶液的离子方程式:
发生氧化还原反应得到无色溶液的离子方程式:【获得结论】
(6)综合以上实验,同学们认为Cu(Ⅱ)盐与Na2S2O3在溶液中的反应与多种因素有关,得到实验结论,选择合适的选项填入下面的横线中。
A配合反应 B.氧化还原反应 C.置换反应 D.复分解反应
①随n(
 ):n(Cu2+)的增大,二者发生
):n(Cu2+)的增大,二者发生②Cu(Ⅱ)盐的阴离子为Cl-时能增大Cu2+和
 发生
发生
您最近半年使用:0次
名校
2 . 实验室用下图装置(夹持装置已略去)制备 ,并研究其性质。其中,a、b为湿润的红色石蕊试纸。
,并研究其性质。其中,a、b为湿润的红色石蕊试纸。
 ,并研究其性质。其中,a、b为湿润的红色石蕊试纸。
,并研究其性质。其中,a、b为湿润的红色石蕊试纸。 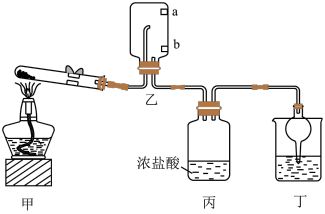
| A.装置乙中,a比b先变蓝 | B.装置丙中,产生大量白烟 |
| C.装置丁中,试剂只能是水 | D.装置丁具有防止倒吸的作用 |
您最近半年使用:0次
名校
解题方法
3 . 小组同学为探究 与可溶性钡的强酸盐能否反应生成
与可溶性钡的强酸盐能否反应生成 沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
(1)A中反应的化学方程式是___________ 。
(2)C中白色沉淀是___________ ,该沉淀的生成表明 具有
具有___________ 性。
(3)分析B中不溶于稀盐酸的沉淀产生的原因,甲同学认为是空气参与反应,乙同学认为是白雾参与反应。
①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是___________ ;乙在A、B间增加洗气瓶D,D中盛放的试剂是足量饱和 溶液,其目的是除去
溶液,其目的是除去___________ (写化学式)。
②进行实验,B中现象:
检验白色沉淀,发现均不溶于稀盐酸。分别用离子方程式解释白色沉淀产生的原因:___________ 。
(4)合并(3)中两同学的方案进行实验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是___________ 。
 与可溶性钡的强酸盐能否反应生成
与可溶性钡的强酸盐能否反应生成 沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。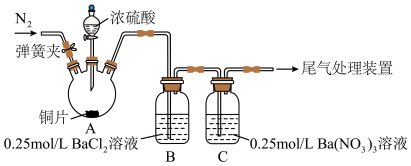
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅红棕色并逐渐消失 |
打开弹簧夹,通入 ,停止加热,一段时间后关闭 ,停止加热,一段时间后关闭 | —— |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
(1)A中反应的化学方程式是
(2)C中白色沉淀是
 具有
具有(3)分析B中不溶于稀盐酸的沉淀产生的原因,甲同学认为是空气参与反应,乙同学认为是白雾参与反应。
①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是
 溶液,其目的是除去
溶液,其目的是除去②进行实验,B中现象:
| 甲 | 大量白色沉淀 | 乙 | 少量白色沉淀 |
(4)合并(3)中两同学的方案进行实验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是
您最近半年使用:0次
名校
解题方法
4 . 研究铜与硝酸的反应,实验如下(加持装置和尾气处理装置略)。
(1)实验Ⅰ产生红棕色气体的离子方程式是___________ 。实验Ⅱ产生红棕色气体的化学方程式是___________ 。
(2)对实验Ⅰ所得溶液呈绿色,而实验Ⅱ所得溶液呈蓝色的原因提出猜想。
查阅资料:i. 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;
ii. 。
。 是弱酸,不稳定。
是弱酸,不稳定。
猜想一: 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色 溶液混合而呈现绿色。
溶液混合而呈现绿色。
猜想二: 电离出的
电离出的 与
与 结合为
结合为 (绿色)。
(绿色)。
①向浓硝酸中通入 ,现象是
,现象是___________ ,滴加少量蓝色 溶液后呈绿色,证实猜想一合理。
溶液后呈绿色,证实猜想一合理。
②研究猜想二是否为实验Ⅰ所得溶液呈绿色的主要原因,实验如下。 的证据是
的证据是___________ 。
Ⅱ.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,说明理由:___________ 。
| 装置 | 编号 | 试剂a | 现象 |
| Ⅰ | 4mL浓硝酸(过量) | 铜片完全溶解,溶液变绿,出现大量红棕色气体。 |
| Ⅱ | 4mL稀硝酸(过量) | 铜片完全溶解,溶液变蓝,液面上方气体呈浅红棕色。 |
(1)实验Ⅰ产生红棕色气体的离子方程式是
(2)对实验Ⅰ所得溶液呈绿色,而实验Ⅱ所得溶液呈蓝色的原因提出猜想。
查阅资料:i.
 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;ii.
 。
。 是弱酸,不稳定。
是弱酸,不稳定。猜想一:
 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色 溶液混合而呈现绿色。
溶液混合而呈现绿色。猜想二:
 电离出的
电离出的 与
与 结合为
结合为 (绿色)。
(绿色)。①向浓硝酸中通入
 ,现象是
,现象是 溶液后呈绿色,证实猜想一合理。
溶液后呈绿色,证实猜想一合理。②研究猜想二是否为实验Ⅰ所得溶液呈绿色的主要原因,实验如下。

 的证据是
的证据是Ⅱ.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,说明理由:
您最近半年使用:0次
名校
解题方法
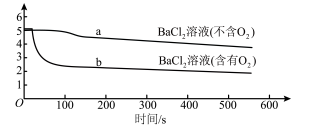
5 . 分别向等体积的不含O2、含有O2的0.1mol/L BaCl2溶液中通入SO2,探究体系中物质间的相互作用,实验记录如下。(已知:pH越小,溶液酸性越强)
下列说法不正确的是
下列说法不正确的是
pH变化 |
|
溶液中是否产生沉淀 | 不含O2的BaCl2溶液中没有白色沉淀, 含有O2的BaCl2溶液中产生白色沉淀。 |
| A.a所示溶液的pH降低的原因:SO2与H2O反应生成H2SO3,溶液的c(H+)增大 |
B.b所示溶液中发生反应: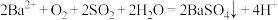 |
| C. SO2通入不含O2的BaCl2溶液后,再加入NaOH溶液,产生BaSO3沉淀 |
D.b比a所示溶液的pH小的原因: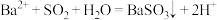 |
您最近半年使用:0次
6 . 氧化还原反应可拆分为氧化和还原两个“半反应”,某小组同学从“半反应”的角度探究反应规律。
(1)已知: 的转化在酸性条件下才能发生。
的转化在酸性条件下才能发生。
①该转化的还原半反应是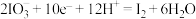 ,则相应的氧化半反应是
,则相应的氧化半反应是___________ 。
②分析上述还原半反应可知:增大 可促进
可促进 得到电子,使其
得到电子,使其___________ 性增强,进而与 发生反应。
发生反应。
(2)探究 与浓盐酸能否发生反应。
与浓盐酸能否发生反应。
①有同学认为 与浓盐酸不能发生反应产生氢气,其依据是
与浓盐酸不能发生反应产生氢气,其依据是___________ 。
用如下装置进行实验【硫酸与浓盐酸中 接近】。
接近】。
②甲实验的目的是___________ 。
③a.丙中气球变鼓是因为生成了___________ 气体(填化学式)。
b.经检测,丙中反应后溶液中存在 。从物质性质角度分析丙中反应能够发生的原因:
。从物质性质角度分析丙中反应能够发生的原因:___________ 。
(3)探究以下原电池的工作原理。
实验结果:产生电流,左侧 电极表面有
电极表面有 析出。
析出。
①该装置中左侧  电极作
电极作___________ (填“正”或“负”)极。
②写出该装置右侧 烧杯中的电极反应式___________ 。
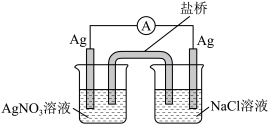
对该原电池的电极反应和总反应的反应类型进行分析,发现两极上分别发生氧化和还原反应,而总反应不一定是氧化还原反应。
③结合上述实验思考,仅由以下实验用品能否设计成原电池__________ 。
 片、
片、 浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
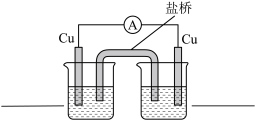
a.若能,在右装置图中填写烧杯中的试剂,并标出电子的移动方向 。
b.若不能,说明原因。
(1)已知:
 的转化在酸性条件下才能发生。
的转化在酸性条件下才能发生。①该转化的还原半反应是
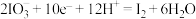 ,则相应的氧化半反应是
,则相应的氧化半反应是②分析上述还原半反应可知:增大
 可促进
可促进 得到电子,使其
得到电子,使其 发生反应。
发生反应。(2)探究
 与浓盐酸能否发生反应。
与浓盐酸能否发生反应。①有同学认为
 与浓盐酸不能发生反应产生氢气,其依据是
与浓盐酸不能发生反应产生氢气,其依据是用如下装置进行实验【硫酸与浓盐酸中
 接近】。
接近】。| 装置 | 序号 | 试管内药品 | 现象 |
 | 甲 | 浓盐酸 | 24小时后仍无明显变化 |
| 乙 |  粉+硫酸 粉+硫酸 | 24小时后仍无明显变化 | |
| 丙 |  粉+浓盐酸 粉+浓盐酸 | 24小时后气球变鼓 |
③a.丙中气球变鼓是因为生成了
b.经检测,丙中反应后溶液中存在
 。从物质性质角度分析丙中反应能够发生的原因:
。从物质性质角度分析丙中反应能够发生的原因:(3)探究以下原电池的工作原理。
实验结果:产生电流,左侧
 电极表面有
电极表面有 析出。
析出。①该装置中
 电极作
电极作②写出该装置

对该原电池的电极反应和总反应的反应类型进行分析,发现两极上分别发生氧化和还原反应,而总反应不一定是氧化还原反应。
③结合上述实验思考,仅由以下实验用品能否设计成原电池
 片、
片、 浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
a.若能,在右装置图中填写烧杯中的试剂,
b.若不能,说明原因。
您最近半年使用:0次
名校
解题方法
7 . 某同学进行如下实验:
①将H2O2溶液与KI溶液混合,产生大量气泡,溶液颜色变黄;
②将①中的黄色溶液分成两等份,一份加入CCl4,振荡,产生气泡速率明显减小,下层溶液呈紫红色;另一份不加CCl4,振荡,产生气泡速率无明显变化。
下列说法不正确 的是
①将H2O2溶液与KI溶液混合,产生大量气泡,溶液颜色变黄;
②将①中的黄色溶液分成两等份,一份加入CCl4,振荡,产生气泡速率明显减小,下层溶液呈紫红色;另一份不加CCl4,振荡,产生气泡速率无明显变化。
下列说法
| A.①中溶液颜色变黄的原因是:H2O2+2I-=I2+2OH- |
| B.②中下层溶液呈紫红色是因为I2溶于CCl4 |
| C.②中产生气泡速率减小的原因是H2O2浓度减小 |
| D.由该实验可知,I2可以加快H2O2分解产生气泡反应速率 |
您最近半年使用:0次
7日内更新
|
184次组卷
|
2卷引用:北京市朝阳区2023-2024学年高三下学期一模化学试题
8 . 兴趣小组查阅文献后,设计实验对苯酚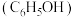 的性质进行探究,回答以下问题。
的性质进行探究,回答以下问题。
已知:ⅰ. 25℃,相关弱酸的电离平衡常数如下:Ka1(H2CO3)=4.2×10−7,Ka2(H2CO3)=5.6×10−11,Ka(C6H5OH)=1.3×10−10。
ⅱ.苯酚与 显色反应的化学方程式为:Fe3++6C6H5OH
显色反应的化学方程式为:Fe3++6C6H5OH [Fe(C6H5O)6]3−(紫色)+6H+。
[Fe(C6H5O)6]3−(紫色)+6H+。
Ⅰ.探究苯酚酸性的强弱
(1)苯酚的电离方程式为___________ 。
(2)兴趣小组按如图装置进行实验,证明酸性强弱顺序为CH3COOH>H2CO3> C6H5OH,所依据的实验现象为___________ ,C中反应的化学方程式为___________ 。
兴趣小组对以上实验的现象提出猜想。
猜想1: 对铁离子与苯酚的反应有促进作用。
对铁离子与苯酚的反应有促进作用。
猜想2: 对铁离子与苯酚的反应有抑制作用。
对铁离子与苯酚的反应有抑制作用。
(3)向实验1反应后溶液中继续加入 固体,若溶液颜色无变化,则可得出的结论是
固体,若溶液颜色无变化,则可得出的结论是___________ 。
(4)向实验1反应后溶液中加入___________ 固体(填化学式),若溶液颜色变为浅紫色,说明猜想2成立。
(5)兴趣小组同学提出猜想3:溶液的 会影响显色效果,并设计如下实验进行验证。
会影响显色效果,并设计如下实验进行验证。
①实验4中生成的红褐色沉淀是___________ (填化学式)。
②实验5中滴加盐酸至过量,溶液由紫色变为浅黄色,结合平衡移动原理解释原因___________ 。
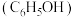 的性质进行探究,回答以下问题。
的性质进行探究,回答以下问题。已知:ⅰ. 25℃,相关弱酸的电离平衡常数如下:Ka1(H2CO3)=4.2×10−7,Ka2(H2CO3)=5.6×10−11,Ka(C6H5OH)=1.3×10−10。
ⅱ.苯酚与
 显色反应的化学方程式为:Fe3++6C6H5OH
显色反应的化学方程式为:Fe3++6C6H5OH [Fe(C6H5O)6]3−(紫色)+6H+。
[Fe(C6H5O)6]3−(紫色)+6H+。Ⅰ.探究苯酚酸性的强弱
(1)苯酚的电离方程式为
(2)兴趣小组按如图装置进行实验,证明酸性强弱顺序为CH3COOH>H2CO3> C6H5OH,所依据的实验现象为
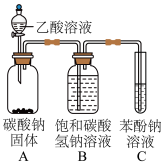
| 实验1 | 实验2 |
|
|
猜想1:
 对铁离子与苯酚的反应有促进作用。
对铁离子与苯酚的反应有促进作用。猜想2:
 对铁离子与苯酚的反应有抑制作用。
对铁离子与苯酚的反应有抑制作用。(3)向实验1反应后溶液中继续加入
 固体,若溶液颜色无变化,则可得出的结论是
固体,若溶液颜色无变化,则可得出的结论是(4)向实验1反应后溶液中加入
(5)兴趣小组同学提出猜想3:溶液的
 会影响显色效果,并设计如下实验进行验证。
会影响显色效果,并设计如下实验进行验证。| 实验 | 操作 | 现象 |
| 3 | 向2mL苯酚溶液(调节 )中滴加0.1mol/LFeCl3溶液 )中滴加0.1mol/LFeCl3溶液 | 溶液显紫色 |
| 4 | 向2mL苯酚溶液(调节 )中滴加0.1mol/LFeCl3溶液 )中滴加0.1mol/LFeCl3溶液 | 生成红褐色沉淀 |
| 5 | 向实验4所得悬浊液中逐滴加入0.1mol/L盐酸至过量 | 沉淀逐渐溶解,溶液变为紫色;继续滴加盐酸,溶液由紫色变为浅黄色 |
②实验5中滴加盐酸至过量,溶液由紫色变为浅黄色,结合平衡移动原理解释原因
您最近半年使用:0次
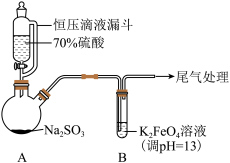
9 . 某实验小组探究SO2与K2FeO4的反应,实验如下。
资料:i.K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
ii.Fe3+可以与C2O 形成[Fe(C2O4)3]3-;
形成[Fe(C2O4)3]3-;
(1)A中产生SO2的化学方程式为___________ 。
(2)暗红褐色沉淀X可能含Fe3+、OH-、SO 、SO
、SO ,检验如下:
,检验如下:
实验二:向X中加入足量盐酸,沉淀溶解。取少量溶液,滴加KSCN溶液后变红。证明溶液中存在___________ 。另取少量溶液滴加BaCl2溶液,产生白色沉淀,但不能确认含有SO ,原因是
,原因是___________ 。
实验三:向X中加入H2C2O4溶液,沉淀溶解。继续滴加BaCl2溶液,产生白色沉淀,过滤后,向沉淀中加入盐酸,白色沉淀溶解。确认X中不含SO 。
。
实验三中用H2C2O4溶液溶解沉淀的目的是:___________ 。
实验四:向X中加入足量盐酸,沉淀溶解。加入几滴碘水(含淀粉),蓝色立即褪去。静置,一段时间后蓝色复现,振荡,不褪色。
结合离子方程式解释沉淀溶解后的现象:___________ 。
(3)查阅资料:a.Fe3+、SO 、H2O(或OH﹣)会形成配合物HOFeOSO2。
、H2O(或OH﹣)会形成配合物HOFeOSO2。 和O2在金属离子的催化作用下产生具有强氧化性的过一硫酸(HSO
和O2在金属离子的催化作用下产生具有强氧化性的过一硫酸(HSO
①向溶液Y中滴加2滴KSCN溶液,未见红色;再加几滴6mol·L-1盐酸,溶液变红。溶液Y中存在Fe(Ⅲ),但直接滴加KSCN溶液未见红色的原因是___________ 。
②取出部分实验一中的橙色溶液,久置不褪色。结合资料a中过程ii分析实验一中溶液最终“几乎无色”的原因:___________ 。
总结:SO2与K2FeO4发生了氧化还原反应和复分解反应,并且遵循化学反应速率和限度规律。
资料:i.K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
ii.Fe3+可以与C2O
 形成[Fe(C2O4)3]3-;
形成[Fe(C2O4)3]3-;| 装置 | 操作及现象 |
| 实验一:向B中通入SO2,产生暗红褐色沉淀X和溶液Y(略显红色);继续通入SO2一段时间后,溶液呈红色,继而变为橙色,最终沉淀消失,溶液几乎无色。 |
(1)A中产生SO2的化学方程式为
(2)暗红褐色沉淀X可能含Fe3+、OH-、SO
 、SO
、SO ,检验如下:
,检验如下:实验二:向X中加入足量盐酸,沉淀溶解。取少量溶液,滴加KSCN溶液后变红。证明溶液中存在
 ,原因是
,原因是实验三:向X中加入H2C2O4溶液,沉淀溶解。继续滴加BaCl2溶液,产生白色沉淀,过滤后,向沉淀中加入盐酸,白色沉淀溶解。确认X中不含SO
 。
。实验三中用H2C2O4溶液溶解沉淀的目的是:
实验四:向X中加入足量盐酸,沉淀溶解。加入几滴碘水(含淀粉),蓝色立即褪去。静置,一段时间后蓝色复现,振荡,不褪色。
结合离子方程式解释沉淀溶解后的现象:
(3)查阅资料:a.Fe3+、SO
 、H2O(或OH﹣)会形成配合物HOFeOSO2。
、H2O(或OH﹣)会形成配合物HOFeOSO2。
 和O2在金属离子的催化作用下产生具有强氧化性的过一硫酸(HSO
和O2在金属离子的催化作用下产生具有强氧化性的过一硫酸(HSO
①向溶液Y中滴加2滴KSCN溶液,未见红色;再加几滴6mol·L-1盐酸,溶液变红。溶液Y中存在Fe(Ⅲ),但直接滴加KSCN溶液未见红色的原因是
②取出部分实验一中的橙色溶液,久置不褪色。结合资料a中过程ii分析实验一中溶液最终“几乎无色”的原因:
总结:SO2与K2FeO4发生了氧化还原反应和复分解反应,并且遵循化学反应速率和限度规律。
您最近半年使用:0次
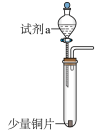
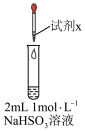
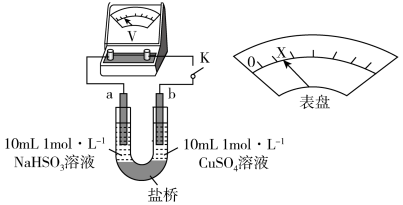
10 . 实验小组对NaHSO3溶液分别与CuCl2、CuSO4溶液的反应进行探究。
已知:Cu+ [Cu(NH3)2]+(无色溶液)
[Cu(NH3)2]+(无色溶液) [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)
(1)推测实验I产生的无色气体为SO2,实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到蓝色褪去。反应的离子方程式为___________ 。
(2)对实验I产生SO2的原因进行分析,提出假设:
假设a:Cu2+水解使溶液中c(H+)增大;
假设b:Cl-存在时,Cu2+与 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。
①假设a不合理,实验证据是___________ 。
②实验表明假设b合理,实验I反应的离子方程式有___________ 、 。
。
(3)对比实验I、II,根据半反应就物质的氧化性还原性提出假设:Cl-___________ 。
下述实验III证实了假设合理,装置如下图。___________ (补全实验操作及现象)。
(4)将实验I的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和 。
。
①通过实验IV证实红色沉淀中含有Cu+和Cu2+。
实验IV:证实红色沉淀中含有Cu+的实验证据是___________ 。___________ 。
②有同学认为实验IV不足以证实红色沉淀中含有Cu2+,设计实验IV的对比实验Ⅴ,证实了Cu2+的存在。实验V的方案和现象是:___________ 。
| 实验 | 装置 | 试剂x | 操作及现象 |
| I |
| 1 mol/LCuCl2溶液 | 加入2mLCuCl2溶液,得到绿色溶液,30s时有无色气泡和白色沉淀产生,上层溶液颜色变浅 |
| II | 1 mol/LCuSO4溶液 | 加入2mL CuSO4溶液,得到绿色溶液,3分钟未见明显变化 |
 [Cu(NH3)2]+(无色溶液)
[Cu(NH3)2]+(无色溶液) [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)(1)推测实验I产生的无色气体为SO2,实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到蓝色褪去。反应的离子方程式为
(2)对实验I产生SO2的原因进行分析,提出假设:
假设a:Cu2+水解使溶液中c(H+)增大;
假设b:Cl-存在时,Cu2+与
 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。①假设a不合理,实验证据是
②实验表明假设b合理,实验I反应的离子方程式有
 。
。(3)对比实验I、II,根据半反应就物质的氧化性还原性提出假设:Cl-
下述实验III证实了假设合理,装置如下图。
(4)将实验I的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和
 。
。①通过实验IV证实红色沉淀中含有Cu+和Cu2+。
实验IV:证实红色沉淀中含有Cu+的实验证据是
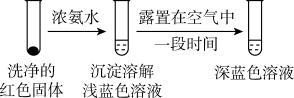
②有同学认为实验IV不足以证实红色沉淀中含有Cu2+,设计实验IV的对比实验Ⅴ,证实了Cu2+的存在。实验V的方案和现象是:
您最近半年使用:0次