名校
1 . 研究氮及其化合物的性质对化工生产和环境保护有重要意义。
Ⅰ.某小组探究浓度对硝酸氧化能力的影响。
资料显示:浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO;氢氧化钠溶液能吸 收NO2, 但不能吸收 NO。该小组按如图装置进行验证实验(夹持仪器已略去)。___________ 。
(2)装置③中盛放的试剂为___________ 。
(3)能证明不同浓度硝酸氧化能力的相对强弱的实验现象为___________ 。
Ⅱ.车尾气中的NOx是一种常见的大气污染物。在2L密闭容器中,800℃时发生反应:2NO(g)+O2 (g)=2NO2(g), 体系中n(NO) 随时间的变化如表:
(4)下图表示NO2的浓度变化的曲线是___________ 。___________ 。
(6)能说明该反应已达到平衡状态的是___________。
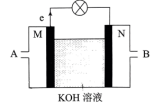
Ⅲ.化学能与其他能量间的转换在生活中处处可见,以反应N2H4+O2=N2+2H2O 为原理设计成利用率高的燃料电池,装置如图。___________ (填“正”或“负”)极, M 处电极反应式为___________ 。
Ⅰ.某小组探究浓度对硝酸氧化能力的影响。
资料显示:浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO;氢氧化钠溶液能吸 收NO2, 但不能吸收 NO。该小组按如图装置进行验证实验(夹持仪器已略去)。
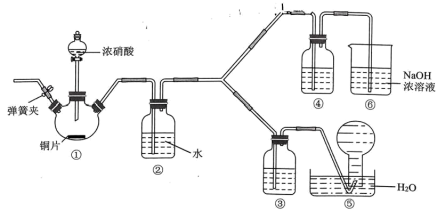
(2)装置③中盛放的试剂为
(3)能证明不同浓度硝酸氧化能力的相对强弱的实验现象为
Ⅱ.车尾气中的NOx是一种常见的大气污染物。在2L密闭容器中,800℃时发生反应:2NO(g)+O2 (g)=2NO2(g), 体系中n(NO) 随时间的变化如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
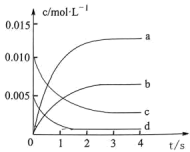
(6)能说明该反应已达到平衡状态的是___________。
| A.容器内气体的颜色不再变化 | B.容器内气体的总质量保持不变 |
| C.正反应和逆反应的速率相等 | D.NO、O2和NO2的物质的量之比为2:1:2 |
Ⅲ.化学能与其他能量间的转换在生活中处处可见,以反应N2H4+O2=N2+2H2O 为原理设计成利用率高的燃料电池,装置如图。
您最近一年使用:0次
7日内更新
|
81次组卷
|
3卷引用:河南省安阳市林州市第一中学2024-2025学年高二上学期8月月考化学试题
解题方法
2 . 1777年,卡尔·威廉·舍勒发现了氨气并确定了其化学性质。受此启发,某小组探究 还原
还原 的固体产物。装置如下图所示。
的固体产物。装置如下图所示。
(1)Fe位于元素周期表_______ 区。
(2)导管L的作用是_______ 。装置D中倒置漏斗的作用是_______ 。
(3)装置B中试剂宜选择_______ (填字母)。
a. b.碱石灰 c.
b.碱石灰 c.
(4)写出装置A中反应的化学方程式:_______ 。
(5)实验中观察到装置C中硬质玻璃管中红色粉末变为黑色粉末(M),硬质玻璃管内壁有液珠。小组进一步探究M成分:
[提出假设]
假设1:M是Fe;
假设2:M是FeO和 混合物;
混合物;
假设3:M是Fe、FeO和 混合物。
混合物。
[设计实验]
①甲同学用强磁铁接近黑色粉末,发现能吸附黑色粉末,他认为假设1成立,丁同学认为他的观点不合理,原因是_______ 。
②乙同学取少量黑色粉末溶于稀硫酸,滴加KSCN溶液,未见溶液变红色,他认为假设2、3一定不成立。他的观点是否合理:_______ (填“合理”或“不合理”),并说明理由:_______ 。
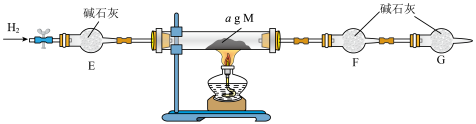
③丙同学设计下图装置定量分析M的成分。 ,且
,且 ,则M的成分是
,则M的成分是_____ (填化学式)。
 还原
还原 的固体产物。装置如下图所示。
的固体产物。装置如下图所示。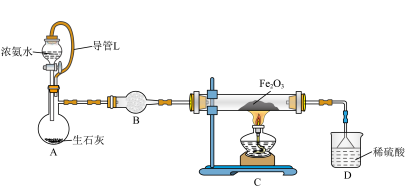
(1)Fe位于元素周期表
(2)导管L的作用是
(3)装置B中试剂宜选择
a.
 b.碱石灰 c.
b.碱石灰 c.
(4)写出装置A中反应的化学方程式:
(5)实验中观察到装置C中硬质玻璃管中红色粉末变为黑色粉末(M),硬质玻璃管内壁有液珠。小组进一步探究M成分:
[提出假设]
假设1:M是Fe;
假设2:M是FeO和
 混合物;
混合物;假设3:M是Fe、FeO和
 混合物。
混合物。[设计实验]
①甲同学用强磁铁接近黑色粉末,发现能吸附黑色粉末,他认为假设1成立,丁同学认为他的观点不合理,原因是
②乙同学取少量黑色粉末溶于稀硫酸,滴加KSCN溶液,未见溶液变红色,他认为假设2、3一定不成立。他的观点是否合理:
③丙同学设计下图装置定量分析M的成分。
 ,且
,且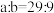 ,则M的成分是
,则M的成分是
您最近一年使用:0次
3 .  常作有机反应的催化剂。某实验小组拟制备
常作有机反应的催化剂。某实验小组拟制备 并探究其性质。
并探究其性质。
实验(一)制备 。
。
装置如图1所示。已知: 沸点为58.8℃。实验中,观察到烧瓶中产生红棕色气体。
沸点为58.8℃。实验中,观察到烧瓶中产生红棕色气体。_______ (填“溴水”或“液溴”)。用铁粉替代铁片的目的是_______ 。
(2)装置中利用到的四氯化碳的性质是_______ 。实验完毕后,将烧瓶中混合物经_______ (填实验操作名称)得到 固体。
固体。
实验(二)探究性质。
为了探究的稳定性,进行如图2实验。_______ (填实验现象)时,可以确认 发生分解反应,生成了
发生分解反应,生成了 。
。
(4)实验过程中,先通入一会儿 ,再点燃酒精灯,这样操作的目的是
,再点燃酒精灯,这样操作的目的是_______ 。
(5)为确认玻璃管中残留物有 ,宜选择试剂
,宜选择试剂_______ (填标号)。
a. 溶液 b.酸性
溶液 b.酸性 溶液
溶液
c.KSCN溶液,氯水 d. 溶液
溶液
(6)为了探究浓度对 氧化性的影响,实验操作及现象如下:
氧化性的影响,实验操作及现象如下:
已知: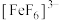 呈无色。
呈无色。
写出实验ⅰ中离子反应方程式:_______ 。
实验ⅱ“不变蓝色”的原因是_______ (结合必要化学用语和文字解释)。
 常作有机反应的催化剂。某实验小组拟制备
常作有机反应的催化剂。某实验小组拟制备 并探究其性质。
并探究其性质。实验(一)制备
 。
。装置如图1所示。已知:
 沸点为58.8℃。实验中,观察到烧瓶中产生红棕色气体。
沸点为58.8℃。实验中,观察到烧瓶中产生红棕色气体。
(2)装置中利用到的四氯化碳的性质是
 固体。
固体。实验(二)探究性质。
为了探究的稳定性,进行如图2实验。
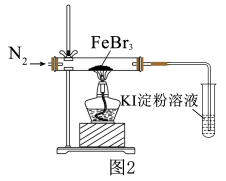
 发生分解反应,生成了
发生分解反应,生成了 。
。(4)实验过程中,先通入一会儿
 ,再点燃酒精灯,这样操作的目的是
,再点燃酒精灯,这样操作的目的是(5)为确认玻璃管中残留物有
 ,宜选择试剂
,宜选择试剂a.
 溶液 b.酸性
溶液 b.酸性 溶液
溶液c.KSCN溶液,氯水 d.
 溶液
溶液(6)为了探究浓度对
 氧化性的影响,实验操作及现象如下:
氧化性的影响,实验操作及现象如下:实验 | 操作 | 现象 |
ⅰ | 向2mL0.1mol 溶液中滴加KI淀粉溶液 溶液中滴加KI淀粉溶液 | 溶液变蓝色 |
ⅱ | 向2mL0.1mol 溶液中先加入适量NaF固体,后滴加KI淀粉溶液 溶液中先加入适量NaF固体,后滴加KI淀粉溶液 | 溶液不变蓝色 |
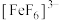 呈无色。
呈无色。写出实验ⅰ中离子反应方程式:
实验ⅱ“不变蓝色”的原因是
您最近一年使用:0次
2024-09-11更新
|
201次组卷
|
2卷引用:河南省驻马店市新蔡县新蔡县第一高级中学2024-2025学年高三上学期开学化学试题
4 . 设计如图装置(夹持装置省略)检验钠与水反应的产物,先在U形管内加入少量煤油和几粒钠块,再从U形管高端加入水(含有酚酞),打开止气夹,赶出空气,一段时间后加热铜丝。下列说法正确的是

| A.钠块在煤油和水交界处四处游走,直至消失 |
B.铜丝由黑色变成红色,说明有 生成 生成 |
| C.U形管溶液右侧从上到下逐渐由无色变为红色 |
D.钠与水反应的离子方程式: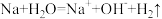 |
您最近一年使用:0次
名校
解题方法
5 . 某兴趣小组的学生根据Mg与CO2反应的原理推测钠也能在CO2中燃烧,为了确定其产物并进行实验论证,某同学设计了下列装置进行实验(已知PdCl2能被CO还原为Pd),请回答下列问题:_______ (填字母)。
(2)检查装置的气密性完好并装好药品后,在点燃酒精灯前,应先进行装置1的操作,待装置_______ (填数字)中出现_______ 的现象时,再点燃酒精灯。
(3)①若装置6中有黑色沉淀(Pd)生成,装置4中残留固体(只有一种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为_______ 。
②若装置6中无明显现象,装置4中残留固体(有两种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为_______ 。
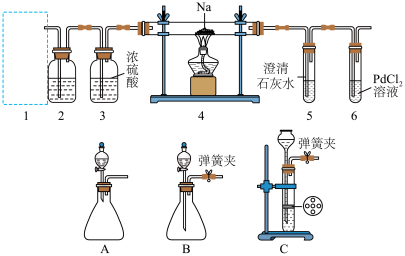
(2)检查装置的气密性完好并装好药品后,在点燃酒精灯前,应先进行装置1的操作,待装置
(3)①若装置6中有黑色沉淀(Pd)生成,装置4中残留固体(只有一种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为
②若装置6中无明显现象,装置4中残留固体(有两种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为
您最近一年使用:0次
解题方法
6 . 某化学兴趣小组进行如下实验探究:
①将少量银镜(表面有 的玻璃)捣碎,加入
的玻璃)捣碎,加入 溶液中,银镜渐渐溶解,溶液黄色明显变浅;
溶液中,银镜渐渐溶解,溶液黄色明显变浅;
②取实验①上层澄清溶液于试管中,滴加氯水,出现白色浑浊,静置后,在上层清液中滴加 溶液,溶液变为红色。
溶液,溶液变为红色。
下列有关说法错误的是
①将少量银镜(表面有
 的玻璃)捣碎,加入
的玻璃)捣碎,加入 溶液中,银镜渐渐溶解,溶液黄色明显变浅;
溶液中,银镜渐渐溶解,溶液黄色明显变浅;②取实验①上层澄清溶液于试管中,滴加氯水,出现白色浑浊,静置后,在上层清液中滴加
 溶液,溶液变为红色。
溶液,溶液变为红色。下列有关说法错误的是
A.实验①中反应的离子方程式有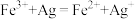 |
B.由实验①可推出: 溶液可能溶解单质 溶液可能溶解单质 |
C.由实验②可得出氧化性: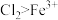 |
D.实验②中白色浑浊是 |
您最近一年使用:0次
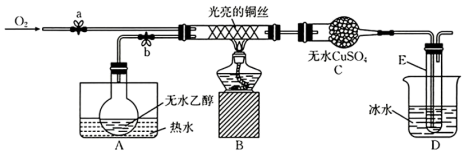
7 . 某同学设计了如图所示装置(夹持装置已省略)进行乙醇的催化氧化实验。先按图示安装好实验装置,关闭活塞a、b,在铜丝的中间部分加热片刻,然后通过控制活塞a和b,有节奏(间歇性)地通入气体。已知:乙醛可被氧化为乙酸,乙醛的沸点为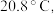 乙酸的沸点为
乙酸的沸点为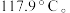
(1)实验室常用 快速制备氧气,写出
快速制备氧气,写出 的结构式:
的结构式:___________ 。
(2)从硬质玻璃管中可观察到受热的铜丝交替出现变黑、变红的现象,请写出实验过程中乙醇催化氧化的化学方程式:___________ 。实验开始后,实验小组将酒精灯去掉之后,依然能观察到铜丝交替出现变黑、变红的现象,试解释其原因:___________ 。
(3)实验中A和D均用到了水浴作用。A的作用是_____ ,D的作用是_____ 。
(4)C中的实验现象是___________ 。
(5)经检测,实验小组发现E中收集到的液体除含有乙醛(易溶于水)外还含有杂质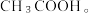 要除去乙醛中的
要除去乙醛中的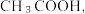 ,可采取的方法为
,可采取的方法为___________ 。
(6)该小组通过以上实验探究做出了如下猜想,你认为正确的是___________ (填标号)。
a.表面被氧化为黑色的铜丝在酒精灯焰心处灼烧,可闻到刺激性气味
b.乙醇催化氧化生成乙醛时,乙醇分子中只有O—H键发生断裂
c.利用金属钠能检验试管E中有没有未反应的乙醇
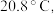 乙酸的沸点为
乙酸的沸点为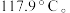
(1)实验室常用
 快速制备氧气,写出
快速制备氧气,写出 的结构式:
的结构式:(2)从硬质玻璃管中可观察到受热的铜丝交替出现变黑、变红的现象,请写出实验过程中乙醇催化氧化的化学方程式:
(3)实验中A和D均用到了水浴作用。A的作用是
(4)C中的实验现象是
(5)经检测,实验小组发现E中收集到的液体除含有乙醛(易溶于水)外还含有杂质
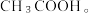 要除去乙醛中的
要除去乙醛中的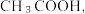 ,可采取的方法为
,可采取的方法为(6)该小组通过以上实验探究做出了如下猜想,你认为正确的是
a.表面被氧化为黑色的铜丝在酒精灯焰心处灼烧,可闻到刺激性气味
b.乙醇催化氧化生成乙醛时,乙醇分子中只有O—H键发生断裂
c.利用金属钠能检验试管E中有没有未反应的乙醇
您最近一年使用:0次
2024-08-21更新
|
76次组卷
|
2卷引用:河南省新乡市2023-2024学年高一下学期7月期末考试化学试题
解题方法
8 . 氯元素是生产生活中常见的非金属元素。某同学探究 及其化合物的性质。
及其化合物的性质。
(1)实验Ⅰ中把 通入水中,反应的化学方程式是
通入水中,反应的化学方程式是____ ,新制氯水经光照后,颜色逐渐消失,并放出的气体是_____ (填化学式),溶液的酸性_____ (填“增强”、“不变”或“减小”)。
(2)实验Ⅱ观察到的现象是_______ ,对应该现象的离子反应方程式为_______ 。
(3)①实验Ⅲ的现象说明,新制氯水具有的性质是_______ 。
②实验Ⅳ:a.现象的白色沉淀是_______ (填化学式)。
b.综合ⅰ、ⅱ现象,该同学推测实验Ⅳ发生的反应为:_______ 。
 (将反应补充完整)
(将反应补充完整)
③为探究实验Ⅲ中试纸褪色的原因及Ⅳ中另一种反应产物,该同学设计实验如下
c.将少量稀硝酸滴在蓝色石蕊试纸上,试纸变红未褪色;
d.……
上述实验d的方案是_______ 。
(4)该同学查阅资料得知,最初,人们直接用氯气作漂白剂,但使用起来不方便,效果也不理想,你认为使用起来不方便,效果也不理想的原因是____ 。经过多年的实验、改进,才有了今天常用的漂白粉。科研人员以氯气和石灰乳为原料制取漂白粉,有关反应的化学方程式是:____ 。
 及其化合物的性质。
及其化合物的性质。| 实验 | 操作 | 现象 |
| Ⅰ | 把 通入水中 通入水中 | 溶液呈浅黄绿色 |
| Ⅱ | 向新制氯水中滴加 溶液 溶液 | |
| Ⅲ | 把新制氯水滴在蓝色石蕊试纸上 | 试纸先变红后褪色 |
| Ⅳ | 向新制氯水中滴加足量 溶液,不断振荡 溶液,不断振荡 | ⅰ.有白色沉淀生成 ⅱ.溶液变为无色 |
 通入水中,反应的化学方程式是
通入水中,反应的化学方程式是(2)实验Ⅱ观察到的现象是
(3)①实验Ⅲ的现象说明,新制氯水具有的性质是
②实验Ⅳ:a.现象的白色沉淀是
b.综合ⅰ、ⅱ现象,该同学推测实验Ⅳ发生的反应为:
 (将反应补充完整)
(将反应补充完整)③为探究实验Ⅲ中试纸褪色的原因及Ⅳ中另一种反应产物,该同学设计实验如下
c.将少量稀硝酸滴在蓝色石蕊试纸上,试纸变红未褪色;
d.……
上述实验d的方案是
(4)该同学查阅资料得知,最初,人们直接用氯气作漂白剂,但使用起来不方便,效果也不理想,你认为使用起来不方便,效果也不理想的原因是
您最近一年使用:0次
9 . 某小组欲探究反应2Fe2+ + I2 2Fe3+ + 2I−,完成如下实验。资料:AgI是黄色固体,难溶于稀硝酸。新制的AgI见光会少量分解。
2Fe3+ + 2I−,完成如下实验。资料:AgI是黄色固体,难溶于稀硝酸。新制的AgI见光会少量分解。_______ 。经检验,Ⅰ、Ⅱ中均未检验出Fe3+。
(2)Ⅲ中的黄色浑浊是_______ (写化学式)。
(3)经检验,Ⅱ→Ⅲ的过程中产生了Fe3+。
① 对Fe3+产生的原因做出如下假设:
假设a:空气中存在O2,由于_______ (用离子方程式表示),可产生Fe3+。
假设b:溶液中Ag+具有氧化性,可产生Fe3+。
假设c:_______ 。
假设d:该条件下,I2溶液可将Fe2+氧化为Fe3+。
② 通过实验进一步证实a、b、c不是产生Fe3+的主要原因,假设d成立。
(4)经检验,Ⅳ中灰黑色浑浊中含有AgI和Ag。
① 验证灰黑色浑浊含有Ag的实验操作及现象是:取洗净后的灰黑色固体,_______ 。
② 为探究Ⅲ→Ⅳ出现灰黑色浑浊的原因,完成了实验1和实验2。
实验1:向1 mL 0.1 mol·L−1 FeSO4溶液中加入1 mL0.1 mol·L−1 AgNO3溶液,开始时,溶液无明显变化。几分钟后,出现大量灰黑色浑浊。反应过程中温度几乎无变化。测定溶液中Ag+浓度随反应时间的变化如下图。
ⅰ.实验1中发生反应的离子方程式是_______ 。
ⅱ.Ⅳ中迅速 出现灰黑色浑浊的可能的原因是_______ 。
 2Fe3+ + 2I−,完成如下实验。资料:AgI是黄色固体,难溶于稀硝酸。新制的AgI见光会少量分解。
2Fe3+ + 2I−,完成如下实验。资料:AgI是黄色固体,难溶于稀硝酸。新制的AgI见光会少量分解。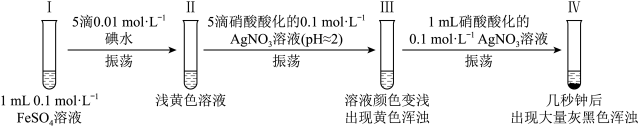
(2)Ⅲ中的黄色浑浊是
(3)经检验,Ⅱ→Ⅲ的过程中产生了Fe3+。
① 对Fe3+产生的原因做出如下假设:
假设a:空气中存在O2,由于
假设b:溶液中Ag+具有氧化性,可产生Fe3+。
假设c:
假设d:该条件下,I2溶液可将Fe2+氧化为Fe3+。
② 通过实验进一步证实a、b、c不是产生Fe3+的主要原因,假设d成立。
(4)经检验,Ⅳ中灰黑色浑浊中含有AgI和Ag。
① 验证灰黑色浑浊含有Ag的实验操作及现象是:取洗净后的灰黑色固体,
② 为探究Ⅲ→Ⅳ出现灰黑色浑浊的原因,完成了实验1和实验2。
实验1:向1 mL 0.1 mol·L−1 FeSO4溶液中加入1 mL0.1 mol·L−1 AgNO3溶液,开始时,溶液无明显变化。几分钟后,出现大量灰黑色浑浊。反应过程中温度几乎无变化。测定溶液中Ag+浓度随反应时间的变化如下图。
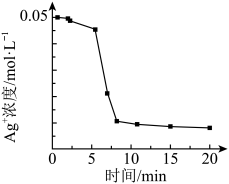
ⅰ.实验1中发生反应的离子方程式是
ⅱ.Ⅳ中
您最近一年使用:0次
2024-08-12更新
|
140次组卷
|
3卷引用:河南省洛阳市洛龙区洛阳市第一高级中学2024-2025学年高二上学期开学化学试题
解题方法
10 . 氮和氮的化合物在国防、工农业生产和生活中都有极其广泛的用途。
(1) 为爆炸物,在不同温度下加热分解,可能发生非氧化还原反应,也可能发生氧化还原反应,下列反应一定不可能发生的是_______(填字母)。
为爆炸物,在不同温度下加热分解,可能发生非氧化还原反应,也可能发生氧化还原反应,下列反应一定不可能发生的是_______(填字母)。
(2)化工厂可用浓氨水来检验Cl2,是否泄漏,有关反应的化学方程式为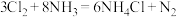 ,该反应中氧化剂为
,该反应中氧化剂为_______ (填化学式),还原剂为_______ (填化学式),标准状况下,每生成2.24LN2,反应中转移电子的物质的量为_______ mol。
(3)工业上在一定温度和催化剂条件下用NH3将 还原生成N2.在实验室利用如图装置探究NO2能否被NH3还原。
还原生成N2.在实验室利用如图装置探究NO2能否被NH3还原。_______ 。
②E装置中发生反应的离子方程式是_______ 。
③若NO2能够被NH3还原,预期观察到C装置中的现象是____ ,发生的化学方程式为____ 。
(4)将 12.8 g Cu投入50 mL某浓度的浓硝酸中,随着Cu的不断减少,反应生成气体的颜色逐渐变浅(假设硝酸对应的还原产物只有 NO2和 NO),当 Cu 全部溶解时,硝酸恰好完全消耗,共收集到气体 3.36 L(标准状况),参加反应的硝酸的物质的量为____ ,相同条件下,NO 和 NO2的体积比_______ 。
(1)
 为爆炸物,在不同温度下加热分解,可能发生非氧化还原反应,也可能发生氧化还原反应,下列反应一定不可能发生的是_______(填字母)。
为爆炸物,在不同温度下加热分解,可能发生非氧化还原反应,也可能发生氧化还原反应,下列反应一定不可能发生的是_______(填字母)。A.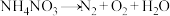 | B.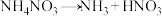 |
C.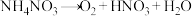 | D.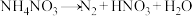 |
(2)化工厂可用浓氨水来检验Cl2,是否泄漏,有关反应的化学方程式为
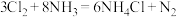 ,该反应中氧化剂为
,该反应中氧化剂为(3)工业上在一定温度和催化剂条件下用NH3将
 还原生成N2.在实验室利用如图装置探究NO2能否被NH3还原。
还原生成N2.在实验室利用如图装置探究NO2能否被NH3还原。
②E装置中发生反应的离子方程式是
③若NO2能够被NH3还原,预期观察到C装置中的现象是
(4)将 12.8 g Cu投入50 mL某浓度的浓硝酸中,随着Cu的不断减少,反应生成气体的颜色逐渐变浅(假设硝酸对应的还原产物只有 NO2和 NO),当 Cu 全部溶解时,硝酸恰好完全消耗,共收集到气体 3.36 L(标准状况),参加反应的硝酸的物质的量为
您最近一年使用:0次



