名校
解题方法
1 . 某小组欲研究烷烃的某些性质设计下图实验装置。回答下列问题:
向如图的B中通入一定量的氯气和甲烷气体,混合均匀后通入C中硬质玻璃管中,夹紧两个弹簧夹,用光照射硬质玻璃管。
(1)B装置有三种功能:①均匀混合气体;②干燥混合气体;③___________ 。
(2)写出装置C中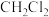 与
与 反应生成氯仿的化学方程式
反应生成氯仿的化学方程式___________ 。
(3)一段时间后,C中玻璃管内的实验现象:___________ 、___________ 。
(4)若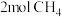 与
与 发生取代反应,测得生成4种有机取代产物的物质的量相等,则产物中最多的物质的物质的量是
发生取代反应,测得生成4种有机取代产物的物质的量相等,则产物中最多的物质的物质的量是___________ mol。
Ⅱ.某烃可以发生氧化反应
将 的某烃在足量氧气中充分燃烧,并使产生的气体全部通入下图装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收)。
的某烃在足量氧气中充分燃烧,并使产生的气体全部通入下图装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收)。
(5)试写出该烃结构简式___________ 。
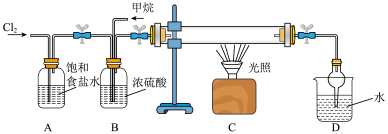
向如图的B中通入一定量的氯气和甲烷气体,混合均匀后通入C中硬质玻璃管中,夹紧两个弹簧夹,用光照射硬质玻璃管。
(1)B装置有三种功能:①均匀混合气体;②干燥混合气体;③
(2)写出装置C中
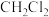 与
与 反应生成氯仿的化学方程式
反应生成氯仿的化学方程式(3)一段时间后,C中玻璃管内的实验现象:
(4)若
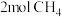 与
与 发生取代反应,测得生成4种有机取代产物的物质的量相等,则产物中最多的物质的物质的量是
发生取代反应,测得生成4种有机取代产物的物质的量相等,则产物中最多的物质的物质的量是Ⅱ.某烃可以发生氧化反应
将
 的某烃在足量氧气中充分燃烧,并使产生的气体全部通入下图装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收)。
的某烃在足量氧气中充分燃烧,并使产生的气体全部通入下图装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收)。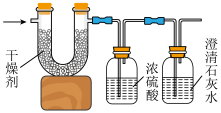
| 实验前 | 实验后 | |
| 实验前实验后(干燥剂+U形管)的质量 | 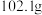 | 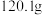 |
| (石灰水+广口瓶)的质量 |  | 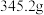 |
(5)试写出该烃结构简式
您最近半年使用:0次
名校
解题方法
2 . 某同学进行如下实验:
①将H2O2溶液与KI溶液混合,产生大量气泡,溶液颜色变黄;
②将①中的黄色溶液分成两等份,一份加入CCl4,振荡,产生气泡速率明显减小,下层溶液呈紫红色;另一份不加CCl4,振荡,产生气泡速率无明显变化。
下列说法不正确 的是
①将H2O2溶液与KI溶液混合,产生大量气泡,溶液颜色变黄;
②将①中的黄色溶液分成两等份,一份加入CCl4,振荡,产生气泡速率明显减小,下层溶液呈紫红色;另一份不加CCl4,振荡,产生气泡速率无明显变化。
下列说法
| A.①中溶液颜色变黄的原因是:H2O2+2I-=I2+2OH- |
| B.②中下层溶液呈紫红色是因为I2溶于CCl4 |
| C.②中产生气泡速率减小的原因是H2O2浓度减小 |
| D.由该实验可知,I2可以加快H2O2分解产生气泡反应速率 |
您最近半年使用:0次
7日内更新
|
181次组卷
|
2卷引用:2024届江西省吉安市第一中学高三下学期一模化学试题
3 . 实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置(加热、夹持装置已略去)如图所示:
回答下列问题:
(1)装置D中发生的主要反应的化学方程式为__________ 。
(2)装置B中长玻璃管E的作用是__________ 。
(3)在装置C中应加入氢氧化钠溶液 ,其目的是吸收反应可能生成_____________ 的气体。
(4)反应过程中应用冷水冷却装置D,其主要目的是______________ ;但又不能过度冷却(如用冰水),其原因是__________ ;将1,2-二溴乙烷粗产品置于分液漏斗中,加水,振荡后静置,产物应在_______ 层(填“上”或“下”)。
(5)若产物中有少量副产物乙醚,最好用_________ 方法除去。
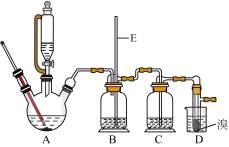
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 常温下状态 | 无色液体 | 无色液体 | 无色液体 |
密度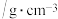 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)装置D中发生的主要反应的化学方程式为
(2)装置B中长玻璃管E的作用是
(3)在装置C中应加入氢氧化钠溶液 ,其目的是吸收反应可能生成
(4)反应过程中应用冷水冷却装置D,其主要目的是
(5)若产物中有少量副产物乙醚,最好用
您最近半年使用:0次
名校
4 . 某化学兴趣小组用下图装置(部分夹持装置已略去)制取氨气并探究其性质。

(1)实验室用装置A制备氨气的化学方程式为_______ 。
(2)装置B中的干燥剂可以选用_______ 。
(3)气体通过C、D装置时,试纸颜色会发生变化的是_______ (填字母)。
(4)当E装置中集满NH3时,挤压胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是_____ 。
(5)用下图装置探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。

①实验中观察到a中黑色粉末变红,b中无水硫酸铜变蓝,并收集到一种单质气体。则a中发生反应的化学方程式为_______ 。
②若向a中通入标准状况下3.36L的氨气,理论上会得到铜的质量为______ g。
(6)已知加热条件下,氨气可以与铝发生置换反应生成AlN;AlN加热时可溶于浓碱溶液并产生氨气,发生反应: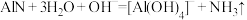 。称取AlN样品23.2g(假设杂质只含Al),将其放入足量浓碱溶液中加热,若所产生的气体全部逸出并收集,测得其体积为14.56L(标准状况),则样品中AlN的质量分数为
。称取AlN样品23.2g(假设杂质只含Al),将其放入足量浓碱溶液中加热,若所产生的气体全部逸出并收集,测得其体积为14.56L(标准状况),则样品中AlN的质量分数为______ %(精确到0.1%)。

(1)实验室用装置A制备氨气的化学方程式为
(2)装置B中的干燥剂可以选用
(3)气体通过C、D装置时,试纸颜色会发生变化的是
(4)当E装置中集满NH3时,挤压胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是
(5)用下图装置探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。

①实验中观察到a中黑色粉末变红,b中无水硫酸铜变蓝,并收集到一种单质气体。则a中发生反应的化学方程式为
②若向a中通入标准状况下3.36L的氨气,理论上会得到铜的质量为
(6)已知加热条件下,氨气可以与铝发生置换反应生成AlN;AlN加热时可溶于浓碱溶液并产生氨气,发生反应:
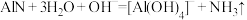 。称取AlN样品23.2g(假设杂质只含Al),将其放入足量浓碱溶液中加热,若所产生的气体全部逸出并收集,测得其体积为14.56L(标准状况),则样品中AlN的质量分数为
。称取AlN样品23.2g(假设杂质只含Al),将其放入足量浓碱溶液中加热,若所产生的气体全部逸出并收集,测得其体积为14.56L(标准状况),则样品中AlN的质量分数为
您最近半年使用:0次
5 . 某研究性学习小组学生根据氧化还原反应规律,探究 、
、 与
与 反应的情况,提出假设并进行相关实验。
反应的情况,提出假设并进行相关实验。
Ⅰ.从理论上分析 和
和 都既有氧化性又有还原性,于是提出如下假设:
都既有氧化性又有还原性,于是提出如下假设:
假设1: 氧化
氧化 ;
;
假设2: 氧化
氧化 。
。
(1)甲同学设计如图装置进行实验:___________ 。
②待试管B中充满红棕色气体,关闭旋塞a和b;取下试管B,向其中加入适量 粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。
粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。
结论:甲同学认为假设2正确。
(2)乙同学认为甲同学设计的实验存在缺陷,为达到实验目的,在A、B之间应增加一个装置,该装置的作用是___________ 。乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;带火星的木条未复燃,得出结论:假设Ⅰ正确。则 和
和 反应的化学方程式是
反应的化学方程式是___________ 。
Ⅱ.该研究性学习小组同学还认为易与 发生反应,应该更易被氧化。查阅资料:
发生反应,应该更易被氧化。查阅资料: ;
;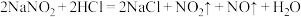 ;酸性条件下,能与
;酸性条件下,能与 反应生成
反应生成 和
和 。
。
(3)丙同学用下图所示装置(部分夹持装置略)探究 与
与 的反应。
的反应。 ,目的是
,目的是___________ 。
②B中观察到的主要现象的是___________ (填字母编号)。
a.铜片逐渐溶解,溶液变为蓝色
b.有红棕色气泡产生
c.有无色气泡产生
③C、E中所盛装的试剂不能是___________ (填字母编号)。
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
④充分反应后,检验D装置中产物的方法是:取D装置中产物少许,___________ ,则产物是 。
。
 、
、 与
与 反应的情况,提出假设并进行相关实验。
反应的情况,提出假设并进行相关实验。Ⅰ.从理论上分析
 和
和 都既有氧化性又有还原性,于是提出如下假设:
都既有氧化性又有还原性,于是提出如下假设:假设1:
 氧化
氧化 ;
;假设2:
 氧化
氧化 。
。(1)甲同学设计如图装置进行实验:

②待试管B中充满红棕色气体,关闭旋塞a和b;取下试管B,向其中加入适量
 粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。
粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。结论:甲同学认为假设2正确。
(2)乙同学认为甲同学设计的实验存在缺陷,为达到实验目的,在A、B之间应增加一个装置,该装置的作用是
 和
和 反应的化学方程式是
反应的化学方程式是Ⅱ.该研究性学习小组同学还认为易与
 发生反应,应该更易被氧化。查阅资料:
发生反应,应该更易被氧化。查阅资料: ;
;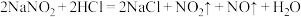 ;酸性条件下,能与
;酸性条件下,能与 反应生成
反应生成 和
和 。
。(3)丙同学用下图所示装置(部分夹持装置略)探究
 与
与 的反应。
的反应。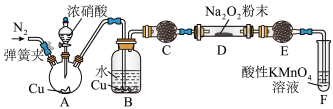
 ,目的是
,目的是②B中观察到的主要现象的是
a.铜片逐渐溶解,溶液变为蓝色
b.有红棕色气泡产生
c.有无色气泡产生
③C、E中所盛装的试剂不能是
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
④充分反应后,检验D装置中产物的方法是:取D装置中产物少许,
 。
。
您最近半年使用:0次
2024-04-08更新
|
553次组卷
|
5卷引用:江西省宜春市宜丰中学2023-2024学年高三下学期3月月考化学试题
名校
6 . 实验室可用图中装置(略去部分夹持仪器)制取 并验证其性质。
并验证其性质。
(1)装置A中发生反应的化学方程式为___________ 。
(2)装置B的作用之一是通过观察产生气泡的多少判断 生成的快慢,其中的液体最好选择
生成的快慢,其中的液体最好选择___________ (填序号)。
a.蒸馏水 b.饱和 溶液 c.饱和
溶液 c.饱和 溶液 d.饱和
溶液 d.饱和 溶液
溶液
(3)C试管中的试剂可以验证二氧化硫的氧化性,现象为___________ 。E装置的作用为___________ 。
(4)为验证二氧化硫的还原性,充分反应后,取试管D中的溶液分成三份,分别进行实验:
方案I:向第一份溶液中加入 溶液,有白色沉淀生成;
溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加入 溶液,有白色沉淀生成;
溶液,有白色沉淀生成;
方案Ⅲ:向第三份溶液中加入 溶液,有产生白色沉淀。
溶液,有产生白色沉淀。
上述方案中合理的是方案___________ (填“I”“Ⅱ”或“Ⅲ”)。
(5)工业上常用SO2做海水提溴过程中的吸收剂,海水提溴工艺流程示意图如下。
浓缩海水 含溴海水
含溴海水 HBr溶液
HBr溶液 高浓度溴水
高浓度溴水 Br2
Br2
其中SO2和H2O吸收热空气吹出的溴(g)时发生的主要化学方程式为___________ 。
 并验证其性质。
并验证其性质。
(1)装置A中发生反应的化学方程式为
(2)装置B的作用之一是通过观察产生气泡的多少判断
 生成的快慢,其中的液体最好选择
生成的快慢,其中的液体最好选择a.蒸馏水 b.饱和
 溶液 c.饱和
溶液 c.饱和 溶液 d.饱和
溶液 d.饱和 溶液
溶液(3)C试管中的试剂可以验证二氧化硫的氧化性,现象为
(4)为验证二氧化硫的还原性,充分反应后,取试管D中的溶液分成三份,分别进行实验:
方案I:向第一份溶液中加入
 溶液,有白色沉淀生成;
溶液,有白色沉淀生成;方案Ⅱ:向第二份溶液中加入
 溶液,有白色沉淀生成;
溶液,有白色沉淀生成;方案Ⅲ:向第三份溶液中加入
 溶液,有产生白色沉淀。
溶液,有产生白色沉淀。上述方案中合理的是方案
(5)工业上常用SO2做海水提溴过程中的吸收剂,海水提溴工艺流程示意图如下。
浓缩海水
 含溴海水
含溴海水 HBr溶液
HBr溶液 高浓度溴水
高浓度溴水 Br2
Br2其中SO2和H2O吸收热空气吹出的溴(g)时发生的主要化学方程式为
您最近半年使用:0次
名校
解题方法
7 . 将铜丝插入浓硝酸中进行如图所示的实验,下列说法正确的是
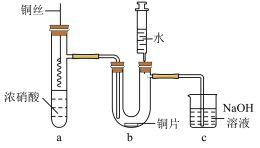

| A.装置a中出现红棕色气体,只体现HNO3的酸性 |
| B.装置c用NaOH吸收尾气,说明NO和NO2均是酸性氧化物 |
| C.注入水后装置b中铜片表面产生气泡,说明Cu与硝酸生成H2 |
| D.一段时间后抽出铜丝,向装置b中U形管内注入水,液体在U形管内在逐渐变成蓝色 |
您最近半年使用:0次
8 . 铁氰化钾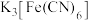 是一种络合物,易溶于水,水溶液带有黄绿色,常用于检验
是一种络合物,易溶于水,水溶液带有黄绿色,常用于检验 。某小组拟设计实验制备铁氰化钾并探究其性质。
。某小组拟设计实验制备铁氰化钾并探究其性质。
实验(一)制备铁氰化钾。以亚铁氰化钾为原料采用氧化法制备铁氰化钾,装置如图所示。
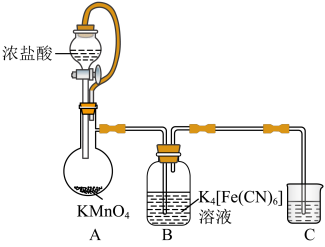
(1)装置A中橡胶管的作用是___________ 。装置C中试剂可能是___________ 。
(2)装置B中化学方程式为___________ 。
(3)从装置B中分离产品,可采用___________ 、降温结晶、___________ 、洗涤、干燥一系列操作。
实验(二)探究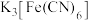 性质。
性质。
【资料显示】
配合物在水中能完全电离出外界和内界,例如: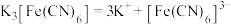 。
。
【提出问题】
 能否电离?
能否电离?
【提出猜想】
猜想1:不能电离;猜想2:能部分电离(存在电离平衡);猜想3:___________。
【设计实验】
(4)猜想3的横线上应填___________ ,综合上述实验分析,可知:猜想___________ 成立。
(5)用方程式和必要的文字分析实验②现象:___________ ,写出产生蓝色沉淀的离子方程式:___________ 。
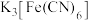 是一种络合物,易溶于水,水溶液带有黄绿色,常用于检验
是一种络合物,易溶于水,水溶液带有黄绿色,常用于检验 。某小组拟设计实验制备铁氰化钾并探究其性质。
。某小组拟设计实验制备铁氰化钾并探究其性质。实验(一)制备铁氰化钾。以亚铁氰化钾为原料采用氧化法制备铁氰化钾,装置如图所示。

(1)装置A中橡胶管的作用是
(2)装置B中化学方程式为
(3)从装置B中分离产品,可采用
实验(二)探究
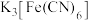 性质。
性质。【资料显示】
配合物在水中能完全电离出外界和内界,例如:
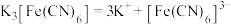 。
。【提出问题】
 能否电离?
能否电离?【提出猜想】
猜想1:不能电离;猜想2:能部分电离(存在电离平衡);猜想3:___________。
【设计实验】
| 实验 | 实验操作及现象 |
| ① | 向浓度均为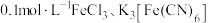 的混合溶液中插入一根无锈铁丝,立即产生蓝色沉淀 的混合溶液中插入一根无锈铁丝,立即产生蓝色沉淀 |
| ② | 向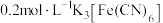 溶液插入一根无锈铁丝(与①相同),一段时间后,溶液产生蓝色 溶液插入一根无锈铁丝(与①相同),一段时间后,溶液产生蓝色 |
(4)猜想3的横线上应填
(5)用方程式和必要的文字分析实验②现象:
您最近半年使用:0次
名校
解题方法
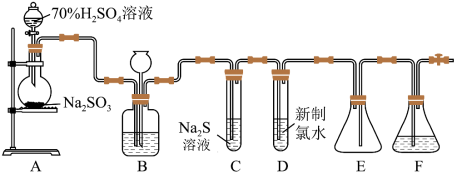
9 . 按如图装置进行实验,将70%浓硫酸全部加入Y形试管Na2SO3中,关闭活塞。B、C处分别为蘸取相应溶液的试纸,下列说法错误的是
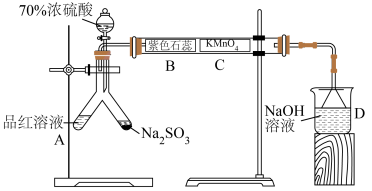

| A.A处品红溶液褪色后,加热可恢复红色 |
| B.B处试纸紫色褪去 |
| C.C处现象可验证SO2被氧化 |
| D.若将D中NaOH溶液换为Na2S溶液,则D中会有淡黄色沉淀生成 |
您最近半年使用:0次
10 . 实验室制备SO2并探究SO2的性质,利用如图装置进行实验。

回答下列问题:
(1)盛装浓硫酸的仪器名称为________ ,装置A中的化学方程式为________ 。
(2)若试剂a为蒸馏水,则装置B中反应的化学方程式为________ 。
(3)若试剂a为BaCl2溶液,则B中________ (填“能”或“不能”)观察到有白色沉淀生成,请说明原因: _______ 。
(4)若试剂a为AgNO3溶液,装置B中观察到白色沉淀。分析装置B中沉淀的成分,提出白色沉淀中可能含有Ag2SO3或Ag2SO4或二者混合物。
①请设计实验检验白色沉淀中是否含有Ag2SO3:________ ;
②推测含Ag2SO4的原因是_______ 。

回答下列问题:
(1)盛装浓硫酸的仪器名称为
(2)若试剂a为蒸馏水,则装置B中反应的化学方程式为
(3)若试剂a为BaCl2溶液,则B中
(4)若试剂a为AgNO3溶液,装置B中观察到白色沉淀。分析装置B中沉淀的成分,提出白色沉淀中可能含有Ag2SO3或Ag2SO4或二者混合物。
①请设计实验检验白色沉淀中是否含有Ag2SO3:
②推测含Ag2SO4的原因是
您最近半年使用:0次



