名校
1 . 某化学兴趣小组查阅资料后制备过氧化钠,并设计实验验证其相关性质。
(1)某小组查阅资料发现, 用途广泛,写出
用途广泛,写出 的一种用途;
的一种用途;___________ ; 能与盐酸发生剧烈反应,写出该反应的化学方程式:
能与盐酸发生剧烈反应,写出该反应的化学方程式:___________ 。
(2)某小组同学取一定量淡黄色固体粉末溶于冷水中,待固体粉末全部反应后,仍可缓慢释放出气体。为探究该固体粉末溶解后的溶液成分,设计如下实验:

①如何证明乙中产生的气体是什么物质?___________ 。
②乙→丙过程说明固体粉末溶解后溶液中含有___________ (填化学式), 在丙中的作用是
在丙中的作用是___________ 。
(3)为验证 与
与 能否反应,该小组同学设计如下实验:
能否反应,该小组同学设计如下实验:
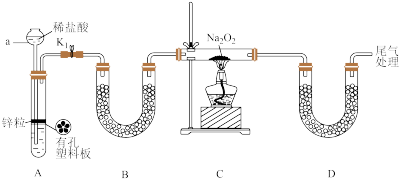
①仪器a的名称是___________ ;装置B的作用是___________ 。
②若 与
与 能反应产生
能反应产生 ,该实验装置C、D之间还缺少检验反应产物
,该实验装置C、D之间还缺少检验反应产物 的装置,缺少的仪器和药品是
的装置,缺少的仪器和药品是___________ 。
(1)某小组查阅资料发现,
 用途广泛,写出
用途广泛,写出 的一种用途;
的一种用途; 能与盐酸发生剧烈反应,写出该反应的化学方程式:
能与盐酸发生剧烈反应,写出该反应的化学方程式:(2)某小组同学取一定量淡黄色固体粉末溶于冷水中,待固体粉末全部反应后,仍可缓慢释放出气体。为探究该固体粉末溶解后的溶液成分,设计如下实验:

①如何证明乙中产生的气体是什么物质?
②乙→丙过程说明固体粉末溶解后溶液中含有
 在丙中的作用是
在丙中的作用是(3)为验证
 与
与 能否反应,该小组同学设计如下实验:
能否反应,该小组同学设计如下实验:
①仪器a的名称是
②若
 与
与 能反应产生
能反应产生 ,该实验装置C、D之间还缺少检验反应产物
,该实验装置C、D之间还缺少检验反应产物 的装置,缺少的仪器和药品是
的装置,缺少的仪器和药品是
您最近一年使用:0次
名校
解题方法
2 . 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
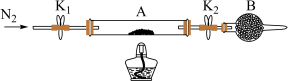
(1)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按如图连接好装置进行实验。______ 。
②将下列实验操作步骤正确排序______ (填标号);重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热 b.熄灭酒精灯
c.关闭K1和K2 d.打开K1和K2,缓缓通入N2
e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=______ (列式表示)。
(2)为探究硫酸亚铁的分解产物,将(1)中已恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后生成两种硫的化合物,反应管中残留固体为红色粉末。_____ 、_____ (填标号)。C、D中有气泡冒出,并可观察到的现象分别为_____ ,_____ 。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_____ 。
(1)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按如图连接好装置进行实验。
②将下列实验操作步骤正确排序
a.点燃酒精灯,加热 b.熄灭酒精灯
c.关闭K1和K2 d.打开K1和K2,缓缓通入N2
e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=
(2)为探究硫酸亚铁的分解产物,将(1)中已恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后生成两种硫的化合物,反应管中残留固体为红色粉末。

a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式
您最近一年使用:0次
2023-04-10更新
|
391次组卷
|
3卷引用:江西省乐安县第二中学2022-2023学年高一下学期5月期中考试化学试题
名校
解题方法
3 . 部分含氮物质的“价—类”二维图如下:
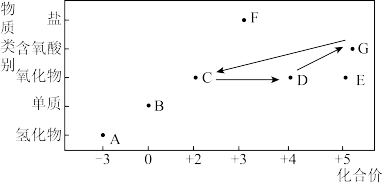
根据图示信息,回答下列问题:
(1)E的化学式为_______ 。写出B的用途:_______ (列举一种)。
(2)在常温条件下实现 的循环转化,其中有颜色变化且属于化合反应的化学方程式为
的循环转化,其中有颜色变化且属于化合反应的化学方程式为_______ 。
(3)实验室可选择甲、乙装置制备A,利用收集的A用丙装置探究A的性质。
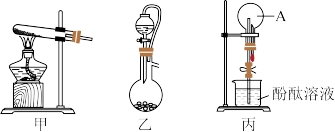
①若选择乙制备A,则反应物是_______ (填名称)。
②若选择甲装置制备A,则化学方程式为_______ 。
③若顺利完成丙装置实验,可观察到_______ 色喷泉。
(4)若F是一种钠盐,取少量F溶于蒸馏水,将溶液分成两份,进行实验,测得结果如下:
已知 水溶液呈无色,由此推断,F具有_______(填字母)。
水溶液呈无色,由此推断,F具有_______(填字母)。

根据图示信息,回答下列问题:
(1)E的化学式为
(2)在常温条件下实现
 的循环转化,其中有颜色变化且属于化合反应的化学方程式为
的循环转化,其中有颜色变化且属于化合反应的化学方程式为(3)实验室可选择甲、乙装置制备A,利用收集的A用丙装置探究A的性质。

①若选择乙制备A,则反应物是
②若选择甲装置制备A,则化学方程式为
③若顺利完成丙装置实验,可观察到
(4)若F是一种钠盐,取少量F溶于蒸馏水,将溶液分成两份,进行实验,测得结果如下:
| 实验 | 操作 | 现象 |
| Ⅰ | 向一份溶液中滴加稀硫酸酸化的 溶液,再滴加淀粉溶液,振荡 溶液,再滴加淀粉溶液,振荡 | 溶液由无色变为蓝色 |
| Ⅱ | 向另一份溶液中滴加少量的稀硫酸酸化的 溶液,振荡 溶液,振荡 | 溶液由紫红色变为无色 |
 水溶液呈无色,由此推断,F具有_______(填字母)。
水溶液呈无色,由此推断,F具有_______(填字母)。| A.氧化性 | B.还原性 | C.既有氧化性,又有还原性 | D.既无氧化性,又无还原性 |
您最近一年使用:0次
名校
4 . 氨气是重要的化工原料,在工农业生产中有重要用途。
(1)工业上合成氨的反应原理为_______ 。
(2)氨气极易溶于水,这个性质可以利用如图装置进喷泉实验。
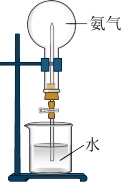
①完成喷泉实验的具体操作为_______ 。
②若该条件为标准状况,且水充满整个圆底烧瓶,则最终所得溶液的物质的量浓度为_______ 。
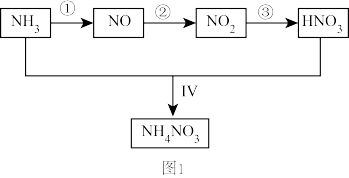
某小组的同学欲探究NH3经一系列反应得到HNO3和NH4NO3的过程。NH3的转化过程如图1所示。
甲、乙两同学分别按图2所示装置进行实验。用于A、B装置中的可选药品:浓氨水、30% H2O2溶液、蒸馏水、NaOH固体、MnO2。
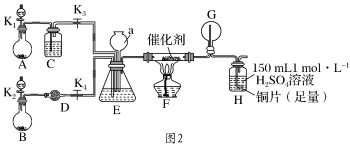
(3)装置A的圆底烧瓶中发生反应的化学方程式为_______ 。装置E有多种作用,下列关于装置E的作用或其中所盛液体的说法中,不正确的是_______ (填字母)。
a.使氨气和氧气充分混合
b.控制通入氨气和氧气的体积比
c.平衡装置内的压强
d.锥形瓶内液体是饱和食盐水
(4)甲同学先点燃酒精灯,再打开K1、K2、K3、K4,反应一段时间后,成功模拟了反应过程,并将实验中产生的气体持续通入装置H一段时间后,装置H中的溶液变成蓝色,则其中铜片所参与反应的离子方程式为_______ ,若制得的氨气仅按①→②→③的顺序完全转化为硝酸,欲使装置H中所得溶液为纯净的CuSO4溶液,理论上所需氨气在标准状况下的体积为_______ L(假设硝酸与铜反应产生的还原产物全部排出反应装置)。
(5)乙同学为模拟过程Ⅳ的反应,在甲同学操作的基础上对该装置进行了下列各项中的一项操作,使G处圆底烧瓶中产生大量白烟,你认为这项操作是_______ (填字母)。
a.关闭K3并熄灭酒精灯
b.关闭K4并熄灭酒精灯
c.关闭K3、K4并熄灭酒精灯
(6)丙同学认为该系列实验装置存在一处明显的设计缺陷,你认为该设计缺陷_______ 。
(1)工业上合成氨的反应原理为
(2)氨气极易溶于水,这个性质可以利用如图装置进喷泉实验。

①完成喷泉实验的具体操作为
②若该条件为标准状况,且水充满整个圆底烧瓶,则最终所得溶液的物质的量浓度为
某小组的同学欲探究NH3经一系列反应得到HNO3和NH4NO3的过程。NH3的转化过程如图1所示。

甲、乙两同学分别按图2所示装置进行实验。用于A、B装置中的可选药品:浓氨水、30% H2O2溶液、蒸馏水、NaOH固体、MnO2。

(3)装置A的圆底烧瓶中发生反应的化学方程式为
a.使氨气和氧气充分混合
b.控制通入氨气和氧气的体积比
c.平衡装置内的压强
d.锥形瓶内液体是饱和食盐水
(4)甲同学先点燃酒精灯,再打开K1、K2、K3、K4,反应一段时间后,成功模拟了反应过程,并将实验中产生的气体持续通入装置H一段时间后,装置H中的溶液变成蓝色,则其中铜片所参与反应的离子方程式为
(5)乙同学为模拟过程Ⅳ的反应,在甲同学操作的基础上对该装置进行了下列各项中的一项操作,使G处圆底烧瓶中产生大量白烟,你认为这项操作是
a.关闭K3并熄灭酒精灯
b.关闭K4并熄灭酒精灯
c.关闭K3、K4并熄灭酒精灯
(6)丙同学认为该系列实验装置存在一处明显的设计缺陷,你认为该设计缺陷
您最近一年使用:0次
2022-04-14更新
|
114次组卷
|
2卷引用:江西省宜春市上高二中2021-2022学年高一下学期第七次月考化学试题
名校
5 .  在生产和生活中有着广泛用途,某化学小组在实验室制备
在生产和生活中有着广泛用途,某化学小组在实验室制备 并探究其性质。请回答:
并探究其性质。请回答:
(一) 的制备,分步骤Ⅰ、Ⅱ两步进行。
的制备,分步骤Ⅰ、Ⅱ两步进行。
步骤Ⅰ.先利用下图所示装置制备
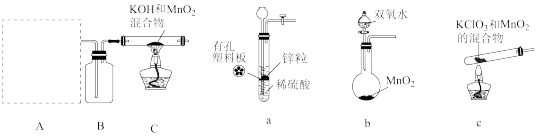
(1)装置A应选用___________ (填a、b或c)。
(2)装置B中所盛试剂的名称为___________ 。
(3)装置C处反应生成 的化学方程式为
的化学方程式为___________ 。
步骤Ⅱ.由 制备
制备 。已知:
。已知: 易溶于水,水溶液呈墨绿色。主要过程如下:
易溶于水,水溶液呈墨绿色。主要过程如下:
①充分反应后,将装置C处所得固体加水溶解,过滤;
②向滤液中通入足量CO2,过滤出生成的 ;
;
⑧将滤液蒸发浓缩、降温结晶、过滤、洗涤、干燥,得 晶体。
晶体。
(4)过程②向滤液中通入足量 ,可观察到的现象为
,可观察到的现象为___________ ;该步反应中氧化剂与还原剂的物质的量之比为___________ 。
(二)KMnO4的性质
已知:KMnO4具有强氧化性,可与草酸 反应。
反应。
(5)写出 酸性溶液与草酸反应的离子方程式
酸性溶液与草酸反应的离子方程式___________ 。
(6)基于(5)的反应原理,选择适当试剂探究浓度对化学反应速率的影响。
可供选择的试剂有:①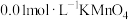 酸性溶液;②
酸性溶液;②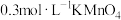 酸性溶液;③
酸性溶液;③ 溶液;④
溶液;④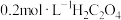 溶液,为了更好的观察现象,应选择的试剂为
溶液,为了更好的观察现象,应选择的试剂为___________ (填序号)。
 在生产和生活中有着广泛用途,某化学小组在实验室制备
在生产和生活中有着广泛用途,某化学小组在实验室制备 并探究其性质。请回答:
并探究其性质。请回答:(一)
 的制备,分步骤Ⅰ、Ⅱ两步进行。
的制备,分步骤Ⅰ、Ⅱ两步进行。步骤Ⅰ.先利用下图所示装置制备


(1)装置A应选用
(2)装置B中所盛试剂的名称为
(3)装置C处反应生成
 的化学方程式为
的化学方程式为步骤Ⅱ.由
 制备
制备 。已知:
。已知: 易溶于水,水溶液呈墨绿色。主要过程如下:
易溶于水,水溶液呈墨绿色。主要过程如下:①充分反应后,将装置C处所得固体加水溶解,过滤;
②向滤液中通入足量CO2,过滤出生成的
 ;
;⑧将滤液蒸发浓缩、降温结晶、过滤、洗涤、干燥,得
 晶体。
晶体。(4)过程②向滤液中通入足量
 ,可观察到的现象为
,可观察到的现象为(二)KMnO4的性质
已知:KMnO4具有强氧化性,可与草酸
 反应。
反应。(5)写出
 酸性溶液与草酸反应的离子方程式
酸性溶液与草酸反应的离子方程式(6)基于(5)的反应原理,选择适当试剂探究浓度对化学反应速率的影响。
可供选择的试剂有:①
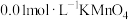 酸性溶液;②
酸性溶液;②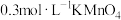 酸性溶液;③
酸性溶液;③ 溶液;④
溶液;④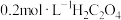 溶液,为了更好的观察现象,应选择的试剂为
溶液,为了更好的观察现象,应选择的试剂为
您最近一年使用:0次
2021-12-07更新
|
646次组卷
|
7卷引用:江西省临川一中暨临川一中实验学校2021-2022学年高二下学期第二次月考化学试题
江西省临川一中暨临川一中实验学校2021-2022学年高二下学期第二次月考化学试题河北省邢台市四校联盟2021-2022学年高三12月联考化学试题(已下线)解密11 化学实验(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题11 物质制备类综合实验-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)湖南省隆回县第二中学2021-2022学年高三上学期第四次月考化学试题(已下线)回归教材重难点10 综合实验方案的设计与评价-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)回归教材重难点10 实验方案的设计与评价-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)
解题方法
6 . 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:____________________ 、_____________________ 。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。
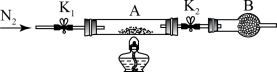
①仪器B的名称是____________________ 。
②将下列实验操作步骤正确排序___________________ (填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________ (列式表示)。若实验时按a、d次序操作,则使x__________ (填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
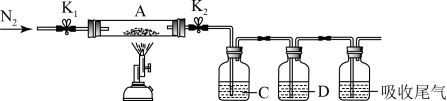
①C、D中的溶液依次为_________ (填标号)。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_________________________ 。
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是
②将下列实验操作步骤正确排序
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式
您最近一年使用:0次
名校
解题方法
7 . 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:____ 。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按下图连接好装置进行实验。
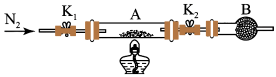
①仪器B的名称是____ 。
②将下列实验操作步骤正确排序____ (填标号);重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A
f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=____ (列式表示)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
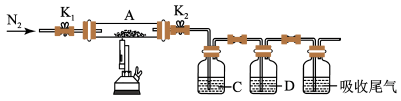
①C、D中的溶液依次为____ (填标号)。C、D有气泡,并可观察到的现象分别为____ 。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式____ 。
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按下图连接好装置进行实验。

①仪器B的名称是
②将下列实验操作步骤正确排序
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A
f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式
您最近一年使用:0次
2019-10-21更新
|
202次组卷
|
4卷引用:江西省上饶中学2019-2020学年高三上学期第一次月考化学试题
8 . 硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全。确定分解产物的成分。
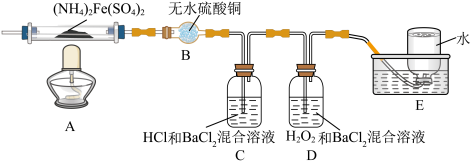
(1)B装置的作用是_________ 。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有_______ 气体产生,写出D中发生反应的离子方程式________ 。
(3)A中固体分解后产生NH3,写出其两种用途_________ 。
(4)用实验的方法验证C溶液含有NH4+:_________ 。

(1)B装置的作用是
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有
(3)A中固体分解后产生NH3,写出其两种用途
(4)用实验的方法验证C溶液含有NH4+:
您最近一年使用:0次
名校
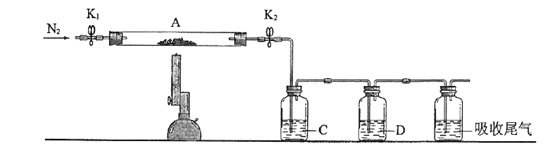
9 . 绿矾是含有一定量结晶水的硫酸亚铁(FeSO4·XH2O),在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________ 、_______________ 。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。
①仪器B的名称是____________________ 。
②将下列实验操作步骤正确排序___________________ (填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________ (列式表示)。若实验时按a、d次序操作,则使x__________ (填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。C、D中的溶液依次为BaCl2溶液、浓H2SO4。C、D中有气泡冒出,并可观察到的现象分别为产生白色沉淀、品红溶液褪色。写出硫酸亚铁高温分解反应的化学方程式_____________________ 。
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。
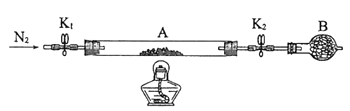
①仪器B的名称是
②将下列实验操作步骤正确排序
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。C、D中的溶液依次为BaCl2溶液、浓H2SO4。C、D中有气泡冒出,并可观察到的现象分别为产生白色沉淀、品红溶液褪色。写出硫酸亚铁高温分解反应的化学方程式
您最近一年使用:0次
2018-08-21更新
|
245次组卷
|
3卷引用:【全国百强校】江西省上高县第二中学2019届高三上学期第一次月考(开学考试)化学试题
名校
10 . 锰的化合物种类较多,大多具有广泛的用途。
Ⅰ.MnO2是H2O2分解的良好的催化剂,它也具有较强的氧化性。某化学兴趣小组通过实验探究MnO2的性质。
该小组设计了如下4个方案以验证MnO2的氧化性,可行的是__________ (填序号)。
把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
把MnO2固体加入到H2O2溶液中,观察是否有气泡产生
Na2SO3溶液中,加入MnO2固体,再滴加BaCl2溶液,观察是否有白色沉淀生成
FeSO4溶液中滴加几滴KSCN溶液,再加入MnO2固体,观察溶液是否变红
为研究溶液中MnO2的氧化能力与溶液酸碱性的关系,该小组同学设计了如下的对比实验:在室温下,取A、B、C三支试管,用同浓度同体积的KI溶液和质量、颗粒大小相同的MnO2固体反应,然后分别加入1mL0.2mol/L NaOH溶液、1mL水、1mL0.1mol/L稀硫酸。现象记录如表所示:
①从以上实验中,我们可以得出的结论是_____________________ 。
②写出C试管中发生反应的离子方程式:_______________________ 。
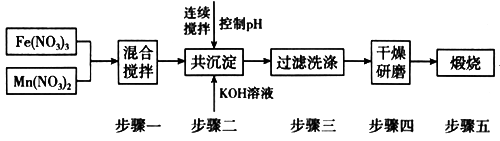
Ⅱ.铁酸锰(MnFe2O4)可用于热化学循环分解水制氢,可有效缓解能源危机。MnFe2O4的制备工艺流程如图:
已知:Fe3+、Mn2+沉淀的pH如表格所示。
步骤一中投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比理论上应为_________________ 。
步骤二中需控制pH的范围是_________________ 。
步骤三中是否洗涤干净的判断方法是_____________________ 。
Ⅰ.MnO2是H2O2分解的良好的催化剂,它也具有较强的氧化性。某化学兴趣小组通过实验探究MnO2的性质。
该小组设计了如下4个方案以验证MnO2的氧化性,可行的是
把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
把MnO2固体加入到H2O2溶液中,观察是否有气泡产生
Na2SO3溶液中,加入MnO2固体,再滴加BaCl2溶液,观察是否有白色沉淀生成
FeSO4溶液中滴加几滴KSCN溶液,再加入MnO2固体,观察溶液是否变红
为研究溶液中MnO2的氧化能力与溶液酸碱性的关系,该小组同学设计了如下的对比实验:在室温下,取A、B、C三支试管,用同浓度同体积的KI溶液和质量、颗粒大小相同的MnO2固体反应,然后分别加入1mL0.2mol/L NaOH溶液、1mL水、1mL0.1mol/L稀硫酸。现象记录如表所示:
| 试管编号 | 实验现象 |
| A | 溶液不变色 |
| B | 溶液缓慢变浅棕褐色 |
| C | 溶液迅速变棕褐色 |
①从以上实验中,我们可以得出的结论是
②写出C试管中发生反应的离子方程式:
Ⅱ.铁酸锰(MnFe2O4)可用于热化学循环分解水制氢,可有效缓解能源危机。MnFe2O4的制备工艺流程如图:
已知:Fe3+、Mn2+沉淀的pH如表格所示。
| 开始沉淀 | 完全沉淀 | |
| Fe3+ | 2.7 | 4.2 |
| Mn2+ | 8.3 | 10.4 |
步骤二中需控制pH的范围是
步骤三中是否洗涤干净的判断方法是
您最近一年使用:0次
2017-03-06更新
|
59次组卷
|
2卷引用:2016-2017学年江西省景德镇市第一中学高二(素质班)上学期期末考试化学试卷



