名校
1 . 硫酸亚铁(FeSO4)和硫酸亚铁铵[(NH4)2Fe(SO4)2]都是在生产、生活中有重要用途的亚铁盐,探究其饱和溶液稳定性的实验如下:先分别配制FeSO4、(NH4)2Fe(SO4)2饱和溶液,测定pH分别为4.46、4.22,后续实验如图所示。
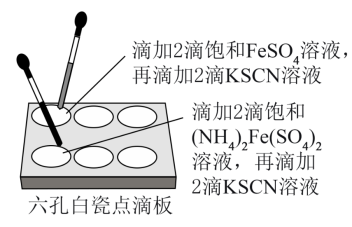
实验结果如表:
回答下列问题:
(1)用白瓷点滴板做上述对比实验的主要优点是____ (答出两条)。
(2)由该实验可以得出两种饱和溶液的稳定性:FeSO4____ (NH4)2Fe(SO4)2(填“大于”“小于”或“等于”,下同),物质的量浓度:FeSO4____ (NH4)2Fe(SO4)2。
(3)FeSO4饱和溶液需要新配制,若久置会发黄、变浑浊,且pH减小,发生反应的离子方程式为____ 。
(4)影响溶液中Fe2+稳定性的因素可提出3种假设。
假设1: 的存在使溶液中Fe2+稳定性增强。
的存在使溶液中Fe2+稳定性增强。
假设2:_____ 使溶液中Fe2+稳定性增强。
假设3:H+浓度增大使溶液中Fe2+稳定性增强。
假设1的依据是 具有一定的还原性,对Fe2+有保护作用,判断该观点是否合理并说明理由
具有一定的还原性,对Fe2+有保护作用,判断该观点是否合理并说明理由____ 。
(5)实验测得相同浓度的FeSO4溶液在不同pH条件下,Fe2+的损耗量%与pH的关系及Fe2+的氧化速率与时间的关系如图(实验过程中溶液温度几乎无变化)。
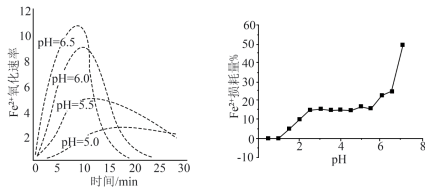
据图分析,开始时Fe2+氧化速率较小,随着产物的生成,速率明显加快,说明产物对反应有催化作用,起催化作用的产物是____ (填化学式),其催化活性最强的pH范围是____ (填标号)。
A.0~1 B.2~2.4 C.2.4~5.5 D.5.5~7
从趋势上看,pH越小,Fe2+损耗量越小的原因是____ 。

实验结果如表:
| 硫酸亚铁和硫酸亚铁铵饱和溶液稳定性对比实验研究 | |||||||
| 溶质 | 0min | 1min | 15min | 60min | 3h | 5h | 24h |
| FeSO4 | 淡淡的桔黄色 | 桔红色 | 红色 | 红色 | 深红 | 深红 | 深红 |
| (NH4)2Fe(SO4)2 | 几乎无色 | 米色 | 米色 | 浅黄 | 黄色 | 桔红 | 桔红 |
(1)用白瓷点滴板做上述对比实验的主要优点是
(2)由该实验可以得出两种饱和溶液的稳定性:FeSO4
(3)FeSO4饱和溶液需要新配制,若久置会发黄、变浑浊,且pH减小,发生反应的离子方程式为
(4)影响溶液中Fe2+稳定性的因素可提出3种假设。
假设1:
 的存在使溶液中Fe2+稳定性增强。
的存在使溶液中Fe2+稳定性增强。假设2:
假设3:H+浓度增大使溶液中Fe2+稳定性增强。
假设1的依据是
 具有一定的还原性,对Fe2+有保护作用,判断该观点是否合理并说明理由
具有一定的还原性,对Fe2+有保护作用,判断该观点是否合理并说明理由(5)实验测得相同浓度的FeSO4溶液在不同pH条件下,Fe2+的损耗量%与pH的关系及Fe2+的氧化速率与时间的关系如图(实验过程中溶液温度几乎无变化)。

据图分析,开始时Fe2+氧化速率较小,随着产物的生成,速率明显加快,说明产物对反应有催化作用,起催化作用的产物是
A.0~1 B.2~2.4 C.2.4~5.5 D.5.5~7
从趋势上看,pH越小,Fe2+损耗量越小的原因是
您最近一年使用:0次
2 . 焦亚硫酸钠(Na2S2O5)用途广泛,是常见的漂白剂、疏松剂、食品抗氧化剂,某研究性学习小组探究焦亚硫酸钠的制取以及其性质。请回答下列问题:
Ⅰ.制备、收集干燥的SO2
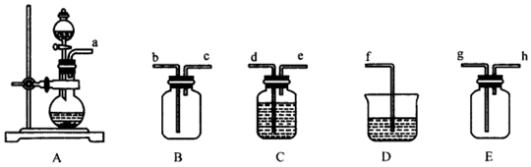
(1)实验室制取SO2的试剂是______ (填字母序号)
①4mol•L-1HNO3溶液 ②70%的H2SO4溶液 ③CaSO3固体 ④Na2SO3固体
A.①③ B.①④ C.②③ D.②④
(2)实验室制取SO2的化学方程式为______ 。按气流方向连接各仪器a→_______ →g→f(注:考虑防倒吸现象)。
Ⅱ.焦亚硫酸钠的制取
①在搅拌的条件下,向饱和碳酸钠溶液中通入SO2至反应液的pH=4.1;
②将溶液蒸发浓缩、结晶、离心分离,20~30℃干燥得到成品。
(3)SO2与Na2CO3溶液反应生成NaHSO3和CO2的化学方程式为_____ 。
Ⅲ.焦亚硫酸钠的性质
(4)Na2S2O5作脱氧剂时的反应原理为:Na2S2O5+O2+H2O=Na2SO4+H2SO4,该反应中,氧化产物是______ ,检验Na2S2O5晶体作脱氧剂时已被氧化的实验方案是_______ 。
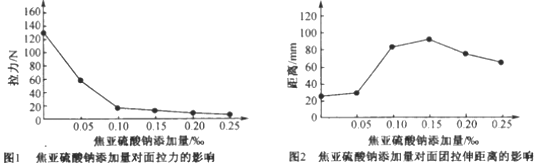
(5)适当加入Na2S2O5使面团变得柔软,面团延伸性增加,拉断面团所需的拉力也逐渐减少,过度加入Na2S2O5会严重破坏蛋白质网络结构,面团变得稀软、发黏、延伸性下降,如图所示。综合来说,当添加量为______ (填字母序号)时,面团延伸性较好。
A.0~0.05‰ B.0.05‰~0.10‰ C.0.1‰~0.15‰ D.0.20‰~0.25‰
Ⅰ.制备、收集干燥的SO2

(1)实验室制取SO2的试剂是
①4mol•L-1HNO3溶液 ②70%的H2SO4溶液 ③CaSO3固体 ④Na2SO3固体
A.①③ B.①④ C.②③ D.②④
(2)实验室制取SO2的化学方程式为
Ⅱ.焦亚硫酸钠的制取
①在搅拌的条件下,向饱和碳酸钠溶液中通入SO2至反应液的pH=4.1;
②将溶液蒸发浓缩、结晶、离心分离,20~30℃干燥得到成品。
(3)SO2与Na2CO3溶液反应生成NaHSO3和CO2的化学方程式为
Ⅲ.焦亚硫酸钠的性质
(4)Na2S2O5作脱氧剂时的反应原理为:Na2S2O5+O2+H2O=Na2SO4+H2SO4,该反应中,氧化产物是
(5)适当加入Na2S2O5使面团变得柔软,面团延伸性增加,拉断面团所需的拉力也逐渐减少,过度加入Na2S2O5会严重破坏蛋白质网络结构,面团变得稀软、发黏、延伸性下降,如图所示。综合来说,当添加量为
A.0~0.05‰ B.0.05‰~0.10‰ C.0.1‰~0.15‰ D.0.20‰~0.25‰

您最近一年使用:0次
3 . FeSO4用于治疗缺铁性贫血。为探究硫酸亚铁的分解产物,按如下装置进行实验。打开K1和K2,缓慢通入N2,加热。实验后反应管中残留固体为红色粉末。分析实验回答下列问题:

(1)加热前通入N2的目的是__________ 。
(2)实验过程中可观察到装置B中的现象为_____ 。C中观察到品红溶液褪色,则可证明混合气体中含有的物质是_____ 。
(3)反应后A中残留红色粉末的用途有__________ (任写一条)。
(4)写出FeSO4高温分解反应的化学方程式__________ 。

(1)加热前通入N2的目的是
(2)实验过程中可观察到装置B中的现象为
(3)反应后A中残留红色粉末的用途有
(4)写出FeSO4高温分解反应的化学方程式
您最近一年使用:0次
4 . Na2O2是重要的化工原料,具有多种用途。
(1)Na2O2具有氧化性,可以将SO2氧化为硫酸钠,写出该反应的化学方程式:______________ ,该反应中,Na2O2的作用为____________ (填“还原剂”、“氧化剂”或“既是氧化剂又是还原剂”)。
(2)Na2O2与CO2反应可以产生氧气。某同学通过下列装置验证Na2O2能否与CO2反应。 (图中铁架台等装置已略去)。
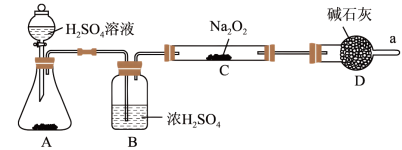
①装置A的名称是_______ ,A中的固体为_________ ,装置B中试剂的作用为______
②若Na2O2能与CO2,则装置C中的现象是____________
(3)无水氯化钙是干燥剂,在a处收集气体,检测发现该气体中几乎都是CO2气体(过氧化钠足量),则说明过氧化钠与CO2气体不反应。该同学查阅相关文献,然后撤掉装置B,其他都保留(包括试剂),连接好装置后再次进行实验,重新收集气体检测,发现得到的气体几乎都是氧气,该实验结果说明过氧化钠与CO2气体反应需要_______________ 。
(4)将一定量的Na2O2固体投入到含有下列离子的溶液中:SO32-、HCO3-、CO32-、Na+,反应完毕后,溶液中上述离子数目几乎不变的有(不考虑溶液体积的变化)__________ (填离子符号)。
(1)Na2O2具有氧化性,可以将SO2氧化为硫酸钠,写出该反应的化学方程式:
(2)Na2O2与CO2反应可以产生氧气。某同学通过下列装置验证Na2O2能否与CO2反应。 (图中铁架台等装置已略去)。

①装置A的名称是
②若Na2O2能与CO2,则装置C中的现象是
(3)无水氯化钙是干燥剂,在a处收集气体,检测发现该气体中几乎都是CO2气体(过氧化钠足量),则说明过氧化钠与CO2气体不反应。该同学查阅相关文献,然后撤掉装置B,其他都保留(包括试剂),连接好装置后再次进行实验,重新收集气体检测,发现得到的气体几乎都是氧气,该实验结果说明过氧化钠与CO2气体反应需要
(4)将一定量的Na2O2固体投入到含有下列离子的溶液中:SO32-、HCO3-、CO32-、Na+,反应完毕后,溶液中上述离子数目几乎不变的有(不考虑溶液体积的变化)
您最近一年使用:0次
名校
5 . I.高锰酸钾在实验室和工农业生产中有广泛的用途,实验室以二氧化锰为主要原料制备高锰酸钾,其部分流程如下:
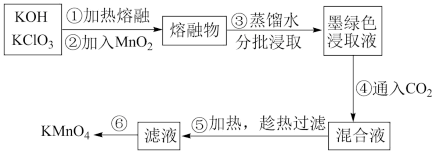
(1)第①步加热熔融应在铁坩埚中进行,而不用瓷坩埚的原因是_______ (用化学方程式表示)。
(2)第④步通入适量CO2,发生反应生成 、MnO2和碳酸盐,则发生反应的离子方程式为
、MnO2和碳酸盐,则发生反应的离子方程式为____ 。
(3)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、过滤、洗涤、干燥,干燥过程中,温度不宜过高,其原因是_______ (用化学方程式表)。
(4)H2O2和KMnO4都是常用的强氧化剂,若向H2O2溶液中滴加酸性高锰酸钾溶液,则酸性高锰酸钾溶液会褪色,写出该反应的离子方程式:_____ 。
II.某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和C12的性质。
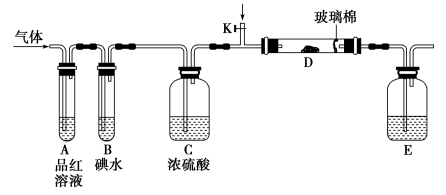
(5)若从左端分别通入SO2和C12,装置A中观察到的现象是否相同_______ (填“相同”或“不相同”)。
(6)若装置B中装有5.0mL1.0mol•L-1的碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2mol电子,则该反应的化学方程式为_____ 。
(7)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4:3;当Cl2与含有X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含有X的溶液反应的离子方程式:_______ 。

(1)第①步加热熔融应在铁坩埚中进行,而不用瓷坩埚的原因是
(2)第④步通入适量CO2,发生反应生成
 、MnO2和碳酸盐,则发生反应的离子方程式为
、MnO2和碳酸盐,则发生反应的离子方程式为(3)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、过滤、洗涤、干燥,干燥过程中,温度不宜过高,其原因是
(4)H2O2和KMnO4都是常用的强氧化剂,若向H2O2溶液中滴加酸性高锰酸钾溶液,则酸性高锰酸钾溶液会褪色,写出该反应的离子方程式:
II.某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和C12的性质。

(5)若从左端分别通入SO2和C12,装置A中观察到的现象是否相同
(6)若装置B中装有5.0mL1.0mol•L-1的碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2mol电子,则该反应的化学方程式为
(7)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4:3;当Cl2与含有X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含有X的溶液反应的离子方程式:
您最近一年使用:0次
2016-12-09更新
|
1025次组卷
|
5卷引用:云南省临沧市第一中学2018届高三上学期第七次月考化学试题



