1 . 将液体Y滴加到盛有固体X的试管中,并在试管口对生成的气体进行检验。下表中固体X、液体Y及检测方法对应关系错误的是( )
| 选项 | 固体X | 液体Y | 检测方法 |
| A | CaO | 浓氨水 | 蘸有浓盐酸的玻璃棒 |
| B | Cu | 浓硫酸 | 干燥的红色石蕊试纸 |
| C | Na2O2 | 水 | 带火星的木条 |
| D | Na2CO3 | 稀硫酸 | 滴有澄清石灰水的玻璃片 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-12-06更新
|
85次组卷
|
4卷引用:吉林省长春市北京师范大学长春附属学校2019-2020学年高二下学期期末考试化学试题
吉林省长春市北京师范大学长春附属学校2019-2020学年高二下学期期末考试化学试题(已下线)2011届福建省厦门六中高三上学期11月月考化学试卷(已下线)专题10.2 物质的分离、提纯、检验与鉴别(讲)-《2020年高考一轮复习讲练测》上海市上海财经大学附属中学2019——2020学年高三上学期期中考试化学试题
解题方法
2 . 常温下,三硫代碳酸钠(Na2CS3)是玫瑰红色针状固体,与碳酸钠性质相近。在工农业生产中有广泛的用途。某小组设计实验探究三硫代碳酸钠的性质并测定其溶液的浓度。
实验一:探究Na2CS3的性质
(1)向Na2CS3溶液中滴入酚酞试液,溶液变红色。用离子方程式说明溶液呈碱性的原因_________ 。
(2)向Na2CS3溶液中滴加酸性KMnO4溶液,紫色褪去。该反应中被氧化的元素是__________ 。
实验二:测定Na2CS3溶液的浓度

按如图所示连接好装置,取50.0mLNa2CS3溶液置于三颈瓶中,打开分液漏斗的活塞,滴入足量2.0mol/L稀H2SO4,关闭活塞。
已知:Na2CS3 + H2SO4=Na2SO4+ CS2 + H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,密度1.26g/mL,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
(1)盛放碱石灰的仪器的名称是_______ ,碱石灰的主要成分是______ (填化学式)。
(2)C中发生反应的离子方程式是____________ 。
(3)反应结束后打开活塞K,再缓慢通入N2一段时间,其目的是_________ 。
(4)为了计算Na2CS3溶液的浓度,对充分反应后B中混合物进行过滤、洗涤、干燥、称重,得8.4g 固体,则三颈瓶中Na2CS3的物质的量浓度为______ 。
实验一:探究Na2CS3的性质
(1)向Na2CS3溶液中滴入酚酞试液,溶液变红色。用离子方程式说明溶液呈碱性的原因
(2)向Na2CS3溶液中滴加酸性KMnO4溶液,紫色褪去。该反应中被氧化的元素是
实验二:测定Na2CS3溶液的浓度

按如图所示连接好装置,取50.0mLNa2CS3溶液置于三颈瓶中,打开分液漏斗的活塞,滴入足量2.0mol/L稀H2SO4,关闭活塞。
已知:Na2CS3 + H2SO4=Na2SO4+ CS2 + H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,密度1.26g/mL,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
(1)盛放碱石灰的仪器的名称是
(2)C中发生反应的离子方程式是
(3)反应结束后打开活塞K,再缓慢通入N2一段时间,其目的是
(4)为了计算Na2CS3溶液的浓度,对充分反应后B中混合物进行过滤、洗涤、干燥、称重,得8.4g 固体,则三颈瓶中Na2CS3的物质的量浓度为
您最近一年使用:0次
3 . 某研究性学习小组的同学利用MnO2、浓盐酸反应来制取干燥的氯气并验证其有无漂白性,所用装置如图所示(可重复使用,不含制气装置)。下列说法正确的是( )
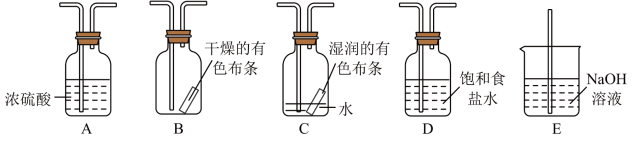

| A.按气流流动的先后顺序,装置连接顺序依次为DACBE |
| B.按气流流动的先后顺序,装置连接顺序依次为DABAE |
| C.装置E的主要用途是制备NaClO |
| D.若实验中使用到装置C且有色布条褪色,则说明湿润的氯气有漂白性 |
您最近一年使用:0次
2018-09-15更新
|
550次组卷
|
8卷引用:吉林省桦甸市第八高级中学2019届高三第一次阶段性考试(8月)化学试题
吉林省桦甸市第八高级中学2019届高三第一次阶段性考试(8月)化学试题(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第2讲 氧及其化合物【教学案】2020届高三化学一轮复习 化学基础实验(选择题和大题训练)黑龙江省哈尔滨市第一中学2021届高三上学期期中考试化学试题(已下线)第12讲 富集在海水中的元素——卤素(精讲)-2022年一轮复习讲练测四川省遂宁市射洪中学2021-2022学年高一上学期第三次(12月)月考(强基班)化学试题(已下线)第12讲 富集在海水中的元素——卤素(讲)-2023年高考化学一轮复习讲练测(全国通用)第3课时 氧化还原反应的应用
4 . 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解。滴加KSCN溶液,溶液颜色无明显变化;再向试管中滴入双氧水,溶液变红。由此可知FeSO4具有__________ 性。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。
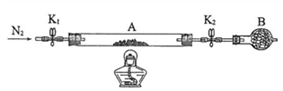
① 仪器B的名称是_____________________ 。
② 将下列实验操作步骤正确排序__________ (填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=__________ (列式表示)。
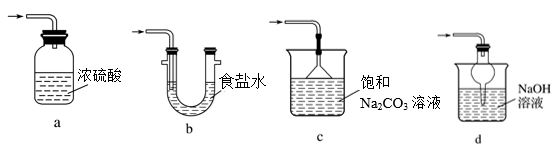
(3)为进一步探究硫酸亚铁分解的性质及产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
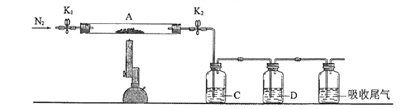
①C中盛有BaCl2溶液,观察到C中有白色沉淀生成,写出相关反应的离子方程式____________________ 。
②D中所盛的试剂为品红溶液,观察到溶液褪色,写出硫酸亚铁高温分解反应的化学方程式________________________________________________________ 。
③装置E用于处理尾气,可选用的装置(夹持仪器已略去)为__________ (填字母)。
(1)在试管中加入少量绿矾样品,加水溶解。滴加KSCN溶液,溶液颜色无明显变化;再向试管中滴入双氧水,溶液变红。由此可知FeSO4具有
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

① 仪器B的名称是
② 将下列实验操作步骤正确排序
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=
(3)为进一步探究硫酸亚铁分解的性质及产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。


①C中盛有BaCl2溶液,观察到C中有白色沉淀生成,写出相关反应的离子方程式
②D中所盛的试剂为品红溶液,观察到溶液褪色,写出硫酸亚铁高温分解反应的化学方程式
③装置E用于处理尾气,可选用的装置(夹持仪器已略去)为

您最近一年使用:0次
2017-11-03更新
|
244次组卷
|
2卷引用:吉林省长春外国语学校2018届高三上学期期中考试理科综合化学试题
名校
5 . 硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,用途十分广泛。它可以作净水剂,在无机化学工业中,它是制取其它铁化合物的原料。
【查阅资料】隔绝空气加热至500℃时硫酸亚铁铵能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等。
【实验探究】某化学小组选用下图所示部分装置进行实验(部分夹持装置略)
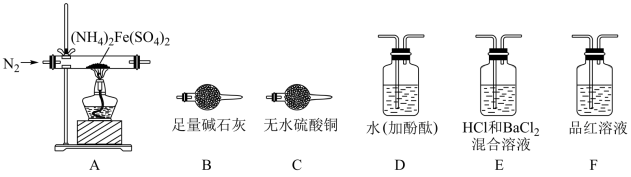
(1)验证分解产物中含有氨气和水蒸气,并探究残留固体成分。
①所选用装置的正确连接顺序为( ) 。
A.A-B-C-D B.A-C-B-D C.A-D-B-C D.A-D-C-B
②取A中残留固体,加入适量稀硫酸,使其完全溶解得到溶液B,下列哪组实验能够证明A中残留固体仅为Fe2O3,而不含 FeO 或 Fe3O4( )
A.向溶液B中滴加酸性高锰酸钾溶液,高锰酸钾溶液不褪色
B.向溶液B中加入苯酚,溶液呈紫色
C.向溶液B中通入足量氯气,加入硫氰酸钾溶液变红色
D.向溶液B中加入铁氰化钾溶液,无现象
(2)探究分解产物中的硫氧化物,连接装置A—E—F—B进行实验。
①实验过程中观察到:E中没有明显现象,F中溶液褪色,据此得出该硫化物是__________ 。
②实验证明(NH4)2Fe(SO4)2受热分解除上述产物外,还有N2生成,写出A中反应的化学方程式________ 。
【查阅资料】隔绝空气加热至500℃时硫酸亚铁铵能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等。
【实验探究】某化学小组选用下图所示部分装置进行实验(部分夹持装置略)

(1)验证分解产物中含有氨气和水蒸气,并探究残留固体成分。
①所选用装置的正确连接顺序为
A.A-B-C-D B.A-C-B-D C.A-D-B-C D.A-D-C-B
②取A中残留固体,加入适量稀硫酸,使其完全溶解得到溶液B,下列哪组实验能够证明A中残留固体仅为Fe2O3,而不含 FeO 或 Fe3O4
A.向溶液B中滴加酸性高锰酸钾溶液,高锰酸钾溶液不褪色
B.向溶液B中加入苯酚,溶液呈紫色
C.向溶液B中通入足量氯气,加入硫氰酸钾溶液变红色
D.向溶液B中加入铁氰化钾溶液,无现象
(2)探究分解产物中的硫氧化物,连接装置A—E—F—B进行实验。
①实验过程中观察到:E中没有明显现象,F中溶液褪色,据此得出该硫化物是
②实验证明(NH4)2Fe(SO4)2受热分解除上述产物外,还有N2生成,写出A中反应的化学方程式
您最近一年使用:0次
2017-10-23更新
|
225次组卷
|
2卷引用:吉林省实验中学2018届高三上学期第二次月考化学试题



