1 . 实验室用如图所示装置检验草酸晶体( )分解生成的含碳气体产物(不考虑草酸蒸气)。已知:常温下,CO通入
)分解生成的含碳气体产物(不考虑草酸蒸气)。已知:常温下,CO通入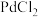 的盐酸溶液中生成黑色Pd粉。下列说法错误的是
的盐酸溶液中生成黑色Pd粉。下列说法错误的是
 )分解生成的含碳气体产物(不考虑草酸蒸气)。已知:常温下,CO通入
)分解生成的含碳气体产物(不考虑草酸蒸气)。已知:常温下,CO通入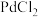 的盐酸溶液中生成黑色Pd粉。下列说法错误的是
的盐酸溶液中生成黑色Pd粉。下列说法错误的是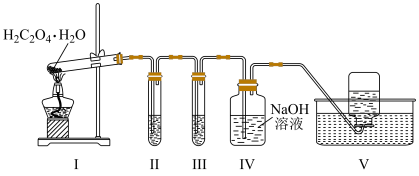
| A.Ⅰ中大试管口向上倾斜,可能因为草酸晶体的熔点低于分解温度 |
| B.由Ⅱ中现象可推断草酸晶体分解生成CO |
| C.Ⅱ、Ⅲ中现象可推断草酸晶体分解反应存在元素化合价变化 |
| D.可用燃烧法代替Ⅴ进行尾气处理 |
您最近一年使用:0次
名校
解题方法
2 . 某同学进行如下实验:
①将H2O2溶液与KI溶液混合,产生大量气泡,溶液颜色变黄;
②将①中的黄色溶液分成两等份,一份加入CCl4,振荡,产生气泡速率明显减小,下层溶液呈紫红色;另一份不加CCl4,振荡,产生气泡速率无明显变化。
下列说法不正确 的是
①将H2O2溶液与KI溶液混合,产生大量气泡,溶液颜色变黄;
②将①中的黄色溶液分成两等份,一份加入CCl4,振荡,产生气泡速率明显减小,下层溶液呈紫红色;另一份不加CCl4,振荡,产生气泡速率无明显变化。
下列说法
| A.①中溶液颜色变黄的原因是:H2O2+2I-=I2+2OH- |
| B.②中下层溶液呈紫红色是因为I2溶于CCl4 |
| C.②中产生气泡速率减小的原因是H2O2浓度减小 |
| D.由该实验可知,I2可以加快H2O2分解产生气泡反应速率 |
您最近一年使用:0次
2024-04-27更新
|
339次组卷
|
2卷引用:2024届江西省吉安市第一中学高三下学期一模化学试题
名校
解题方法
3 . 为探究 的性质,设计了如下实验。
的性质,设计了如下实验。
下列说法错误的是
 的性质,设计了如下实验。
的性质,设计了如下实验。| 实验装置 |
|
| 实验操作及现象 | ①抽去毛玻璃片后,反应瓶内壁有白色固体物质生成,红棕色气体逐渐变浅,直至无色。 ②取白色固体物质溶于水,依次加入稀盐酸、  溶液,溶液中出现白色沉淀。 溶液,溶液中出现白色沉淀。 |
A.白色固体主要成分为 |
B.物质氧化性:浓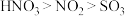 |
C.由实验可知,能用湿润的淀粉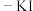 试纸鉴别 试纸鉴别 与 与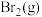 |
D.实验后的剩余气体可用酸性 溶液处理,防止污染空气 溶液处理,防止污染空气 |
您最近一年使用:0次
2024-03-09更新
|
646次组卷
|
5卷引用:江西省赣州市2024届高三下学期年3月摸底考试化学试题
江西省赣州市2024届高三下学期年3月摸底考试化学试题江西省赣州市2024届高三下学期3月摸底考试化学试题云南省云南师范大学实验中学2023-2024学年高一下学期三月月考化学试题河北省廊坊市2023-2024学年高一下学期3月月考化学试题(已下线)通关练02 重要无机化合物的性质及应用-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
解题方法
4 . 以下探究目的对应的实验方案最合适的是
| 实验方案 | 探究目的 | |
| A | 向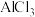 溶液中加入金属 溶液中加入金属 | 比较 和 和 的还原能力 的还原能力 |
| B | 分别向稀硝酸和稀醋酸中加入铜粉 | 比较稀硝酸和稀醋酸的酸性强弱 |
| C | 将浓硫酸滴入乙醇中,加热至 ,生成的气体通入酸性重铬酸钾溶液 ,生成的气体通入酸性重铬酸钾溶液 | 验证乙烯具有还原性 |
| D | 向 溶液中同时通入 溶液中同时通入 和 和 | 比较 和 和 的氧化能力 的氧化能力 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-01-23更新
|
956次组卷
|
5卷引用:2024年1月江西普通高等学校招生考试适应性测试化学试题
2024年1月江西普通高等学校招生考试适应性测试化学试题(已下线)2024年1月“九省联考”江西卷真题完全解读与考后提升(已下线)选择题1-52024届陕西省咸阳市乾县第一中学高三下学期第一次模拟考试理综试题-高中化学(已下线)热点08 表格型实验方案的设计与评价
名校
解题方法
5 . 三硫代碳酸钠(Na2CS3)在农业上用作杀菌剂和杀线虫剂,在工业上用于处理废水中的重金属离子。某化学兴趣小组对Na2CS3的一些性质进行了探究性实验。
实验1.探究Na2CS3的性质:
(1)H2CS3是___________ (填“强”或“弱”)酸。
(2)已知步骤③中反应的氧化产物是 ,则每生成1 mol
,则每生成1 mol  ,转移
,转移___________ mol 电子。
(3)某同学取步骤③反应后所得溶液于试管中,滴加足量盐酸和氯化钡溶液,他认为通过测定产生的白色沉淀的质量即可求出实验中所用的Na2CS3的质量,你是否同意他的观点并说明理由:___________ 。
实验II.测定Na2CS3溶液的浓度:
按如图所示装置进行实验:将50. 0 mL Na2CS3溶液置于三颈烧瓶中,打开仪器M的活塞,滴入足量2.0 mol· L-1的稀H2SO4,关闭活塞。
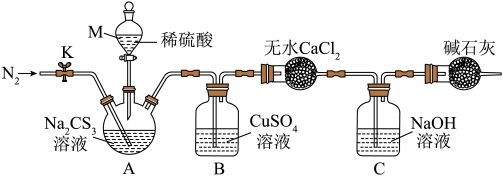
已知: +2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)
+2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)
(4)仪器M的名称是___________ ;反应开始前需要先通入一段时间N2,其作用为___________ 。
(5)B中发生反应的离子方程式为___________ 。
(6)为了计算三硫代碳酸钠溶液的浓度,可通过测定B中生成沉淀的质量来计算。称量B中沉淀质量之前需要进行的实验操作是___________ 、干燥, 若B中生成沉淀的质量为8.4 g,则Na2CS3溶液的物质的量浓度是___________ mol·L-1。
实验1.探究Na2CS3的性质:
| 步骤 | 操作及现象 |
| ① | 取少量Na2CS3固体溶于蒸馏水中,配制成溶液并分成两等份 |
| ② | 向其中一份溶液中滴加几滴酚酞试剂,溶液变成红色 |
| ③ | 向另一份溶液中滴加用硫酸酸化的KMnO4溶液,紫色褪去 |
(2)已知步骤③中反应的氧化产物是
 ,则每生成1 mol
,则每生成1 mol  ,转移
,转移(3)某同学取步骤③反应后所得溶液于试管中,滴加足量盐酸和氯化钡溶液,他认为通过测定产生的白色沉淀的质量即可求出实验中所用的Na2CS3的质量,你是否同意他的观点并说明理由:
实验II.测定Na2CS3溶液的浓度:
按如图所示装置进行实验:将50. 0 mL Na2CS3溶液置于三颈烧瓶中,打开仪器M的活塞,滴入足量2.0 mol· L-1的稀H2SO4,关闭活塞。

已知:
 +2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)
+2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)(4)仪器M的名称是
(5)B中发生反应的离子方程式为
(6)为了计算三硫代碳酸钠溶液的浓度,可通过测定B中生成沉淀的质量来计算。称量B中沉淀质量之前需要进行的实验操作是
您最近一年使用:0次
2023-05-04更新
|
345次组卷
|
3卷引用:江西省赣州市2023届高三下学期4月联考理科综合化学试题
名校
解题方法
6 . 某小组研究钠与不同浓度盐酸的反应。
【实验操作】
取5块质量均为0.20 g且形状相似的金属钠,分别放入20 mL不同浓度的盐酸中,如图。
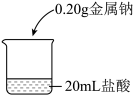
【实验现象与数据】
经检验,⑤中出现的白色浑浊中的固体为NaCl。
【问题与讨论】
(1)补全钠与盐酸反应的化学方程式:
_______ :
(2)小组得出结论:钠的密度小于盐酸的密度,依据的实验现象是_______ 。
(3)在上述实验中,盐酸浓度越大,钠完全消失所用的时间_______ 。
(4)在上述实验中,钠完全消失所用的时间不同。原因可能是:盐酸浓度越大,化学反应越快,但是生成的氯化钠改变了盐酸与钠的_______ ,该因素影响了化学反应速率,进而影响了钠完全消失所用的时间。
【实验操作】
取5块质量均为0.20 g且形状相似的金属钠,分别放入20 mL不同浓度的盐酸中,如图。

【实验现象与数据】
| 编号 | ① | ② | ③ | ④ | ⑤ |
| c(HCl)/(mol·L-1) | 0.5 | 1.0 | 1.5 | 3.0 | 6.0 |
| 主要现象 | 钠浮在液面上,四处游动 | ||||
| 钠燃烧。溶液澄清 | 钠短时燃烧。溶液澄清 | 钠的表面有火花。溶液澄清 | 钠的表面。有少量火花。溶液澄清 | 钠的周围出现白色浑浊,一段时间后变澄清 | |
| 钠完全消失所用的时间/s | 11 | 21 | 37 | 65 | 114 |
【问题与讨论】
(1)补全钠与盐酸反应的化学方程式:

(2)小组得出结论:钠的密度小于盐酸的密度,依据的实验现象是
(3)在上述实验中,盐酸浓度越大,钠完全消失所用的时间
(4)在上述实验中,钠完全消失所用的时间不同。原因可能是:盐酸浓度越大,化学反应越快,但是生成的氯化钠改变了盐酸与钠的
您最近一年使用:0次
2023-03-15更新
|
505次组卷
|
3卷引用:江西省抚州市宜黄县第一中学2023届高三一模考试化学试题
7 . 甲醛(HCHO)是无色气体,易溶于水,有特殊的刺激性气味,对人眼、鼻等有刺激作用。40%甲醛溶液沸点为96℃,易挥发。甲醛在碱性溶液中具有极强的还原性。为探究过量甲醛和新制 反应的产物成分,进行如下研究:
反应的产物成分,进行如下研究:
(1)在如图装置中进行实验,向a中加入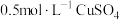 溶液50mL和
溶液50mL和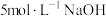 溶液100mL ,振荡,再加入40%的甲醛溶液40mL,缓慢加热a,在65℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红色,并有气体产生。
溶液100mL ,振荡,再加入40%的甲醛溶液40mL,缓慢加热a,在65℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红色,并有气体产生。
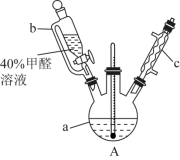
①仪器b的名称是_______ 。
②仪器c的作用为_______ 。
③能说明甲醛具有还原性的实验现象是_______ 。
(2)查阅资料发现气体产物是副反应产生的。为确认气体产物中含 不含CO,将装置A和如图所示的装置连接后进行实验。
不含CO,将装置A和如图所示的装置连接后进行实验。
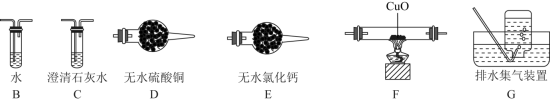
①依次连接的合理顺序为:A→B→_______→_______→_______→_______→G。______
②装置B的作用是_______ 。
③确认气体产物中含 而不含CO的现象是
而不含CO的现象是_______ 。
 反应的产物成分,进行如下研究:
反应的产物成分,进行如下研究:(1)在如图装置中进行实验,向a中加入
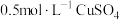 溶液50mL和
溶液50mL和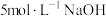 溶液100mL ,振荡,再加入40%的甲醛溶液40mL,缓慢加热a,在65℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红色,并有气体产生。
溶液100mL ,振荡,再加入40%的甲醛溶液40mL,缓慢加热a,在65℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红色,并有气体产生。
①仪器b的名称是
②仪器c的作用为
③能说明甲醛具有还原性的实验现象是
(2)查阅资料发现气体产物是副反应产生的。为确认气体产物中含
 不含CO,将装置A和如图所示的装置连接后进行实验。
不含CO,将装置A和如图所示的装置连接后进行实验。
①依次连接的合理顺序为:A→B→_______→_______→_______→_______→G。
②装置B的作用是
③确认气体产物中含
 而不含CO的现象是
而不含CO的现象是
您最近一年使用:0次
解题方法
8 . 次氯酸(HClO)的浓溶液呈黄色,是极强氧化剂,常用作消毒剂及除甲醛(HCHO)的试剂。某学习小组设计下列装置制备HClO并验证其氧化性(夹持仪器及降温装置已省略)。
已知:Cl2O为棕黄色气体,极易溶于水并迅速反应生成HClO。
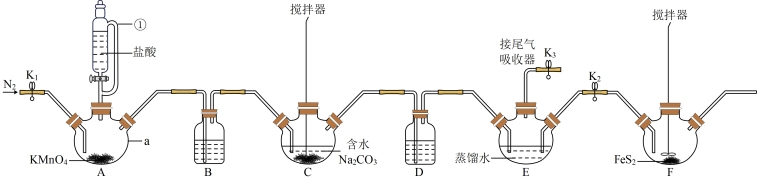
回答下列问题:
(1)HClO的结构式为____ ,仪器a的名称为____ 。
(2)制备HClO时要打开活塞K1、K3,关闭K2,待装置A中反应结束时再通入一段时间N2。
①仪器C中制备Cl2O时,发生反应的化学方程式为2Cl2+2Na2CO3+H2O-=Cl2O+2NaCl+2____ (填化学式),仪器B、D中的试剂分别为____ (填字母)。
a.浓H2SO4、CCl4
b.饱和食盐水、CCl4
c.饱和食盐水、浓H2SO4
②反应结束后再通入一段时间N2的目的是____ 。
(3)验证HClO的氧化性时要向F中加入过量HClO并充分搅拌,待溶液变澄清时停止搅拌。
①将E中HClO溶液转移到F中的具体操作为____ (答出对开关的操作)。
②反应结束时,F的溶液中含有的离子主要有Fe3+、Cl-、SO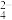 、H+,该反应的离子方程式为
、H+,该反应的离子方程式为____ 。
(4)HClO可用于除去HCHO,生成一种常见强酸和两种常见无污染的氧化物。
①该反应的化学方程式为____ 。
②若除去15gHCHO,则转移电子的个数为____ NA(NA表示阿伏加德罗常数)。
已知:Cl2O为棕黄色气体,极易溶于水并迅速反应生成HClO。

回答下列问题:
(1)HClO的结构式为
(2)制备HClO时要打开活塞K1、K3,关闭K2,待装置A中反应结束时再通入一段时间N2。
①仪器C中制备Cl2O时,发生反应的化学方程式为2Cl2+2Na2CO3+H2O-=Cl2O+2NaCl+2
a.浓H2SO4、CCl4
b.饱和食盐水、CCl4
c.饱和食盐水、浓H2SO4
②反应结束后再通入一段时间N2的目的是
(3)验证HClO的氧化性时要向F中加入过量HClO并充分搅拌,待溶液变澄清时停止搅拌。
①将E中HClO溶液转移到F中的具体操作为
②反应结束时,F的溶液中含有的离子主要有Fe3+、Cl-、SO
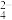 、H+,该反应的离子方程式为
、H+,该反应的离子方程式为(4)HClO可用于除去HCHO,生成一种常见强酸和两种常见无污染的氧化物。
①该反应的化学方程式为
②若除去15gHCHO,则转移电子的个数为
您最近一年使用:0次
名校
解题方法
9 . 实验小组制备硫代硫酸钠并探究其性质。
(1)实验室可利用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2↑,制备硫代硫酸钠,装置如图。
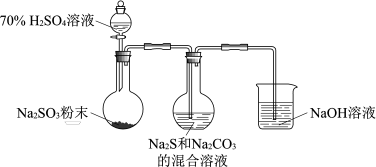
①加入化学试剂之前,应____ ,烧杯中NaOH溶液主要作用是____ 。
②用化学用语解释Na2S和Na2CO3的混合溶液呈碱性的原因:____ 、____ 。
③为了保证Na2S2O3的产量,实验中通入的SO2不能过量。要控制SO2的生成速率,可以采取的措施有:____ (写出一条)。
(2)探究Na2S2O3的性质:
实验小组研究S产生的原因:(已知:Na2S2O3中S元素的化合价分别为-2和+6价)
假设1:
假设2:空气中的O2氧化了-2价硫元素
假设3:Cl2、HClO等含氯的氧化性微粒氧化了-2价硫元素
设计实验方案:
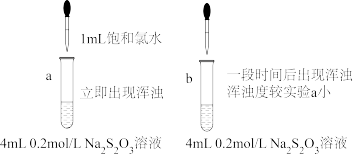
①假设1为____ 。
②向试管b中加入____ 。
③依据现象,S产生的主要原因是____ 。
④步骤3,继续加入氯水,沉淀消失的原因是____ (写化学方程式)。
(1)实验室可利用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2↑,制备硫代硫酸钠,装置如图。

①加入化学试剂之前,应
②用化学用语解释Na2S和Na2CO3的混合溶液呈碱性的原因:
③为了保证Na2S2O3的产量,实验中通入的SO2不能过量。要控制SO2的生成速率,可以采取的措施有:
(2)探究Na2S2O3的性质:
| 步骤1 | 取Na2S2O3晶体溶解,配成0.2 mol/L溶液。 |
| 步骤2 | 取4 mL溶液,向其中加入1 mL饱和氯水(pH=2.4),溶液立即出现浑浊,经检验浑浊物为S |
| 步骤3 | 继续滴加氯水,浑浊度增大,最后消失,溶液变澄清。 |
假设1:
假设2:空气中的O2氧化了-2价硫元素
假设3:Cl2、HClO等含氯的氧化性微粒氧化了-2价硫元素
设计实验方案:

①假设1为
②向试管b中加入
③依据现象,S产生的主要原因是
④步骤3,继续加入氯水,沉淀消失的原因是
您最近一年使用:0次
10 . CS(NH2)(硫脲,白色而有光泽的晶体,溶于水,20℃时溶解度为13.6g;在150℃时转变成NH4SCN)是用于制造药物、染料、金属矿物的浮选剂等的原料。某化学实验小组同学用Ca(HS)2与CaCN2(石灰氮)合成硫脲并探究其性质。
(1)制备Ca(HS)2溶液,所用装置如图(已知酸性:H2CO3>H2S):
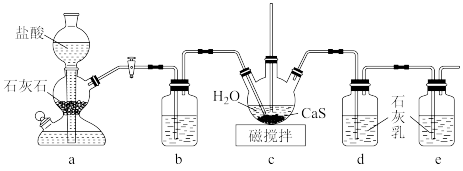
①c中盛放药品的仪器名称是____ ,装置b中盛放的试剂是____ 。
②装置c中的长直导管的作用是____ 。
(2)制备硫脲:将CaCN2与Ca(HS)2溶液混合,加热至80℃时,可合成硫脲,同时生成一种常见的碱,合适的加热方式是____ ;该反应的化学方程式为____ 。
(3)探究硫脲的性质:
①取少量硫脲溶于水并加热,验证有NH4SCN生成,检验阴离子可用的试剂是____ ,检验阳离子的方法为____ 。
②可用酸性KMnO4培液滴定硫脲,已知CS(NH2)2被氧化为CO2、N2及SO ,该反应的离子方程式为
,该反应的离子方程式为_____ 。
(1)制备Ca(HS)2溶液,所用装置如图(已知酸性:H2CO3>H2S):

①c中盛放药品的仪器名称是
②装置c中的长直导管的作用是
(2)制备硫脲:将CaCN2与Ca(HS)2溶液混合,加热至80℃时,可合成硫脲,同时生成一种常见的碱,合适的加热方式是
(3)探究硫脲的性质:
①取少量硫脲溶于水并加热,验证有NH4SCN生成,检验阴离子可用的试剂是
②可用酸性KMnO4培液滴定硫脲,已知CS(NH2)2被氧化为CO2、N2及SO
 ,该反应的离子方程式为
,该反应的离子方程式为
您最近一年使用:0次




