1 . 某小组欲研究烷烃的某些性质设计下图实验装置。回答下列问题:
Ⅰ.烷烃可以发生取代反应。
向下图的B中通入一定量的氯气和甲烷气体,混合均匀后通入C中硬质玻璃管中,夹紧C两端弹簧夹,用强光照射硬质玻璃管。

(1)将实验室制得的 先通过饱和食盐水的目的是
先通过饱和食盐水的目的是_______ 。
(2)写出装置C中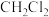 与
与 反应生成氯仿的化学方程式
反应生成氯仿的化学方程式_______ 。
(3)一段时间后,C中玻璃管内的实验现象_______ 、_______ 。
(4)若2 mol 与
与 发生取代反应,测得生成4种有机取代产物的物质的量相等,则消耗的氯气的物质的量是
发生取代反应,测得生成4种有机取代产物的物质的量相等,则消耗的氯气的物质的量是_______ mol。
(5)某丁烷与氯气发生反应的产物之一为 ,则分子式为
,则分子式为 的同分异构体有
的同分异构体有_______ 种。
Ⅱ.烷烃可以发生氧化反应。
将一定量的某烷烃在足量氧气中充分燃烧,并使产生的气体全部通入下图装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收)。

(6)试写出该烷烃分子式为_______ 。
Ⅰ.烷烃可以发生取代反应。
向下图的B中通入一定量的氯气和甲烷气体,混合均匀后通入C中硬质玻璃管中,夹紧C两端弹簧夹,用强光照射硬质玻璃管。

(1)将实验室制得的
 先通过饱和食盐水的目的是
先通过饱和食盐水的目的是(2)写出装置C中
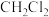 与
与 反应生成氯仿的化学方程式
反应生成氯仿的化学方程式(3)一段时间后,C中玻璃管内的实验现象
(4)若2 mol
 与
与 发生取代反应,测得生成4种有机取代产物的物质的量相等,则消耗的氯气的物质的量是
发生取代反应,测得生成4种有机取代产物的物质的量相等,则消耗的氯气的物质的量是(5)某丁烷与氯气发生反应的产物之一为
 ,则分子式为
,则分子式为 的同分异构体有
的同分异构体有Ⅱ.烷烃可以发生氧化反应。
将一定量的某烷烃在足量氧气中充分燃烧,并使产生的气体全部通入下图装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收)。

| 实验前 | 实验后 | |
| 实验前实验后(干燥剂+U形管)的质量 | 101.1g | 102.9g |
| (石灰水+广口瓶)的质量 | 312.0g | 315.3g |
您最近一年使用:0次
2023-05-23更新
|
293次组卷
|
2卷引用:江西省龙南中学2022-2023学年高一下学期6月期末考试化学试题
解题方法
2 .  溶液与KI溶液混合时,按照复分解反应原理分析,可得到AgI黄色沉淀。查阅资料可知:①
溶液与KI溶液混合时,按照复分解反应原理分析,可得到AgI黄色沉淀。查阅资料可知:① 溶液呈酸性;②
溶液呈酸性;② 具有较强的氧化性;③单质碘遇淀粉溶液会变蓝。根据所得信息,甲学生对
具有较强的氧化性;③单质碘遇淀粉溶液会变蓝。根据所得信息,甲学生对 溶液与KI溶液混合时发生的反应做出了如下猜测:
溶液与KI溶液混合时发生的反应做出了如下猜测:
猜测1:发生复分解反应。
猜测2: 与
与 发生氧化还原反应。
发生氧化还原反应。
(1)①如果猜测2成立,则发生反应的化学方程式为_______ ;为了验证该猜测,甲同学往反应后的溶液中加入淀粉,观察到溶液变蓝,证明猜测2成立。
②乙同学认为甲同学的实验方案不能证明猜测2成立,原因是 溶液中的
溶液中的 在酸性条件下具有较强的氧化性,也可能氧化
在酸性条件下具有较强的氧化性,也可能氧化 ,反应的离子方程式为
,反应的离子方程式为_______ ;该反应中的氧化剂和还原剂的物质的量之比为_______ 。
(2)乙同学利用原电池原理来验证以上猜测,设计了如图所示实验装置(盐桥中的离子可以自由移动,两烧杯中电解质溶液足量),一段时间后,电流计指针发生偏转, 溶液无气泡产生,石墨2表面有银白色金属析出。
溶液无气泡产生,石墨2表面有银白色金属析出。
①该装置的负极为石墨_______ (填“1”或“2”)。
②若石墨2增重5.4g(不考虑其他反应),则电路中转移电子数为_______  。
。
③根据实验现象,证明猜测2成立。若将盐桥中的 溶液换成
溶液换成 溶液,一段时间后,电流计指针不发生偏转,可能原因是
溶液,一段时间后,电流计指针不发生偏转,可能原因是_______ 。
(3)原电池在生产生活和学习中有着广泛的应用,下列关于原电池的说法正确的是_______(填标号)。
 溶液与KI溶液混合时,按照复分解反应原理分析,可得到AgI黄色沉淀。查阅资料可知:①
溶液与KI溶液混合时,按照复分解反应原理分析,可得到AgI黄色沉淀。查阅资料可知:① 溶液呈酸性;②
溶液呈酸性;② 具有较强的氧化性;③单质碘遇淀粉溶液会变蓝。根据所得信息,甲学生对
具有较强的氧化性;③单质碘遇淀粉溶液会变蓝。根据所得信息,甲学生对 溶液与KI溶液混合时发生的反应做出了如下猜测:
溶液与KI溶液混合时发生的反应做出了如下猜测:猜测1:发生复分解反应。
猜测2:
 与
与 发生氧化还原反应。
发生氧化还原反应。(1)①如果猜测2成立,则发生反应的化学方程式为
②乙同学认为甲同学的实验方案不能证明猜测2成立,原因是
 溶液中的
溶液中的 在酸性条件下具有较强的氧化性,也可能氧化
在酸性条件下具有较强的氧化性,也可能氧化 ,反应的离子方程式为
,反应的离子方程式为(2)乙同学利用原电池原理来验证以上猜测,设计了如图所示实验装置(盐桥中的离子可以自由移动,两烧杯中电解质溶液足量),一段时间后,电流计指针发生偏转,
 溶液无气泡产生,石墨2表面有银白色金属析出。
溶液无气泡产生,石墨2表面有银白色金属析出。
①该装置的负极为石墨
②若石墨2增重5.4g(不考虑其他反应),则电路中转移电子数为
 。
。③根据实验现象,证明猜测2成立。若将盐桥中的
 溶液换成
溶液换成 溶液,一段时间后,电流计指针不发生偏转,可能原因是
溶液,一段时间后,电流计指针不发生偏转,可能原因是(3)原电池在生产生活和学习中有着广泛的应用,下列关于原电池的说法正确的是_______(填标号)。
| A.原电池是化学能转化为电能的装置 | B.原电池内发生的反应为氧化还原反应 |
| C.所有的化学反应均可设计成原电池 | D.电子从负极流出,经电解质溶液流入正极 |
您最近一年使用:0次
2023-05-20更新
|
196次组卷
|
2卷引用:江西省吉安市吉州区部分学校联考2022-2023学年高一下学期7月期末考试化学试题
名校
解题方法
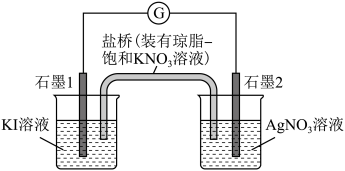
3 . 人类的农业生产离不开氮肥,几乎所有的氮肥都以氨为原料,某化学兴趣小组利用图1装置制备氨气,图2装置探究其相关性质。
I.实验室制取氨气。
(1)图1装置中生成NH3的化学方程式为______ 。检验圆底烧瓶中已收集满氨气的方法是______ 。
II.探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。
(2)无水硫酸铜的作用是______ ;仪器b的名称为______ ;有同学认为需要在无水硫酸铜的后面再接一个装有CaCl2固体的球形干燥管,这样做的目的是______ 。
(3)实验中观察到a中CuO粉末变红,b中无水硫酸铜变蓝,并收集到一种单质气体。则该反应的化学方程式为______ 。
(4)若a中消耗标准状况下3.36L的氨气,理论得到铜的质量为______ g。

I.实验室制取氨气。
(1)图1装置中生成NH3的化学方程式为
II.探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。
(2)无水硫酸铜的作用是
(3)实验中观察到a中CuO粉末变红,b中无水硫酸铜变蓝,并收集到一种单质气体。则该反应的化学方程式为
(4)若a中消耗标准状况下3.36L的氨气,理论得到铜的质量为
您最近一年使用:0次
2023-05-11更新
|
504次组卷
|
2卷引用:江西省全南中学2022-2023学年高一下学期教学质量验收化学试题
名校
解题方法
4 . 亚硝酸钠(NaNO2)在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业中的用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。
已知:①NO+NO2+2OH-=2 +H2O;
+H2O;
②气体液化的温度:NO2为21℃,NO为-152℃。
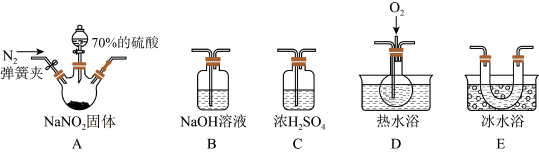
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接)为A、C、___________ 、___________ 、B。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是___________ 。
(3)在关闭弹簧夹、打开分液漏斗活塞、滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是___________ ;
②装置E的作用是___________ 。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为___________ 。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是___________ 。
已知:①NO+NO2+2OH-=2
 +H2O;
+H2O;②气体液化的温度:NO2为21℃,NO为-152℃。

(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接)为A、C、
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是
(3)在关闭弹簧夹、打开分液漏斗活塞、滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是
②装置E的作用是
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是
您最近一年使用:0次
2023-05-11更新
|
739次组卷
|
5卷引用:江西省宜春市上高中学2022-2023学年高一下学期7月期末考试化学试题
名校
解题方法
5 . 三硫代碳酸钠(Na2CS3)在农业上用作杀菌剂和杀线虫剂,在工业上用于处理废水中的重金属离子。某化学兴趣小组对Na2CS3的一些性质进行了探究性实验。
实验1.探究Na2CS3的性质:
(1)H2CS3是___________ (填“强”或“弱”)酸。
(2)已知步骤③中反应的氧化产物是 ,则每生成1 mol
,则每生成1 mol  ,转移
,转移___________ mol 电子。
(3)某同学取步骤③反应后所得溶液于试管中,滴加足量盐酸和氯化钡溶液,他认为通过测定产生的白色沉淀的质量即可求出实验中所用的Na2CS3的质量,你是否同意他的观点并说明理由:___________ 。
实验II.测定Na2CS3溶液的浓度:
按如图所示装置进行实验:将50. 0 mL Na2CS3溶液置于三颈烧瓶中,打开仪器M的活塞,滴入足量2.0 mol· L-1的稀H2SO4,关闭活塞。
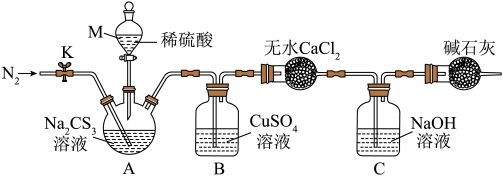
已知: +2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)
+2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)
(4)仪器M的名称是___________ ;反应开始前需要先通入一段时间N2,其作用为___________ 。
(5)B中发生反应的离子方程式为___________ 。
(6)为了计算三硫代碳酸钠溶液的浓度,可通过测定B中生成沉淀的质量来计算。称量B中沉淀质量之前需要进行的实验操作是___________ 、干燥, 若B中生成沉淀的质量为8.4 g,则Na2CS3溶液的物质的量浓度是___________ mol·L-1。
实验1.探究Na2CS3的性质:
| 步骤 | 操作及现象 |
| ① | 取少量Na2CS3固体溶于蒸馏水中,配制成溶液并分成两等份 |
| ② | 向其中一份溶液中滴加几滴酚酞试剂,溶液变成红色 |
| ③ | 向另一份溶液中滴加用硫酸酸化的KMnO4溶液,紫色褪去 |
(2)已知步骤③中反应的氧化产物是
 ,则每生成1 mol
,则每生成1 mol  ,转移
,转移(3)某同学取步骤③反应后所得溶液于试管中,滴加足量盐酸和氯化钡溶液,他认为通过测定产生的白色沉淀的质量即可求出实验中所用的Na2CS3的质量,你是否同意他的观点并说明理由:
实验II.测定Na2CS3溶液的浓度:
按如图所示装置进行实验:将50. 0 mL Na2CS3溶液置于三颈烧瓶中,打开仪器M的活塞,滴入足量2.0 mol· L-1的稀H2SO4,关闭活塞。

已知:
 +2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)
+2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)(4)仪器M的名称是
(5)B中发生反应的离子方程式为
(6)为了计算三硫代碳酸钠溶液的浓度,可通过测定B中生成沉淀的质量来计算。称量B中沉淀质量之前需要进行的实验操作是
您最近一年使用:0次
2023-05-04更新
|
345次组卷
|
3卷引用:江西省赣州市2023届高三下学期4月联考理科综合化学试题
6 . 某化学小组同学欲按如图装置进行实验,探究NH3催化氧化反应。

A、B装置可选药品:浓氨水、H2O2、蒸馏水、NaOH固体、MnO2
(1)装置A用于制取氧气,其发生反应的化学方程式是_______ 。
(2)装置D的名称是______ ,其所装试剂是_______ 。
(3)装置E中发生反应的化学方程式是______ 。
(4)实验一段时间后,观察到装置F中有红棕色气体,生成红棕色气体的化学方程式是_______ ,用离子方程式表示G中溶液变成蓝色的原因:_______ 。
(5)可用如图所示的装置替换上述装置中虚线框部分,化合物X为_______ 。NH4HCO3的作用是______ 。


A、B装置可选药品:浓氨水、H2O2、蒸馏水、NaOH固体、MnO2
(1)装置A用于制取氧气,其发生反应的化学方程式是
(2)装置D的名称是
(3)装置E中发生反应的化学方程式是
(4)实验一段时间后,观察到装置F中有红棕色气体,生成红棕色气体的化学方程式是
(5)可用如图所示的装置替换上述装置中虚线框部分,化合物X为

您最近一年使用:0次
7 . 焦亚硫酸钠 是常用的抗氧化剂,在空气中、受热时均易分解。
是常用的抗氧化剂,在空气中、受热时均易分解。
化学兴趣小组同学利用图所示装置(部分夹持装置已略去,实验前已除去装置中的空气)制取 并探究
并探究 的性质。
的性质。
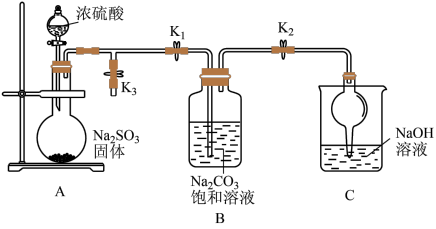
Ⅰ.打开 和
和 ,关闭
,关闭 ,制取
,制取 。
。
(1) 中O元素化合价为-2,其中S的化合价为
中O元素化合价为-2,其中S的化合价为___________ 。
(2)装置A中所发生反应的化学方程式为___________ ,装置C的作用是___________ 。
(3)B中通入过量 充分反应后,经冷却结晶时发生反应
充分反应后,经冷却结晶时发生反应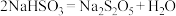 可获得
可获得 晶体。B中生成
晶体。B中生成 的化学方程式为
的化学方程式为___________ 。
(4)B中所得 晶体常用饱和
晶体常用饱和 水溶液洗涤。用饱和
水溶液洗涤。用饱和 水溶液洗涤的目的除洗去产物表面的杂质离子外还有
水溶液洗涤的目的除洗去产物表面的杂质离子外还有___________ 。
(5)装置C反应后烧杯中含有 和
和 ,验证该溶液中含有
,验证该溶液中含有 溶液的方法:取少量溶液,滴加足量的稀硫酸,
溶液的方法:取少量溶液,滴加足量的稀硫酸,___________ 。
Ⅱ.更换B瓶中的溶液,探究的性质。
(6)将B中溶液更换为品红的乙醇溶液,无明显现象,而将 通入品红的水溶液中,溶液褪色。可推知,
通入品红的水溶液中,溶液褪色。可推知,___________ 不能使品红褪色。
 是常用的抗氧化剂,在空气中、受热时均易分解。
是常用的抗氧化剂,在空气中、受热时均易分解。化学兴趣小组同学利用图所示装置(部分夹持装置已略去,实验前已除去装置中的空气)制取
 并探究
并探究 的性质。
的性质。
Ⅰ.打开
 和
和 ,关闭
,关闭 ,制取
,制取 。
。(1)
 中O元素化合价为-2,其中S的化合价为
中O元素化合价为-2,其中S的化合价为(2)装置A中所发生反应的化学方程式为
(3)B中通入过量
 充分反应后,经冷却结晶时发生反应
充分反应后,经冷却结晶时发生反应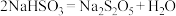 可获得
可获得 晶体。B中生成
晶体。B中生成 的化学方程式为
的化学方程式为(4)B中所得
 晶体常用饱和
晶体常用饱和 水溶液洗涤。用饱和
水溶液洗涤。用饱和 水溶液洗涤的目的除洗去产物表面的杂质离子外还有
水溶液洗涤的目的除洗去产物表面的杂质离子外还有(5)装置C反应后烧杯中含有
 和
和 ,验证该溶液中含有
,验证该溶液中含有 溶液的方法:取少量溶液,滴加足量的稀硫酸,
溶液的方法:取少量溶液,滴加足量的稀硫酸,Ⅱ.更换B瓶中的溶液,探究的性质。
(6)将B中溶液更换为品红的乙醇溶液,无明显现象,而将
 通入品红的水溶液中,溶液褪色。可推知,
通入品红的水溶液中,溶液褪色。可推知,
您最近一年使用:0次
2023-04-30更新
|
129次组卷
|
2卷引用:江西省彭泽县第二高级中学2022-2023学年高一下学期5月期中考试化学试题
解题方法
8 . T℃时,在体积为2L的密闭容器内,与同一个化学反应有关的A、B、C、D四种物质(D为固体,其余均为气体)的物质的量随反应时间变化的曲线如图所示,回答下列问题。
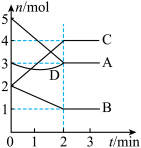
(1)该反应的化学方程式为_______ 。
(2)物质D在反应中的作用是______ 。
(3)若在上述反应中A是SO2、B是O2、C是SO3。下列说法能表示反应达到平衡状态的是______ (填字母);在0~2min内用O2表示的反应速率v(O2)=______ 。
A.容器内的气体压强保持不变 B.物质的量浓度:c(SO2)=2c(O2)
C.混合气的平均相对分子质量保持不变 D.化学反应速率:v(SO2)=v(SO3)
(4)某兴趣小组同学拟在实验室中制取SO2,并探究SO2使品红溶液褪色的原因。
①用Cu和浓硫酸反应制取SO2,化学反应方程式是_______ 。
②兴趣小组同学利用如图装置探究SO2的漂白性,观察到I中品红溶液不褪色,II中品红溶液褪色。
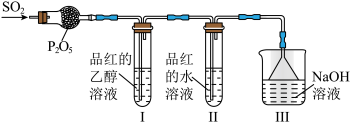
查阅资料:SO2通入水中存在如下反应:SO2+xH2O SO2•xH2O
SO2•xH2O H++HSO
H++HSO +(x-1)H2O;HSO
+(x-1)H2O;HSO
 SO
SO +H+。
+H+。
通过分析上述现象,猜测使品红水溶液褪色的微粒可能是i.H2SO3;ii.______ ;iii.______ 。
③为了证明上述猜测ii和iii,进行表中实验1和2,记录现象。
该实验说明,两种粒子中,______ 使品红水溶液褪色程度更大。
④取实验1所得溶液直接加热接近沸腾,溶液不恢复红色,在热溶液中滴加稀硫酸则恢复红色;说明______ ;取实验2所得溶液直接加热,则慢慢恢复浅红色,说明NaHSO3与品红生成的物质不稳定。

(1)该反应的化学方程式为
(2)物质D在反应中的作用是
(3)若在上述反应中A是SO2、B是O2、C是SO3。下列说法能表示反应达到平衡状态的是
A.容器内的气体压强保持不变 B.物质的量浓度:c(SO2)=2c(O2)
C.混合气的平均相对分子质量保持不变 D.化学反应速率:v(SO2)=v(SO3)
(4)某兴趣小组同学拟在实验室中制取SO2,并探究SO2使品红溶液褪色的原因。
①用Cu和浓硫酸反应制取SO2,化学反应方程式是
②兴趣小组同学利用如图装置探究SO2的漂白性,观察到I中品红溶液不褪色,II中品红溶液褪色。

查阅资料:SO2通入水中存在如下反应:SO2+xH2O
 SO2•xH2O
SO2•xH2O H++HSO
H++HSO +(x-1)H2O;HSO
+(x-1)H2O;HSO
 SO
SO +H+。
+H+。通过分析上述现象,猜测使品红水溶液褪色的微粒可能是i.H2SO3;ii.
③为了证明上述猜测ii和iii,进行表中实验1和2,记录现象。
| 实验序号 | 实验1 | 实验2 |
| 实验操作 |  2mL0.20mol•L-1Na2SO3溶液 |  2mL0.20mol•L-1NaHSO3溶液 |
| 实验现象 | 迅速褪色 | 褪色较慢 |
④取实验1所得溶液直接加热接近沸腾,溶液不恢复红色,在热溶液中滴加稀硫酸则恢复红色;说明
您最近一年使用:0次
2023-04-28更新
|
380次组卷
|
3卷引用:江西省南昌市等5地2022-2023学年高一下学期4月期中考试化学试题
名校
解题方法
9 . 利用如图微型实验装置制取H2S和SO2,并探究硫元素之间的转化。实验时挤压胶头滴管使硫酸滴到药匙中,然后倾斜试管使硫酸滴到药匙外与FeS反应。下列说法错误的是
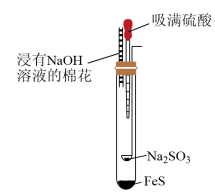

| A.实验开始一段时间后,试管内壁上有黄色颗粒出现 |
| B.玻璃导气管中塞有蘸NaOH棉花的目的是吸收尾气 |
| C.实验过程中发生的反应均可用离子方程式表示 |
D.生成SO2的离子反应为SO +2H+=SO2↑+H2O +2H+=SO2↑+H2O |
您最近一年使用:0次
2023-04-28更新
|
207次组卷
|
3卷引用:江西省南昌市等5地2022-2023学年高一下学期4月期中考试化学试题
名校
解题方法
10 . 用下列仪器或装置进行相应实验,部分现象描述和解释不正确的是
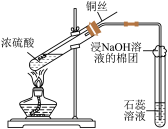 | 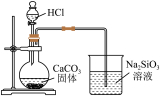 |  | 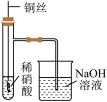 |
| ① | ② | ③ | ④ |
| A.①中石蕊溶液变为红色后不褪色 |
| B.②的烧杯中产生白色沉淀,说明非金属性Cl>C>Si |
| C.③中产生红棕色气体,不能说明木炭与浓硝酸发生了反应 |
| D.④的试管内先出现红棕色气体,后变无色 |
您最近一年使用:0次
2023-04-21更新
|
405次组卷
|
4卷引用:江西省宜春市宜丰中学2022-2023学年高一下学期5月月考化学试题



