1 . 铁氰化钾 是一种络合物,易溶于水,水溶液带有黄绿色,常用于检验
是一种络合物,易溶于水,水溶液带有黄绿色,常用于检验 。某小组拟设计实验制备铁氰化钾并探究其性质。
。某小组拟设计实验制备铁氰化钾并探究其性质。
实验(一)制备铁氰化钾。以亚铁氰化钾为原料采用氧化法制备铁氰化钾,装置如图所示。
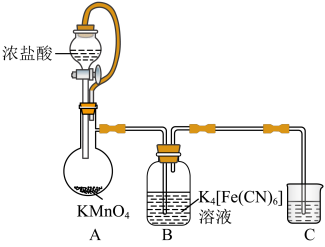
(1)装置A中橡胶管的作用是___________ 。装置C中试剂可能是___________ 。
(2)装置B中化学方程式为___________ 。
(3)从装置B中分离产品,可采用___________ 、降温结晶、___________ 、洗涤、干燥一系列操作。
实验(二)探究 性质。
性质。
【资料显示】
配合物在水中能完全电离出外界和内界,例如: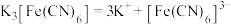 。
。
【提出问题】
 能否电离?
能否电离?
【提出猜想】
猜想1:不能电离;猜想2:能部分电离(存在电离平衡);猜想3:___________。
【设计实验】
(4)猜想3的横线上应填___________ ,综合上述实验分析,可知:猜想___________ 成立。
(5)用方程式和必要的文字分析实验②现象:___________ ,写出产生蓝色沉淀的离子方程式:___________ 。
 是一种络合物,易溶于水,水溶液带有黄绿色,常用于检验
是一种络合物,易溶于水,水溶液带有黄绿色,常用于检验 。某小组拟设计实验制备铁氰化钾并探究其性质。
。某小组拟设计实验制备铁氰化钾并探究其性质。实验(一)制备铁氰化钾。以亚铁氰化钾为原料采用氧化法制备铁氰化钾,装置如图所示。

(1)装置A中橡胶管的作用是
(2)装置B中化学方程式为
(3)从装置B中分离产品,可采用
实验(二)探究
 性质。
性质。【资料显示】
配合物在水中能完全电离出外界和内界,例如:
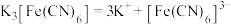 。
。【提出问题】
 能否电离?
能否电离?【提出猜想】
猜想1:不能电离;猜想2:能部分电离(存在电离平衡);猜想3:___________。
【设计实验】
| 实验 | 实验操作及现象 |
| ① | 向浓度均为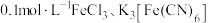 的混合溶液中插入一根无锈铁丝,立即产生蓝色沉淀 的混合溶液中插入一根无锈铁丝,立即产生蓝色沉淀 |
| ② | 向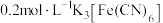 溶液插入一根无锈铁丝(与①相同),一段时间后,溶液产生蓝色 溶液插入一根无锈铁丝(与①相同),一段时间后,溶液产生蓝色 |
(4)猜想3的横线上应填
(5)用方程式和必要的文字分析实验②现象:
您最近一年使用:0次
名校
解题方法
2 . 按如图装置进行实验,将70%浓硫酸全部加入Y形试管Na2SO3中,关闭活塞。B、C处分别为蘸取相应溶液的试纸,下列说法错误的是
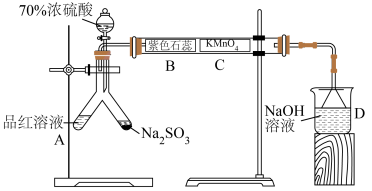

| A.A处品红溶液褪色后,加热可恢复红色 |
| B.B处试纸紫色褪去 |
| C.C处现象可验证SO2被氧化 |
| D.若将D中NaOH溶液换为Na2S溶液,则D中会有淡黄色沉淀生成 |
您最近一年使用:0次
3 . 实验室制备SO2并探究SO2的性质,利用如图装置进行实验。

回答下列问题:
(1)盛装浓硫酸的仪器名称为________ ,装置A中的化学方程式为________ 。
(2)若试剂a为蒸馏水,则装置B中反应的化学方程式为________ 。
(3)若试剂a为BaCl2溶液,则B中________ (填“能”或“不能”)观察到有白色沉淀生成,请说明原因: _______ 。
(4)若试剂a为AgNO3溶液,装置B中观察到白色沉淀。分析装置B中沉淀的成分,提出白色沉淀中可能含有Ag2SO3或Ag2SO4或二者混合物。
①请设计实验检验白色沉淀中是否含有Ag2SO3:________ ;
②推测含Ag2SO4的原因是_______ 。

回答下列问题:
(1)盛装浓硫酸的仪器名称为
(2)若试剂a为蒸馏水,则装置B中反应的化学方程式为
(3)若试剂a为BaCl2溶液,则B中
(4)若试剂a为AgNO3溶液,装置B中观察到白色沉淀。分析装置B中沉淀的成分,提出白色沉淀中可能含有Ag2SO3或Ag2SO4或二者混合物。
①请设计实验检验白色沉淀中是否含有Ag2SO3:
②推测含Ag2SO4的原因是
您最近一年使用:0次
名校
解题方法
4 . 为探究 的性质,设计了如下实验。
的性质,设计了如下实验。
下列说法错误的是
 的性质,设计了如下实验。
的性质,设计了如下实验。| 实验装置 |
|
| 实验操作及现象 | ①抽去毛玻璃片后,反应瓶内壁有白色固体物质生成,红棕色气体逐渐变浅,直至无色。 ②取白色固体物质溶于水,依次加入稀盐酸、  溶液,溶液中出现白色沉淀。 溶液,溶液中出现白色沉淀。 |
A.白色固体主要成分为 |
B.物质氧化性:浓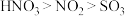 |
C.由实验可知,能用湿润的淀粉 试纸鉴别 试纸鉴别 与 与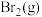 |
D.实验后的剩余气体可用酸性 溶液处理,防止污染空气 溶液处理,防止污染空气 |
您最近一年使用:0次
2024-03-09更新
|
645次组卷
|
5卷引用:江西省赣州市2024届高三下学期3月摸底考试化学试题
江西省赣州市2024届高三下学期3月摸底考试化学试题江西省赣州市2024届高三下学期年3月摸底考试化学试题云南省云南师范大学实验中学2023-2024学年高一下学期三月月考化学试题河北省廊坊市2023-2024学年高一下学期3月月考化学试题(已下线)通关练02 重要无机化合物的性质及应用-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
名校
5 .  具有强氧化性,
具有强氧化性, 具有还原性,某探究小组的同学学习氧化还原反应的知识后推测
具有还原性,某探究小组的同学学习氧化还原反应的知识后推测 与
与 可以发生反应。为了验证他们的猜想,设计了如图所示的实验进行验证。
可以发生反应。为了验证他们的猜想,设计了如图所示的实验进行验证。
Ⅰ.实验探究:
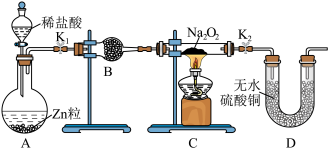
(1)利用装置A制取 ,写出装有稀盐酸的仪器名称
,写出装有稀盐酸的仪器名称___________ ,B装置里面盛放的试剂可以是___________ (填序号),作用是___________ 。
A.浓硫酸 B.碱石灰 C.无水氯化钙 D.无水硫酸铜
(2)下面是实验过程中的重要步骤,选出正确的操作顺序___________ 。(填序号)
①用小试管收集气体,并检验其纯度
②组装好实验装置,检查装置的气密性
③加热装有 的硬质玻璃管,使其逐渐熔化,反应一段时间
的硬质玻璃管,使其逐渐熔化,反应一段时间
④打开止水夹 和
和 ,通过分液漏斗向
,通过分液漏斗向 中滴加稀盐酸
中滴加稀盐酸
⑤停止加热,充分冷却后,关闭止水夹 和
和
(3)在实验过程中观察到C中淡黄色固体逐渐变成白色,无水硫酸铜未变成蓝色,则 与
与 反应的化学方程式为
反应的化学方程式为___________ 。
(4)若只用水和酚酞溶液___________ (填“能”或“不能”)检验C中 是否反应完全。
是否反应完全。
Ⅱ.数据处理:
(5)实验结束以后,该小组的同学还想测定 装置内白色固体中未反应完的
装置内白色固体中未反应完的 含量。
含量。
操作流程如下:

①白色固体中 的质量分数为
的质量分数为___________ (用含 和
和 的式子表示)。
的式子表示)。
②若在转移溶液的过程中,不小心将溶液溅到蒸发皿外面,则测得的 的质量分数
的质量分数___________ (填“偏大”、“偏小”或“不变”)
 具有强氧化性,
具有强氧化性, 具有还原性,某探究小组的同学学习氧化还原反应的知识后推测
具有还原性,某探究小组的同学学习氧化还原反应的知识后推测 与
与 可以发生反应。为了验证他们的猜想,设计了如图所示的实验进行验证。
可以发生反应。为了验证他们的猜想,设计了如图所示的实验进行验证。
Ⅰ.实验探究:
(1)利用装置A制取
 ,写出装有稀盐酸的仪器名称
,写出装有稀盐酸的仪器名称A.浓硫酸 B.碱石灰 C.无水氯化钙 D.无水硫酸铜
(2)下面是实验过程中的重要步骤,选出正确的操作顺序
①用小试管收集气体,并检验其纯度
②组装好实验装置,检查装置的气密性
③加热装有
 的硬质玻璃管,使其逐渐熔化,反应一段时间
的硬质玻璃管,使其逐渐熔化,反应一段时间④打开止水夹
 和
和 ,通过分液漏斗向
,通过分液漏斗向 中滴加稀盐酸
中滴加稀盐酸⑤停止加热,充分冷却后,关闭止水夹
 和
和
(3)在实验过程中观察到C中淡黄色固体逐渐变成白色,无水硫酸铜未变成蓝色,则
 与
与 反应的化学方程式为
反应的化学方程式为(4)若只用水和酚酞溶液
 是否反应完全。
是否反应完全。Ⅱ.数据处理:
(5)实验结束以后,该小组的同学还想测定
 装置内白色固体中未反应完的
装置内白色固体中未反应完的 含量。
含量。操作流程如下:

①白色固体中
 的质量分数为
的质量分数为 和
和 的式子表示)。
的式子表示)。②若在转移溶液的过程中,不小心将溶液溅到蒸发皿外面,则测得的
 的质量分数
的质量分数
您最近一年使用:0次
2023-10-11更新
|
366次组卷
|
3卷引用:江西省信丰中学2023-2024学年高一上学期第二次月考化学试题
名校
解题方法
6 . 某小组同学分别探究 溶液、
溶液、 溶液的性质。
溶液的性质。
I.探究 溶液的性质。
溶液的性质。
(1)从物质类别角度判断 属于
属于___________ ,因此可以与某些碱反应。
(2)预测 具有氧化性,因此可以与
具有氧化性,因此可以与 反应,此时
反应,此时 体现
体现___________ 性。
(3)预测 具有还原性,预测依据是
具有还原性,预测依据是___________ ,因此可以与酸性 溶液反应。
溶液反应。
(4)进行如下实验操作:
①i中的现象是________ ,用化学方程式表示产生该现象的原因:_________ 、_________ 。
②ii中反应的离子方程式是___________ 。
③iii中的现象是___________ 。
II.探究 溶液的性质。
溶液的性质。
小组同学进行如下实验操作并观察到对应现象:
(5)iv中反应的离子方程式是___________ 。
III.小组同学探究vi中褪色原因,提出两种假设:a.铁离子被转化,b. 被转化。
被转化。
(6)分别向褪色后的溶液中滴加 溶液和
溶液和 溶液各1滴,观察到
溶液各1滴,观察到_________ 现象,得出结论:假设b成立。
 溶液、
溶液、 溶液的性质。
溶液的性质。I.探究
 溶液的性质。
溶液的性质。(1)从物质类别角度判断
 属于
属于(2)预测
 具有氧化性,因此可以与
具有氧化性,因此可以与 反应,此时
反应,此时 体现
体现(3)预测
 具有还原性,预测依据是
具有还原性,预测依据是 溶液反应。
溶液反应。(4)进行如下实验操作:
 | 序号 | 操作 |
| i | 滴加 溶液 溶液 | |
| ii | 加入少量锌粉 | |
| iii | 滴加酸性 溶液 溶液 |
②ii中反应的离子方程式是
③iii中的现象是
II.探究
 溶液的性质。
溶液的性质。小组同学进行如下实验操作并观察到对应现象:
| 操作 | 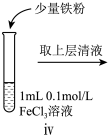 |  |  |
| 现象 | 溶液由棕黄色变为浅绿色 | 无明显现象 | 溶液变为红色,而后红色褪去 |
III.小组同学探究vi中褪色原因,提出两种假设:a.铁离子被转化,b.
 被转化。
被转化。(6)分别向褪色后的溶液中滴加
 溶液和
溶液和 溶液各1滴,观察到
溶液各1滴,观察到
您最近一年使用:0次
2023-09-10更新
|
284次组卷
|
3卷引用:江西省赣州市信丰中学2023-2024学年高一上学期第四次月考化学试题
江西省赣州市信丰中学2023-2024学年高一上学期第四次月考化学试题内蒙古巴彦淖尔市第一中学2022-2023学年高一上学期1月期末考试化学试题(已下线)专题03 铁 金属材料-【寒假自学课】2024年高一化学寒假提升学与练(人教版2019)
7 . 我国早期科技丛书(物理小识·金石类》记载:“青矾厂气熏人,衣服当之易烂,载木不盛”,“青矾强热,得赤色固体,气凝即得矾油”。“青矾”是指 ,“青矾厂气”是指
,“青矾厂气”是指 和
和 ,“矾油”是指硫酸(
,“矾油”是指硫酸( 熔点-75.5℃,沸点-10℃;
熔点-75.5℃,沸点-10℃; 熔点16.8℃,沸点44.8℃)。某实验小组利用如图装置模拟古法制硫酸并进行
熔点16.8℃,沸点44.8℃)。某实验小组利用如图装置模拟古法制硫酸并进行 ,性质探究。
,性质探究。
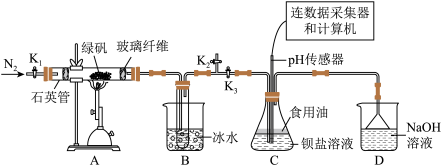
回答下列问题:
I.制取硫酸
(1)实验开始前打开活塞 、
、___________ ,关闭活塞___________ ,通入一段时间 后。关闭活塞
后。关闭活塞___________ 。打开活塞___________ ,用酒精喷灯高温加热绿矾。
(2)A装置硬质玻璃管中发生反应的化学方程式为___________ 。
(3)B装置的作用是___________ 。
II.探究 的性质
的性质
在装置C中先后三次加入同浓度同体积不同情况的钡盐溶液。控制食用油油层厚度一致、通入 流速一致(
流速一致( 是具有强氧化性的强酸)。三次实验现象如下表:
是具有强氧化性的强酸)。三次实验现象如下表:
分别得到如下pH-t图:

(4)C装置中覆盖食用油的目的是___________ 。
(5)pH-t图中,曲线①呈缓慢下降趋势,这是因为___________ 。
(6)曲线②出现骤降,这是因为___________ (用离子方程式来表达)。
 ,“青矾厂气”是指
,“青矾厂气”是指 和
和 ,“矾油”是指硫酸(
,“矾油”是指硫酸( 熔点-75.5℃,沸点-10℃;
熔点-75.5℃,沸点-10℃; 熔点16.8℃,沸点44.8℃)。某实验小组利用如图装置模拟古法制硫酸并进行
熔点16.8℃,沸点44.8℃)。某实验小组利用如图装置模拟古法制硫酸并进行 ,性质探究。
,性质探究。
回答下列问题:
I.制取硫酸
(1)实验开始前打开活塞
 、
、 后。关闭活塞
后。关闭活塞(2)A装置硬质玻璃管中发生反应的化学方程式为
(3)B装置的作用是
II.探究
 的性质
的性质在装置C中先后三次加入同浓度同体积不同情况的钡盐溶液。控制食用油油层厚度一致、通入
 流速一致(
流速一致( 是具有强氧化性的强酸)。三次实验现象如下表:
是具有强氧化性的强酸)。三次实验现象如下表:| 实验 | ① | ② | ③ |
| 所加试剂 | 已煮沸的 溶液 溶液 | 未煮沸的 溶液 溶液 | 已煮沸的 溶液 溶液 |
| 实验现象 | 无白色沉淀生成 | 有白色沉淀生成 | 有白色沉淀生成 |

(4)C装置中覆盖食用油的目的是
(5)pH-t图中,曲线①呈缓慢下降趋势,这是因为
(6)曲线②出现骤降,这是因为
您最近一年使用:0次
8 . 某小组欲研究烷烃的某些性质设计下图实验装置。回答下列问题:
Ⅰ.烷烃可以发生取代反应。
向下图的B中通入一定量的氯气和甲烷气体,混合均匀后通入C中硬质玻璃管中,夹紧C两端弹簧夹,用强光照射硬质玻璃管。

(1)将实验室制得的 先通过饱和食盐水的目的是
先通过饱和食盐水的目的是_______ 。
(2)写出装置C中 与
与 反应生成氯仿的化学方程式
反应生成氯仿的化学方程式_______ 。
(3)一段时间后,C中玻璃管内的实验现象_______ 、_______ 。
(4)若2 mol 与
与 发生取代反应,测得生成4种有机取代产物的物质的量相等,则消耗的氯气的物质的量是
发生取代反应,测得生成4种有机取代产物的物质的量相等,则消耗的氯气的物质的量是_______ mol。
(5)某丁烷与氯气发生反应的产物之一为 ,则分子式为
,则分子式为 的同分异构体有
的同分异构体有_______ 种。
Ⅱ.烷烃可以发生氧化反应。
将一定量的某烷烃在足量氧气中充分燃烧,并使产生的气体全部通入下图装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收)。

(6)试写出该烷烃分子式为_______ 。
Ⅰ.烷烃可以发生取代反应。
向下图的B中通入一定量的氯气和甲烷气体,混合均匀后通入C中硬质玻璃管中,夹紧C两端弹簧夹,用强光照射硬质玻璃管。

(1)将实验室制得的
 先通过饱和食盐水的目的是
先通过饱和食盐水的目的是(2)写出装置C中
 与
与 反应生成氯仿的化学方程式
反应生成氯仿的化学方程式(3)一段时间后,C中玻璃管内的实验现象
(4)若2 mol
 与
与 发生取代反应,测得生成4种有机取代产物的物质的量相等,则消耗的氯气的物质的量是
发生取代反应,测得生成4种有机取代产物的物质的量相等,则消耗的氯气的物质的量是(5)某丁烷与氯气发生反应的产物之一为
 ,则分子式为
,则分子式为 的同分异构体有
的同分异构体有Ⅱ.烷烃可以发生氧化反应。
将一定量的某烷烃在足量氧气中充分燃烧,并使产生的气体全部通入下图装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收)。

| 实验前 | 实验后 | |
| 实验前实验后(干燥剂+U形管)的质量 | 101.1g | 102.9g |
| (石灰水+广口瓶)的质量 | 312.0g | 315.3g |
您最近一年使用:0次
2023-05-23更新
|
293次组卷
|
2卷引用:江西省龙南中学2022-2023学年高一下学期6月期末考试化学试题
名校
解题方法
9 . 人类的农业生产离不开氮肥,几乎所有的氮肥都以氨为原料,某化学兴趣小组利用图1装置制备氨气,图2装置探究其相关性质。
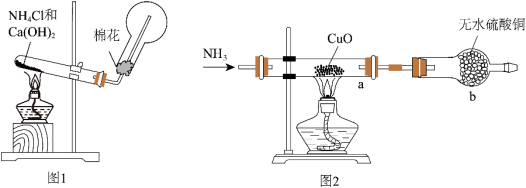
I.实验室制取氨气。
(1)图1装置中生成NH3的化学方程式为______ 。检验圆底烧瓶中已收集满氨气的方法是______ 。
II.探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。
(2)无水硫酸铜的作用是______ ;仪器b的名称为______ ;有同学认为需要在无水硫酸铜的后面再接一个装有CaCl2固体的球形干燥管,这样做的目的是______ 。
(3)实验中观察到a中CuO粉末变红,b中无水硫酸铜变蓝,并收集到一种单质气体。则该反应的化学方程式为______ 。
(4)若a中消耗标准状况下3.36L的氨气,理论得到铜的质量为______ g。

I.实验室制取氨气。
(1)图1装置中生成NH3的化学方程式为
II.探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。
(2)无水硫酸铜的作用是
(3)实验中观察到a中CuO粉末变红,b中无水硫酸铜变蓝,并收集到一种单质气体。则该反应的化学方程式为
(4)若a中消耗标准状况下3.36L的氨气,理论得到铜的质量为
您最近一年使用:0次
2023-05-11更新
|
504次组卷
|
2卷引用:江西省全南中学2022-2023学年高一下学期教学质量验收化学试题
名校
解题方法
10 . 三硫代碳酸钠(Na2CS3)在农业上用作杀菌剂和杀线虫剂,在工业上用于处理废水中的重金属离子。某化学兴趣小组对Na2CS3的一些性质进行了探究性实验。
实验1.探究Na2CS3的性质:
(1)H2CS3是___________ (填“强”或“弱”)酸。
(2)已知步骤③中反应的氧化产物是 ,则每生成1 mol
,则每生成1 mol  ,转移
,转移___________ mol 电子。
(3)某同学取步骤③反应后所得溶液于试管中,滴加足量盐酸和氯化钡溶液,他认为通过测定产生的白色沉淀的质量即可求出实验中所用的Na2CS3的质量,你是否同意他的观点并说明理由:___________ 。
实验II.测定Na2CS3溶液的浓度:
按如图所示装置进行实验:将50. 0 mL Na2CS3溶液置于三颈烧瓶中,打开仪器M的活塞,滴入足量2.0 mol· L-1的稀H2SO4,关闭活塞。
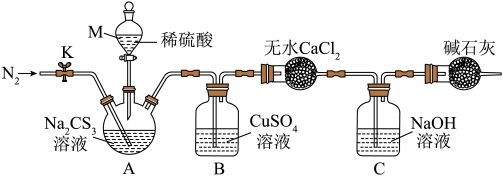
已知: +2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)
+2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)
(4)仪器M的名称是___________ ;反应开始前需要先通入一段时间N2,其作用为___________ 。
(5)B中发生反应的离子方程式为___________ 。
(6)为了计算三硫代碳酸钠溶液的浓度,可通过测定B中生成沉淀的质量来计算。称量B中沉淀质量之前需要进行的实验操作是___________ 、干燥, 若B中生成沉淀的质量为8.4 g,则Na2CS3溶液的物质的量浓度是___________ mol·L-1。
实验1.探究Na2CS3的性质:
| 步骤 | 操作及现象 |
| ① | 取少量Na2CS3固体溶于蒸馏水中,配制成溶液并分成两等份 |
| ② | 向其中一份溶液中滴加几滴酚酞试剂,溶液变成红色 |
| ③ | 向另一份溶液中滴加用硫酸酸化的KMnO4溶液,紫色褪去 |
(2)已知步骤③中反应的氧化产物是
 ,则每生成1 mol
,则每生成1 mol  ,转移
,转移(3)某同学取步骤③反应后所得溶液于试管中,滴加足量盐酸和氯化钡溶液,他认为通过测定产生的白色沉淀的质量即可求出实验中所用的Na2CS3的质量,你是否同意他的观点并说明理由:
实验II.测定Na2CS3溶液的浓度:
按如图所示装置进行实验:将50. 0 mL Na2CS3溶液置于三颈烧瓶中,打开仪器M的活塞,滴入足量2.0 mol· L-1的稀H2SO4,关闭活塞。

已知:
 +2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)
+2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)(4)仪器M的名称是
(5)B中发生反应的离子方程式为
(6)为了计算三硫代碳酸钠溶液的浓度,可通过测定B中生成沉淀的质量来计算。称量B中沉淀质量之前需要进行的实验操作是
您最近一年使用:0次
2023-05-04更新
|
344次组卷
|
3卷引用:江西省赣州市2023届高三下学期4月联考理科综合化学试题




