1 . 某同学设计了如图装置(夹持装置已略去)用于制取 ,并验证
,并验证 的部分性质,回答下列问题:
的部分性质,回答下列问题:
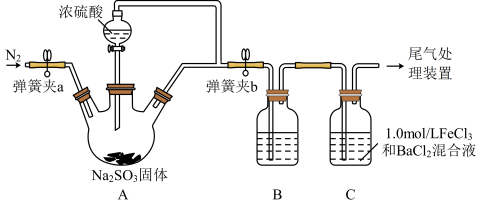
(1)装置A中用于添加浓硫酸的仪器名称为_______ 。
(2)A中发生反应的化学方程式为_______ 。浓硫酸表现出来的性质是_______ 。
(3)某同学为了检验装置中A、B两部分的气密性,进行的操作是关闭弹簧夹a、打开弹簧夹b,用酒精灯在三口烧瓶下微热,观察到B中长导管口有明显气泡现象,他判断气密性良好。你认为该操作是否合理_______ (填“合理”或“不合理”)。
(4)实验前要向装置中鼓入 ,目的是
,目的是_______ 。
(5)为了验证 是酸性氧化物,B中可选用的试剂是_______(填字母)。
是酸性氧化物,B中可选用的试剂是_______(填字母)。
(6)装置C中可观察到白色沉淀现象,由此可验证 具有
具有_______ 性,相关反应的总的离子方程式为_______ 。
 ,并验证
,并验证 的部分性质,回答下列问题:
的部分性质,回答下列问题:
(1)装置A中用于添加浓硫酸的仪器名称为
(2)A中发生反应的化学方程式为
(3)某同学为了检验装置中A、B两部分的气密性,进行的操作是关闭弹簧夹a、打开弹簧夹b,用酒精灯在三口烧瓶下微热,观察到B中长导管口有明显气泡现象,他判断气密性良好。你认为该操作是否合理
(4)实验前要向装置中鼓入
 ,目的是
,目的是(5)为了验证
 是酸性氧化物,B中可选用的试剂是_______(填字母)。
是酸性氧化物,B中可选用的试剂是_______(填字母)。| A.无色酚酞溶液 | B.蓝色石蕊试液 | C.红色品红溶液 | D. 淀粉溶液 淀粉溶液 |
 具有
具有
您最近一年使用:0次
2023-04-20更新
|
254次组卷
|
2卷引用:江西省抚州市七校2022-2023学年高一下学期期中考试化学试题
名校
解题方法
2 . 如图所示是 的两个性质探究实验,下列有关说法中正确的是
的两个性质探究实验,下列有关说法中正确的是
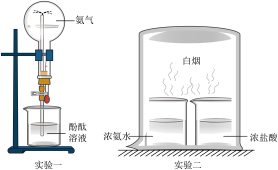
 的两个性质探究实验,下列有关说法中正确的是
的两个性质探究实验,下列有关说法中正确的是
| A.两个实验均只表现氨气的化学性质 | B.两个实验均表现了 易挥发的性质 易挥发的性质 |
C.两个实验均可说明 是碱性气体 是碱性气体 | D.两个实验均可说明 是还原性气体 是还原性气体 |
您最近一年使用:0次
2023-04-20更新
|
178次组卷
|
3卷引用:江西省抚州市七校2022-2023学年高一下学期期中考试化学试题
江西省抚州市七校2022-2023学年高一下学期期中考试化学试题江西省南丰县第一中学 黎川一中 宜黄一中 南城二中 金溪一中 广昌一中 乐安县实验学校2022-2023学年高一下学期期中联考化学试卷 (已下线)第17讲 氨的转化与生成-【暑假自学课】2023年新高一化学暑假精品课(鲁科版2019必修第一册)
名校
3 . 利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:

根据设计要求回答:
(1)盛浓盐酸的仪器名称是_______ ;
(2)A装置中发生反应的离子方程式是_______ ;
(3)B装置有三种功能:①_______ ,②显示气流速度,③均匀混合气体;
(4)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式_______ ;
(5)D装置的石棉浸有KI—淀粉溶液,其作用是_______ ,反应现象是_______ ;
(6)E装置除生成盐酸外,还最多可能含有三种液态有机物,从E中分离出盐酸的操作名称为_______ 。

根据设计要求回答:
(1)盛浓盐酸的仪器名称是
(2)A装置中发生反应的离子方程式是
(3)B装置有三种功能:①
(4)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式
(5)D装置的石棉浸有KI—淀粉溶液,其作用是
(6)E装置除生成盐酸外,还最多可能含有三种液态有机物,从E中分离出盐酸的操作名称为
您最近一年使用:0次
2023-04-18更新
|
746次组卷
|
4卷引用:江西省南昌市铁路第一中学2022-2023学年高一下学期5月月考化学试题
名校
4 . I.某实验小组利用以下装置制取氨气并探究氨气的性质:

(1)装置A中发生反应的化学方程式为______ 。
(2)装置B中的干燥剂是______ (填名称)。
(3)装置C中的现象是______ 。
(4)实验进行一段时间后,挤压装置D中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是____ ,发生反应的化学方程式为______ 。
(5)为防止过量氨气外逸,需要在上述装置的末端增加一个尾气吸收装置,应选用的装置是_____ (填“E”或“F”)。
II.现有足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体2.24L(标准状况),这些气体与一定体积O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4 mol∙L−1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是50mL。
(6)参加反应的硝酸是_____ mol;标准状况下混合气体中含NO2体积为_____ L。

(1)装置A中发生反应的化学方程式为
(2)装置B中的干燥剂是
(3)装置C中的现象是
(4)实验进行一段时间后,挤压装置D中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是
(5)为防止过量氨气外逸,需要在上述装置的末端增加一个尾气吸收装置,应选用的装置是
II.现有足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体2.24L(标准状况),这些气体与一定体积O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4 mol∙L−1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是50mL。
(6)参加反应的硝酸是
您最近一年使用:0次
2023-04-14更新
|
195次组卷
|
2卷引用:江西省龙南中学2022-2023学年高一下学期4月期中考试化学试题
名校
解题方法
5 . 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按如图连接好装置进行实验。______ 。
②将下列实验操作步骤正确排序______ (填标号);重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热 b.熄灭酒精灯
c.关闭K1和K2 d.打开K1和K2,缓缓通入N2
e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=______ (列式表示)。
(2)为探究硫酸亚铁的分解产物,将(1)中已恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后生成两种硫的化合物,反应管中残留固体为红色粉末。_____ 、_____ (填标号)。C、D中有气泡冒出,并可观察到的现象分别为_____ ,_____ 。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_____ 。
(1)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按如图连接好装置进行实验。
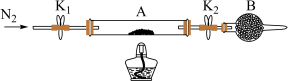
②将下列实验操作步骤正确排序
a.点燃酒精灯,加热 b.熄灭酒精灯
c.关闭K1和K2 d.打开K1和K2,缓缓通入N2
e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=
(2)为探究硫酸亚铁的分解产物,将(1)中已恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后生成两种硫的化合物,反应管中残留固体为红色粉末。

a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式
您最近一年使用:0次
2023-04-10更新
|
391次组卷
|
3卷引用:江西省乐安县第二中学2022-2023学年高一下学期5月期中考试化学试题
解题方法
6 . 84消毒液是一种常见的含氯消毒剂。如图为某品牌84消毒液的说明书中的部分内容。
(1)常温,将氯气通入NaOH溶液中可制得84消毒液的主要成分。写出离子方程式:_______ 。
(2)某同学研究84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有 、
、 、
、 ;相同浓度时,
;相同浓度时, 的氧化性强于
的氧化性强于 ;ORP是反映水溶液中所有物质表现出来的氧化—还原性,ORP值越大,氧化性越强。
;ORP是反映水溶液中所有物质表现出来的氧化—还原性,ORP值越大,氧化性越强。
I.向2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
II.向2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
III.测得84消毒液在不同温度时ORP随时间的变化曲线如下。
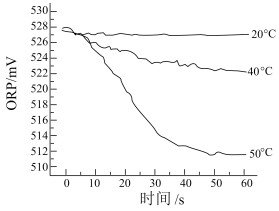
①已知白醋显酸性,不具有漂白性。实验I、II现象不同的原因是_______ 。
②由实验III可得出的结论是_______ 。ORP值不同的原因可能是_______ 。
(3)针对不同物品的消毒,84消毒液需要稀释到不同的浓度来使用。取含次氯酸钠14.9g/L的84消毒液1mL,加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为_______  。
。
(4)2016年巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是 将
将 氧化产生的
氧化产生的 促进藻类快速生长。写出该反应的化学方程式:
促进藻类快速生长。写出该反应的化学方程式:_______ 。
| 产品特点 本品是以次氯酸钠为主要成分的液体消毒剂。可杀灭肠道致病菌、化脓性球菌、致病性酵母菌,并能灭活病毒。 注意事项 1.本品易使有色衣脱色,禁止用于丝、毛、麻织物的消毒。 2.不得将本品与酸性产品(如洁厕类清洁产品)同时使用。 3.置于避光、阴凉处保存。 4.需稀释后使用,勿口服。 |
(1)常温,将氯气通入NaOH溶液中可制得84消毒液的主要成分。写出离子方程式:
(2)某同学研究84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有
 、
、 、
、 ;相同浓度时,
;相同浓度时, 的氧化性强于
的氧化性强于 ;ORP是反映水溶液中所有物质表现出来的氧化—还原性,ORP值越大,氧化性越强。
;ORP是反映水溶液中所有物质表现出来的氧化—还原性,ORP值越大,氧化性越强。I.向2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
II.向2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
III.测得84消毒液在不同温度时ORP随时间的变化曲线如下。

①已知白醋显酸性,不具有漂白性。实验I、II现象不同的原因是
②由实验III可得出的结论是
(3)针对不同物品的消毒,84消毒液需要稀释到不同的浓度来使用。取含次氯酸钠14.9g/L的84消毒液1mL,加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为
 。
。(4)2016年巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是
 将
将 氧化产生的
氧化产生的 促进藻类快速生长。写出该反应的化学方程式:
促进藻类快速生长。写出该反应的化学方程式:
您最近一年使用:0次
名校
7 . 实验小组研究铜与硝酸的反应,实验如下(加持装置和尾气处理装置略)。
(1)实验I、II中的红棕色气体均是 。
。
①实验I产生 的化学方程式是
的化学方程式是_______ 。
②实验II产生 的化学方程式是
的化学方程式是_______ 。
(2)对实验I产生 ,实验II产生NO的原因提出解释。
,实验II产生NO的原因提出解释。
①硝酸浓度越稀,溶液中单位体积内的 数目越少。被还原时,每个
数目越少。被还原时,每个 从铜片处获得较多电子的机会越
从铜片处获得较多电子的机会越_______ (填“大”或“小”),因此越易被还原为较低价态的含氮物质。
②浓硝酸具有较强的_______ 性,可将NO转化为 。
。
(3)对实验I所得溶液呈绿色,而实验II所得溶液呈蓝色的原因提出猜想。查阅资料:
i. 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;
ii.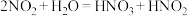 。
。 是弱酸,不稳定。
是弱酸,不稳定。
猜想一: 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色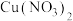 溶液混合而呈现绿色。
溶液混合而呈现绿色。
猜想二: 电离出的
电离出的 与
与 结合为
结合为 绿色)。
绿色)。
①向浓硝酸中通入 ,现象是
,现象是_______ ,滴加少量蓝色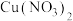 溶液后呈绿色,证实猜想一合理。
溶液后呈绿色,证实猜想一合理。
②研究猜想二是否为实验I所得溶液呈绿色的主要原因,实验如下。
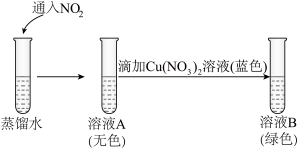
a.能说明溶液A中含有 的现象是
的现象是_______ 。
b.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想二不是实验I所得溶液呈绿色的主要原因,说明理由:_______ 。
(4) 因外观和食盐相似,又有咸味,容易使人误食中毒。已知
因外观和食盐相似,又有咸味,容易使人误食中毒。已知 能发生如下反应:
能发生如下反应: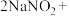
 ,根据上述反应,选择生活中常见的物质和有关试剂进行实验,以鉴别
,根据上述反应,选择生活中常见的物质和有关试剂进行实验,以鉴别 和NaCl固体。需选用的物质是
和NaCl固体。需选用的物质是_______ (填序号)。
①水 ②淀粉碘化钾试纸 ③淀粉 ④白酒 ⑤白醋
| 装置 | 编号 | 试剂a | 现象 |
 | I | 4mL浓硝酸(过量) | 铜片完全溶解,溶液变绿,出现大量红棕色气体 |
| II | 4mL稀硝酸(过量) | 铜片完全溶解,溶液变蓝,液面上方气体呈浅红棕色 |
 。
。①实验I产生
 的化学方程式是
的化学方程式是②实验II产生
 的化学方程式是
的化学方程式是(2)对实验I产生
 ,实验II产生NO的原因提出解释。
,实验II产生NO的原因提出解释。①硝酸浓度越稀,溶液中单位体积内的
 数目越少。被还原时,每个
数目越少。被还原时,每个 从铜片处获得较多电子的机会越
从铜片处获得较多电子的机会越②浓硝酸具有较强的
 。
。(3)对实验I所得溶液呈绿色,而实验II所得溶液呈蓝色的原因提出猜想。查阅资料:
i.
 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;ii.
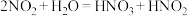 。
。 是弱酸,不稳定。
是弱酸,不稳定。猜想一:
 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色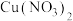 溶液混合而呈现绿色。
溶液混合而呈现绿色。猜想二:
 电离出的
电离出的 与
与 结合为
结合为 绿色)。
绿色)。①向浓硝酸中通入
 ,现象是
,现象是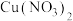 溶液后呈绿色,证实猜想一合理。
溶液后呈绿色,证实猜想一合理。②研究猜想二是否为实验I所得溶液呈绿色的主要原因,实验如下。

a.能说明溶液A中含有
 的现象是
的现象是b.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想二不是实验I所得溶液呈绿色的主要原因,说明理由:
(4)
 因外观和食盐相似,又有咸味,容易使人误食中毒。已知
因外观和食盐相似,又有咸味,容易使人误食中毒。已知 能发生如下反应:
能发生如下反应: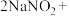
 ,根据上述反应,选择生活中常见的物质和有关试剂进行实验,以鉴别
,根据上述反应,选择生活中常见的物质和有关试剂进行实验,以鉴别 和NaCl固体。需选用的物质是
和NaCl固体。需选用的物质是①水 ②淀粉碘化钾试纸 ③淀粉 ④白酒 ⑤白醋
您最近一年使用:0次
名校
解题方法
8 . 实验室探究 和
和 溶液反应的原理,装置如图,实验中Y装置产生白色沉淀。下列说法错误的是
溶液反应的原理,装置如图,实验中Y装置产生白色沉淀。下列说法错误的是
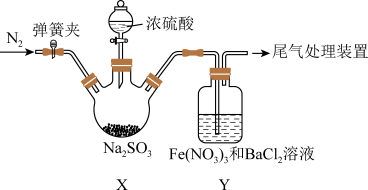
 和
和 溶液反应的原理,装置如图,实验中Y装置产生白色沉淀。下列说法错误的是
溶液反应的原理,装置如图,实验中Y装置产生白色沉淀。下列说法错误的是
A.滴加浓硫酸之前应进行的操作是打开弹簧夹,通入 一段时间 一段时间 |
B.Y中产生的白色沉淀是 |
| C.在X装置中浓硫酸体现氧化性和酸性 |
D.若将 换成氨水,Y中能产生白色沉淀 换成氨水,Y中能产生白色沉淀 |
您最近一年使用:0次
2023-03-17更新
|
392次组卷
|
4卷引用:江西省五校2022-2023学年高一下学期直升班联考化学试题
名校
解题方法
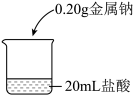
9 . 某小组研究钠与不同浓度盐酸的反应。
【实验操作】
取5块质量均为0.20 g且形状相似的金属钠,分别放入20 mL不同浓度的盐酸中,如图。
【实验现象与数据】
经检验,⑤中出现的白色浑浊中的固体为NaCl。
【问题与讨论】
(1)补全钠与盐酸反应的化学方程式:
_______ :
(2)小组得出结论:钠的密度小于盐酸的密度,依据的实验现象是_______ 。
(3)在上述实验中,盐酸浓度越大,钠完全消失所用的时间_______ 。
(4)在上述实验中,钠完全消失所用的时间不同。原因可能是:盐酸浓度越大,化学反应越快,但是生成的氯化钠改变了盐酸与钠的_______ ,该因素影响了化学反应速率,进而影响了钠完全消失所用的时间。
【实验操作】
取5块质量均为0.20 g且形状相似的金属钠,分别放入20 mL不同浓度的盐酸中,如图。

【实验现象与数据】
| 编号 | ① | ② | ③ | ④ | ⑤ |
| c(HCl)/(mol·L-1) | 0.5 | 1.0 | 1.5 | 3.0 | 6.0 |
| 主要现象 | 钠浮在液面上,四处游动 | ||||
| 钠燃烧。溶液澄清 | 钠短时燃烧。溶液澄清 | 钠的表面有火花。溶液澄清 | 钠的表面。有少量火花。溶液澄清 | 钠的周围出现白色浑浊,一段时间后变澄清 | |
| 钠完全消失所用的时间/s | 11 | 21 | 37 | 65 | 114 |
【问题与讨论】
(1)补全钠与盐酸反应的化学方程式:

(2)小组得出结论:钠的密度小于盐酸的密度,依据的实验现象是
(3)在上述实验中,盐酸浓度越大,钠完全消失所用的时间
(4)在上述实验中,钠完全消失所用的时间不同。原因可能是:盐酸浓度越大,化学反应越快,但是生成的氯化钠改变了盐酸与钠的
您最近一年使用:0次
2023-03-15更新
|
505次组卷
|
3卷引用:江西省抚州市宜黄县第一中学2023届高三一模考试化学试题
10 . 某实验兴趣小组用氯酸钾(KClO3)和浓盐酸制取氯气,为了制取并验证氯气的某些性质和证明在制备Cl2的过程中会有水蒸气和HCl挥发出来。某甲同学查阅资料知Cl2易溶于CCl4,HCl不溶于CCl4,于是设计如图装置(部分夹持仪器省略)进行实验。
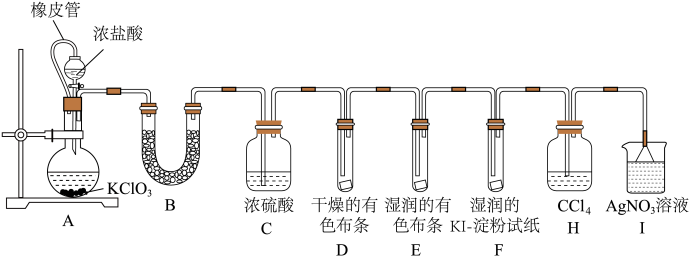
请按要求回答下列问题:
(1)装置A中发生反应的化学方程式为______ ,橡皮管的作用是______ 。
(2)证明混有水蒸气,装置B中的U形接管中所盛试剂为______ 。
(3)装置D、E的实验目的是______ 。
(4)装置F中湿润的KI-淀粉试纸变蓝色,反应的离子方程式为______ 。
(5)证明混有HCl的离子方程式:______ 。
(6)乙同学认为甲同学的实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在H和I两个装置之间再加一个装置瓶检验。你认为该装置瓶中可以放入______ 。

请按要求回答下列问题:
(1)装置A中发生反应的化学方程式为
(2)证明混有水蒸气,装置B中的U形接管中所盛试剂为
(3)装置D、E的实验目的是
(4)装置F中湿润的KI-淀粉试纸变蓝色,反应的离子方程式为
(5)证明混有HCl的离子方程式:
(6)乙同学认为甲同学的实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在H和I两个装置之间再加一个装置瓶检验。你认为该装置瓶中可以放入
您最近一年使用:0次
2023-03-01更新
|
231次组卷
|
3卷引用:江西省九江市修水县第一中学等六校2022-2023学年高一下学期2月第一次联考化学试卷



