名校
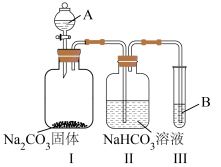
1 . 某小组同学在实验室制备、收集氯气,并进行氯水中相关物质的性质探究,回答下列问题。

(1)制备Cl2。装置Ⅰ中反应的离子 方程式是___________ 。
(2)除去Cl2中混有的HCl。装置Ⅱ中溶液a为饱和___________ 溶液。
(3)收集Cl2。装置Ⅲ中气体应该从集气瓶的___________ (选“m”或“n”)口进入。
(4)蘸有NaOH溶液的棉花上发生反应的离子 方程式是___________ 。
(5)氯水中相关物质的性质探究。
①若装置Ⅳ中试剂b为H2O,制得氯水。氯水呈黄绿色是由于其中含有___________ ;Cl2与H2O反应的化学方程式为___________ 。
②若装置Ⅳ中试剂b为CCl4,可制得Cl2的CCl4溶液(Cl2可溶于CCl4,且不与CCl4反应)。取稀盐酸、新制氯水、Cl2的CCl4溶液,分别滴在三张红色纸条上,可观察到___________ 现象,证明氯水中HClO具有漂白性作用。
③验证氯水中HClO光照分解的产物。将装置Ⅳ广口瓶中的氯水转移至三颈瓶内,将pH传感器、氯离子传感器、氧气传感器分别插入三颈瓶中(如图),用强光照射氯水,进行实验并采集数据,获得相关变化曲线。


若能够证明氯水中HClO在光照下发生了分解反应,则图中纵坐标可以表示的物理量是___________ (填字母)。(注:酸性溶液中,c(H+)越大,pH越小,溶液酸性越强。)
a.氯水的pH b.氢离子的浓度 c.氯离子的浓度 d.氧气的体积分数

(1)制备Cl2。装置Ⅰ中反应的
(2)除去Cl2中混有的HCl。装置Ⅱ中溶液a为饱和
(3)收集Cl2。装置Ⅲ中气体应该从集气瓶的
(4)蘸有NaOH溶液的棉花上发生反应的
(5)氯水中相关物质的性质探究。
①若装置Ⅳ中试剂b为H2O,制得氯水。氯水呈黄绿色是由于其中含有
②若装置Ⅳ中试剂b为CCl4,可制得Cl2的CCl4溶液(Cl2可溶于CCl4,且不与CCl4反应)。取稀盐酸、新制氯水、Cl2的CCl4溶液,分别滴在三张红色纸条上,可观察到
③验证氯水中HClO光照分解的产物。将装置Ⅳ广口瓶中的氯水转移至三颈瓶内,将pH传感器、氯离子传感器、氧气传感器分别插入三颈瓶中(如图),用强光照射氯水,进行实验并采集数据,获得相关变化曲线。


若能够证明氯水中HClO在光照下发生了分解反应,则图中纵坐标可以表示的物理量是
a.氯水的pH b.氢离子的浓度 c.氯离子的浓度 d.氧气的体积分数
您最近一年使用:0次
2 . 某小组探究AgNO3溶液对氯水漂白性的影响,装置如下图所示。
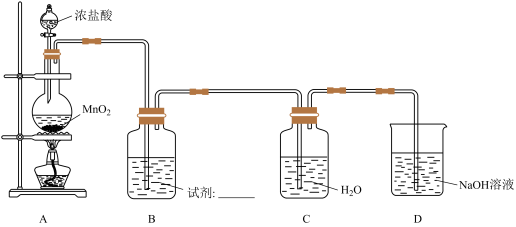
(1)A中反应的化学方程式是________ 。
(2)B中试剂是________ 。
(3)用化学方程式表示D中NaOH溶液的作用___________ 。
(4)取C中氯水,进行实验:向溶液a中加入1mL氯水。
资料:品红是一种有机化合物,水溶液呈红色。
Ⅱ中品红褪色慢,推测可能发生HClO+AgNO3=AgClO+HNO3,导致Ⅱ中HClO减少。分析沉淀中含AgClO,探究如下:将沉淀滤出、洗涤。向沉淀中加入盐酸,产生黄绿色气体。
①说明AgClO具有______ 性。
②产生黄绿色气体的化学方程式是________ 。
③实验发现,沉淀经几次洗涤后,加入盐酸,不再产生黄绿色气体。
(5)Ⅱ中溶液仍具有漂白性,可能是所加AgNO3溶液不足量。
①取Ⅱ中上层清液,_________ ,证实所加AgNO3溶液过量。
②Ⅱ中溶液仍具有漂白性的原因是__________ 。

(1)A中反应的化学方程式是
(2)B中试剂是
(3)用化学方程式表示D中NaOH溶液的作用
(4)取C中氯水,进行实验:向溶液a中加入1mL氯水。
| 序号 | 溶液a | 现象 |
| Ⅰ | 1滴品红+1mLH2O | 几秒后品红褪色 |
| Ⅱ | 1滴品红+1mLAgNO3溶液 | 几分钟后品红褪色,产生白色沉淀 |
Ⅱ中品红褪色慢,推测可能发生HClO+AgNO3=AgClO+HNO3,导致Ⅱ中HClO减少。分析沉淀中含AgClO,探究如下:将沉淀滤出、洗涤。向沉淀中加入盐酸,产生黄绿色气体。
①说明AgClO具有
②产生黄绿色气体的化学方程式是
③实验发现,沉淀经几次洗涤后,加入盐酸,不再产生黄绿色气体。
(5)Ⅱ中溶液仍具有漂白性,可能是所加AgNO3溶液不足量。
①取Ⅱ中上层清液,
②Ⅱ中溶液仍具有漂白性的原因是
您最近一年使用:0次
名校
解题方法
3 . 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,并探究NaClO的性质。
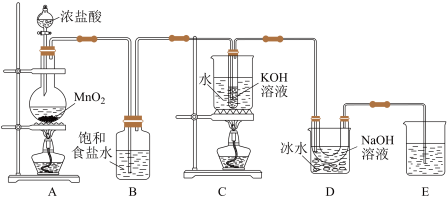
回答下列问题:
(1)A中反应的化学方程式是___________ 。在该反应中浓盐酸表现的性质是___________ (填序号)。
a.只有还原性 b.还原性和酸性 c.只有氧化性 d.氧化性和酸性
(2)B中所盛试剂为___________ 。
(3)C中反应的离子方程式为:___________
___________Cl2+___________OH- ___________
___________ +___________Cl-+___________
+___________Cl-+___________
(4)推测D中采用冰水浴冷却的目的是___________ 。
(5)探究NaClO的性质。
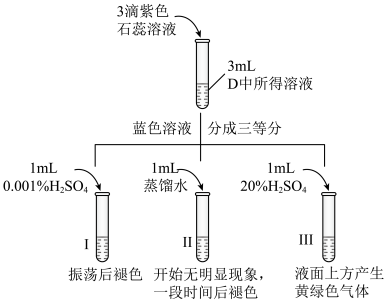
①滴入石蕊溶液,D中所得溶液呈蓝色,说明D中溶液呈___________ 性(酸、碱)。
②Ⅰ中溶液褪色的原因是因为反应生成了___________ (写物质的化学式)。
(6)通过上述实验可知,影响氧化还原反应的因素有___________ 。

回答下列问题:
(1)A中反应的化学方程式是
a.只有还原性 b.还原性和酸性 c.只有氧化性 d.氧化性和酸性
(2)B中所盛试剂为
(3)C中反应的离子方程式为:
___________Cl2+___________OH-
 ___________
___________ +___________Cl-+___________
+___________Cl-+___________(4)推测D中采用冰水浴冷却的目的是
(5)探究NaClO的性质。

①滴入石蕊溶液,D中所得溶液呈蓝色,说明D中溶液呈
②Ⅰ中溶液褪色的原因是因为反应生成了
(6)通过上述实验可知,影响氧化还原反应的因素有
您最近一年使用:0次
4 . 某同学探究 与水反应并定量测定过氧化钠的纯度。
与水反应并定量测定过氧化钠的纯度。
I.探究 与水反应
与水反应
取0.02molNa2O2粉末加入到40mL水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。
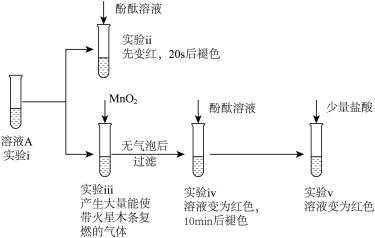
(1)由实验_____ 中现象可知,Na2O2与H2O反应有H2O2生成;
(2)由实验ⅱ、ⅲ、ⅳ可知,实验ⅱ中溶液褪色与_____ 有关;
(3)由实验ⅳ、ⅴ可知,实验ⅳ中溶液褪色的原因是_____ 。
II.测定 试样的纯度,实验装置如下图。
试样的纯度,实验装置如下图。
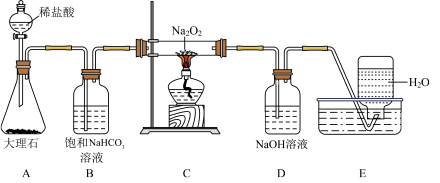
(4)A中反应的离子方程式为_____ ;装置D的作用是_____ 。
(5)C装置发生的反应的化学方程式为_____ 。
(6)若开始测得样品质量为2.0g,反应结束后,在E集气瓶中收集得到气体体积 (该状况下22.4L氧气的质量为32g),则该
(该状况下22.4L氧气的质量为32g),则该 试样的纯度为
试样的纯度为_____ 。
 与水反应并定量测定过氧化钠的纯度。
与水反应并定量测定过氧化钠的纯度。I.探究
 与水反应
与水反应取0.02molNa2O2粉末加入到40mL水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。

(1)由实验
(2)由实验ⅱ、ⅲ、ⅳ可知,实验ⅱ中溶液褪色与
(3)由实验ⅳ、ⅴ可知,实验ⅳ中溶液褪色的原因是
II.测定
 试样的纯度,实验装置如下图。
试样的纯度,实验装置如下图。
(4)A中反应的离子方程式为
(5)C装置发生的反应的化学方程式为
(6)若开始测得样品质量为2.0g,反应结束后,在E集气瓶中收集得到气体体积
 (该状况下22.4L氧气的质量为32g),则该
(该状况下22.4L氧气的质量为32g),则该 试样的纯度为
试样的纯度为
您最近一年使用:0次
名校
5 . 某化学小组对卤代烷在不同条件下发生反应的情况进行实验探究。
[实验1]取一支试管,滴入15滴溴乙烷,加入1mL5%的NaOH溶液,振荡后放入盛有热水的烧杯中水浴加热。片刻后,取分层后的上层水溶液,滴入另一支盛有___________的试管中,再加入2滴AgNO3溶液。溶液出现浑浊。
[实验2]向圆底烧瓶中加入2.0gNaOH和15mL无水乙醇,搅拌,再加入5mL1-溴丁烷和几片碎瓷片,微热(液体沸腾后,移开酒精灯),产生的气体通过盛有___________试管A后,再通入盛有酸性KMnO4溶液的B试管。紫红色逐渐褪去。
请回答:
(1)补全试剂:实验1中___________ ,实验2中___________ 。溴乙烷发生水解反应的化学方程式是___________ 。
(2)已知:溴乙烷的沸点:38.4℃,1-溴丁烷的沸点:101.6℃
①由微粒间作用解释溴乙烷和1-溴丁烷沸点差异的原因是___________ 。
②有同学用溴乙烷代替1-溴丁烷进行实验2,发现酸性KMnO4溶液不褪色。由已知沸点差异分析实验失败的可能原因:___________ 。
(3)对比实验1和实验2所用试剂,有利于卤代烃消去反应发生的外部条件,除了弱极性溶剂外,还需要相对较___________ (填“高”或“低”)的温度。
(4)实验2检验出反应产物有丁烯,仍不能说明该条件下没有发生取代反应。若进一步检验是否生成1-丁醇,可采用的如下方法是___________ (填序号)。
a.使反应混合物与金属钠反应
b.对产物进行质谱分析
c.对产物进行核磁共振氢谱分析
(5)研究表明,除了外部条件,卤代烷的自身结构特点也决定了反应的趋向。伯卤代烷(R-CH2-X)优先发生取代反应,叔卤代烷(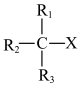 )优先发生消去反应。写出2-甲基-2-溴丙烷发生消去反应的化学方程式:
)优先发生消去反应。写出2-甲基-2-溴丙烷发生消去反应的化学方程式:___________ 。
[实验1]取一支试管,滴入15滴溴乙烷,加入1mL5%的NaOH溶液,振荡后放入盛有热水的烧杯中水浴加热。片刻后,取分层后的上层水溶液,滴入另一支盛有___________的试管中,再加入2滴AgNO3溶液。溶液出现浑浊。
[实验2]向圆底烧瓶中加入2.0gNaOH和15mL无水乙醇,搅拌,再加入5mL1-溴丁烷和几片碎瓷片,微热(液体沸腾后,移开酒精灯),产生的气体通过盛有___________试管A后,再通入盛有酸性KMnO4溶液的B试管。紫红色逐渐褪去。
请回答:
(1)补全试剂:实验1中
(2)已知:溴乙烷的沸点:38.4℃,1-溴丁烷的沸点:101.6℃
①由微粒间作用解释溴乙烷和1-溴丁烷沸点差异的原因是
②有同学用溴乙烷代替1-溴丁烷进行实验2,发现酸性KMnO4溶液不褪色。由已知沸点差异分析实验失败的可能原因:
(3)对比实验1和实验2所用试剂,有利于卤代烃消去反应发生的外部条件,除了弱极性溶剂外,还需要相对较
(4)实验2检验出反应产物有丁烯,仍不能说明该条件下没有发生取代反应。若进一步检验是否生成1-丁醇,可采用的如下方法是
a.使反应混合物与金属钠反应
b.对产物进行质谱分析
c.对产物进行核磁共振氢谱分析
(5)研究表明,除了外部条件,卤代烷的自身结构特点也决定了反应的趋向。伯卤代烷(R-CH2-X)优先发生取代反应,叔卤代烷(
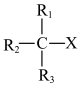 )优先发生消去反应。写出2-甲基-2-溴丙烷发生消去反应的化学方程式:
)优先发生消去反应。写出2-甲基-2-溴丙烷发生消去反应的化学方程式:
您最近一年使用:0次
6 . I.有机物种类繁多,性质多种多样。下列十种物质:①C2H5OH ②CH3CHO ③CH3COOH ④HOCH2CH2OH ⑤HOCH2(CHOH)4CHO⑥蛋白质 ⑦淀粉 ⑧油脂 ⑨酚醛树脂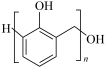 ⑩塑料
⑩塑料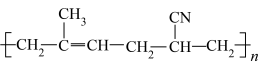
填写序号回答下列问题:
(1)①~③中,沸点最高的是___________ 。
(2)①~④中能发生缩合聚合反应的是___________ 。
(3)①~⑤中含有手性碳原子的是___________ 。
(4)属于天然高分子的是___________ 。
(5)⑨单体为___________ ;⑩单体为___________ 。
II.某同学为验证酸性:醋酸>碳酸>苯酚,经仔细考虑,设计如下实验装置,请回答下列问题:
(6)A处的试剂是___________ (填序号,下同),B处的试剂是___________ 。
①醋酸溶液 ②CH3COONa溶液 ③苯酚溶液 ④苯酚钠溶液
(7)装置II中饱和NaHCO3溶液的作用___________ 。
(8)能证明三种酸的酸性强弱的现象___________ 。
(9)写出装置Ⅲ中发生反应的离子方程式___________ 。
 ⑩塑料
⑩塑料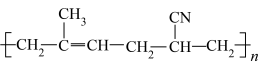
填写序号回答下列问题:
(1)①~③中,沸点最高的是
(2)①~④中能发生缩合聚合反应的是
(3)①~⑤中含有手性碳原子的是
(4)属于天然高分子的是
(5)⑨单体为
II.某同学为验证酸性:醋酸>碳酸>苯酚,经仔细考虑,设计如下实验装置,请回答下列问题:

(6)A处的试剂是
①醋酸溶液 ②CH3COONa溶液 ③苯酚溶液 ④苯酚钠溶液
(7)装置II中饱和NaHCO3溶液的作用
(8)能证明三种酸的酸性强弱的现象
(9)写出装置Ⅲ中发生反应的离子方程式
您最近一年使用:0次
名校
7 . 某同学进行如下实验:
已知:i.H2O2 H++HO
H++HO HO
HO
 H++O
H++O
ii.BaO2是一种白色难溶于水的固体
下列说法不合理的是
| 序号 | 实验① | 实验② | 实验③ | 实验④ | 实验⑤ |
| 方案 | 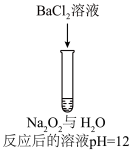 | 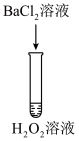 | 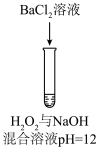 | 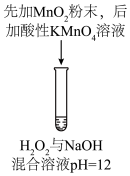 | 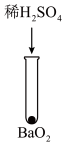 |
| 现象 | 出现白色沉淀 | 无明显现象 | 出现白色沉淀 | 产生大量气泡,高锰酸钾溶液不褪色 | 出现白色沉淀 |
 H++HO
H++HO HO
HO
 H++O
H++O
ii.BaO2是一种白色难溶于水的固体
下列说法不合理的是
| A.实验①和③生成白色沉淀的反应属于复分解反应 |
| B.实验③可证明H2O2溶液中存在电离平衡 |
| C.实验⑤的白色沉淀经检验为BaSO4,但不能证明溶解度BaO2>BaSO4 |
| D.可用BaCl2、MnO2、H2O检验长期放置的Na2O2中是否含有Na2CO3 |
您最近一年使用:0次
名校
解题方法
8 . 某课外活动小组设计了下列装置,验证二氧化碳跟过氧化钠反应时需要与水接触。

已知: 碱石灰是常见的干燥剂,可以吸收水和二氧化碳。
【装置分析】
(1)装置②中的试剂是___________ (填序号)。
a.饱和NaHCO3溶液 b.饱和Na2CO3溶液 c.浓H2SO4
(2)装置③中的试剂是___________ 。
【进行实验】
步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条
放在a处。
步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条
放在a处。
(3)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是___________ 。
(4)过氧化钠跟二氧化碳反应的化学方程式是___________ 。
【实验反思】
(5)有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠跟二氧化碳发生了化学反应。”其理由是___________ 。
(6)需要补充的实验操作是:取⑤中反应后的少量固体,___________ 。

已知: 碱石灰是常见的干燥剂,可以吸收水和二氧化碳。
【装置分析】
(1)装置②中的试剂是
a.饱和NaHCO3溶液 b.饱和Na2CO3溶液 c.浓H2SO4
(2)装置③中的试剂是
【进行实验】
步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条
放在a处。
步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条
放在a处。
(3)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是
(4)过氧化钠跟二氧化碳反应的化学方程式是
【实验反思】
(5)有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠跟二氧化碳发生了化学反应。”其理由是
(6)需要补充的实验操作是:取⑤中反应后的少量固体,
您最近一年使用:0次
名校
9 . 按下图进行实验,探究H2O2的分解反应。下列说法不正确的是
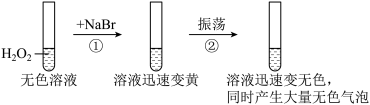

| A.1molH2O2发生分解反应时,转移电子的物质的量是2mol |
| B.NaBr中的Br-加快了H2O2分解速率 |
| C.双氧水既发生氧化反应,又反应了还原反应 |
| D.反应②的离子方程式是Br2+H2O2=2Br-+2H++O2↑ |
您最近一年使用:0次
名校
10 . 某实验小组同学依据资料深入探究Fe³+在水溶液中的行为。
资料:i.Fe³+在水溶液中以水合铁离子的形式存在,如[Fe(H2O)6]3+;[Fe(H2O)6] 3+发生如下水解反应:[Fe(H2O)6]3+(几乎无色)+nH2O [Fe(H2O)6-n(OH)n]3−n(黄色)+nH3O+(n=0~6)。
[Fe(H2O)6-n(OH)n]3−n(黄色)+nH3O+(n=0~6)。
ii.[FeCl4(H2O)2]-为黄色。
进行实验:【实验I】

【实验Ⅱ】分别用试管①、③中的试剂作为待测液,用色度计测定其透光率。透光率越小,溶液颜色越深;透光率越大,溶液颜色越浅。
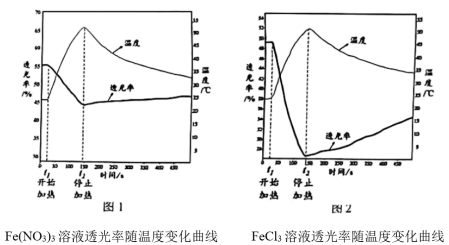
(1)实验1中,试管②溶液变为无色的原因是___________ 。
(2)实验I中,试管③溶液呈棕黄色与[FeCl4(H2O)2]-有关,支持此结论的实验现象是___________ 。
(3)由实验Ⅱ图1、2可知:加热时,溶液颜色___________ (填“变浅"、“变深”或“不变”)。
(4)由实验Ⅱ,可以得出如下结论:
[结论一]FeCl3溶液中存在可逆反应:[FeCl4(H2O)2]-+4H2O=[Fe(H2O)6]³++4Cl-得出此结论的理由是___________ 。
[结论二]结论一中反应的△H___________ (填“>0”或"<0")。
资料:i.Fe³+在水溶液中以水合铁离子的形式存在,如[Fe(H2O)6]3+;[Fe(H2O)6] 3+发生如下水解反应:[Fe(H2O)6]3+(几乎无色)+nH2O
 [Fe(H2O)6-n(OH)n]3−n(黄色)+nH3O+(n=0~6)。
[Fe(H2O)6-n(OH)n]3−n(黄色)+nH3O+(n=0~6)。ii.[FeCl4(H2O)2]-为黄色。
进行实验:【实验I】

【实验Ⅱ】分别用试管①、③中的试剂作为待测液,用色度计测定其透光率。透光率越小,溶液颜色越深;透光率越大,溶液颜色越浅。

(1)实验1中,试管②溶液变为无色的原因是
(2)实验I中,试管③溶液呈棕黄色与[FeCl4(H2O)2]-有关,支持此结论的实验现象是
(3)由实验Ⅱ图1、2可知:加热时,溶液颜色
(4)由实验Ⅱ,可以得出如下结论:
[结论一]FeCl3溶液中存在可逆反应:[FeCl4(H2O)2]-+4H2O=[Fe(H2O)6]³++4Cl-得出此结论的理由是
[结论二]结论一中反应的△H
您最近一年使用:0次



