名校
1 . 实验室用下图装置(夹持装置已略去)制备 ,并研究其性质。其中,a、b为湿润的红色石蕊试纸。
,并研究其性质。其中,a、b为湿润的红色石蕊试纸。
 ,并研究其性质。其中,a、b为湿润的红色石蕊试纸。
,并研究其性质。其中,a、b为湿润的红色石蕊试纸。 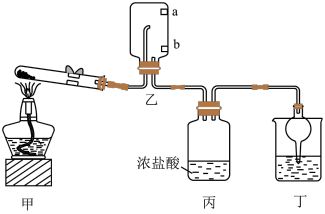
| A.装置乙中,a比b先变蓝 | B.装置丙中,产生大量白烟 |
| C.装置丁中,试剂只能是水 | D.装置丁具有防止倒吸的作用 |
您最近一年使用:0次
解题方法
2 . 兴趣小组按如下装置进行含硫物质的转化研究(夹持装置已略去,气密性已检验),将稀硫酸全部加入Ⅰ中的试管,关闭活塞。Ⅰ中试管内发生的反应是: ,下列说法正确的是
,下列说法正确的是
 ,下列说法正确的是
,下列说法正确的是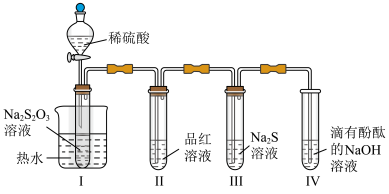
A.Ⅰ中试管内的反应,体现了 的氧化性 的氧化性 |
B.Ⅱ中试管内品红溶液褪色,体现了 的酸性 的酸性 |
C.Ⅲ中试管内中出现浑浊,反应过程中 发生了化学键的断裂 发生了化学键的断裂 |
D.Ⅳ中红色褪去体现了 的还原性 的还原性 |
您最近一年使用:0次
名校
3 . 某实验小组用收集到的氯气制得氯水并对氯水成分和性质进行研究,实验如下:
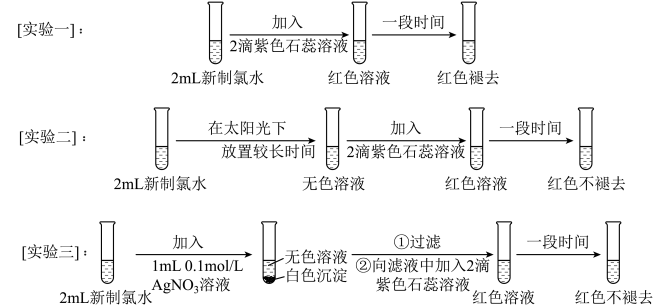
(1)实验一的现象表明,氯水具有酸性和___________ 性。
(2)氯气与水反应的化学方程式为___________ 。
(3)用化学用语说明实验二中“红色不褪去”的原因___________ 。
【实验四】
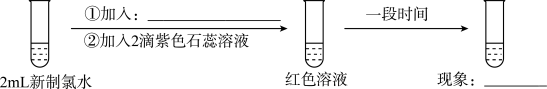
(4)实验四证明了实验三中“红色不褪去”不是因为氯水被稀释,补充所加试剂和现象___________ 。
进一步思考实验三中“红色不褪去”的原因。
(5)依据实验三的现象,猜测实验三中白色沉淀的成分可能是___________ ,写出生成该白色沉淀的化学方程式___________ 。

(1)实验一的现象表明,氯水具有酸性和
(2)氯气与水反应的化学方程式为
(3)用化学用语说明实验二中“红色不褪去”的原因
【实验四】

(4)实验四证明了实验三中“红色不褪去”不是因为氯水被稀释,补充所加试剂和现象
进一步思考实验三中“红色不褪去”的原因。
(5)依据实验三的现象,猜测实验三中白色沉淀的成分可能是
您最近一年使用:0次
名校
4 . 某课外小组探究二氧化碳与过氧化钠反应是否需要接触水,装置如下图。
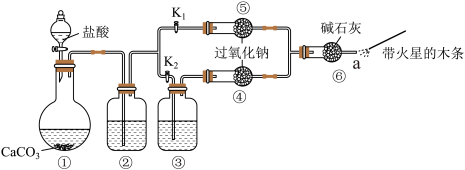
【装置分析】
(1)装置①中反应的离子方程式是___________ 。
(2)装置②中的试剂是___________ 。
(3)装置③中的试剂是___________ 。
【实验步骤】
步骤1:打开弹簧夹 。关闭
。关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
沙骤2:打开弹簧夹 ,关闭
,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
(4)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是___________ ,甲同学因此得出了结论:二氧化碳与过氧化钠反应需要接触水。
(5)过氧化钠跟二氧化碳反应的化学方程式是___________ 。
【实验反思】
(6)乙同学不同意甲同学的结论,其理由是___________ 。
(7)乙同学认为可补充一个实验、实验方案是:取⑤中反应后的少量固体,___________ 。

【装置分析】
(1)装置①中反应的离子方程式是
(2)装置②中的试剂是
(3)装置③中的试剂是
【实验步骤】
步骤1:打开弹簧夹
 。关闭
。关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。沙骤2:打开弹簧夹
 ,关闭
,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。(4)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是
(5)过氧化钠跟二氧化碳反应的化学方程式是
【实验反思】
(6)乙同学不同意甲同学的结论,其理由是
(7)乙同学认为可补充一个实验、实验方案是:取⑤中反应后的少量固体,
您最近一年使用:0次
5 . 某兴趣小组同学用图1所示装置,向一定体积的0.01mol/LBa(OH)2溶液中逐滴滴加0.2mol/LH2SO4溶液,不断搅拌并测定溶液导电能力的变化,实验测得混合溶液的导电能力随时间变化的曲线如图2所示。
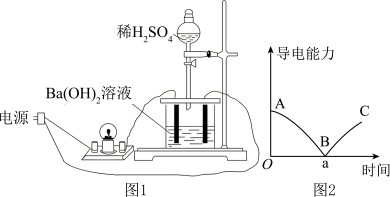
(1)用化学用语解释未滴加硫酸时,接通电源后灯泡变亮的原因:_______ ;
(2)实验过程中观察到的现象是:烧杯中_______ ,小灯泡_______ 。
(3)写出Ba(OH)2溶液与稀H2SO4反应的离子方程式_______ 。
(4)B点代表反应恰好完全,用Na2SO4溶液替代H2SO4溶液,重复上述实验进行对照,分析二者现象上的不同之处为_______ 。

(1)用化学用语解释未滴加硫酸时,接通电源后灯泡变亮的原因:
(2)实验过程中观察到的现象是:烧杯中
(3)写出Ba(OH)2溶液与稀H2SO4反应的离子方程式
(4)B点代表反应恰好完全,用Na2SO4溶液替代H2SO4溶液,重复上述实验进行对照,分析二者现象上的不同之处为
您最近一年使用:0次
名校
解题方法
6 . 某小组同学探究 固体受热分解的产物,利用下图装置进行实验。
固体受热分解的产物,利用下图装置进行实验。

已知: 熔点-72℃,沸点-10℃;
熔点-72℃,沸点-10℃; 熔点16.8℃,沸点44.8℃。
熔点16.8℃,沸点44.8℃。
下列关于 分解产物的判断及依据
分解产物的判断及依据不正确 的是
 固体受热分解的产物,利用下图装置进行实验。
固体受热分解的产物,利用下图装置进行实验。
| 实验过程 | 实验现象 | |
| Ⅰ | 通入一段时间 ,加热 ,加热 | A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
| Ⅱ | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
| Ⅲ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
| Ⅳ | 将Ⅲ所得溶液滴入D试管中 | 最终溶液变为浅绿色 |
 熔点-72℃,沸点-10℃;
熔点-72℃,沸点-10℃; 熔点16.8℃,沸点44.8℃。
熔点16.8℃,沸点44.8℃。下列关于
 分解产物的判断及依据
分解产物的判断及依据A.由实验ⅠA中与实验Ⅲ中现象推断产物中有 |
B.由实验ⅠB中白色沉淀推断产物中一定含 |
C.由实验Ⅱ中现象推断产物中有 |
D.除实验Ⅳ中现象外,仅由实验ⅠA中固体颜色变化也可推断产物中可能含 |
您最近一年使用:0次
名校
7 . 某小组研究 溶液与KI溶液的反应,实验记录如下:
溶液与KI溶液的反应,实验记录如下:
【资料】:ⅰ. 溶液呈碱性。
溶液呈碱性。
ⅱ. 在
在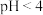 并加热的条件下极不稳定。
并加热的条件下极不稳定。
ⅲ.碘的化合物主要以 和
和 的形式存在。
的形式存在。
ⅳ.酸性条件下 不能氧化
不能氧化 ,可以氧化
,可以氧化 。
。
(1) 的电子式为:
的电子式为:_______ 。
(2)实验Ⅰ中溶液变为浅黄色的离子方程式是_______ 。
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
①提出假设a: 在碱性溶液中不能存在。
在碱性溶液中不能存在。
设计实验Ⅲ证实了假设a成立,补充实验Ⅲ的操作及现象:向_______ 溶液中加入少量滴有淀粉溶液的碘水。振荡,观察到_______ 。
②提出假设b: 可将
可将 氧化为
氧化为 。
。
进行实验也证实了假设b成立。
(4)检验实验Ⅱ所得溶液中的 :取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的
:取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的 。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在
。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在 。
。
①产生的黄绿色气体是_______ 。
②有同学认为此实验不能说明实验Ⅱ所得溶液中存在 ,理由是
,理由是_______ 。欲证明实验Ⅱ所得溶液中存在 ,改进的实验方案是
,改进的实验方案是_______ 。
③实验Ⅱ中反应的离子方程式是_______ 。
 溶液与KI溶液的反应,实验记录如下:
溶液与KI溶液的反应,实验记录如下:| 实验编号 | 实验操作 | 实验现象 | |
| Ⅰ |  | ⅰ.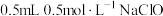 溶液 溶液ⅱ.几滴淀粉溶液、 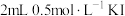 溶液 溶液 | ⅰ.溶液变为浅黄色 ⅱ.溶液变蓝 |
| Ⅱ |  | ⅰ. 溶液 溶液ⅱ.几滴淀粉溶液、 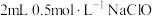 溶液 溶液 | ⅰ.溶液保持无色 ⅱ.溶液不变蓝,溶液的  |
 溶液呈碱性。
溶液呈碱性。ⅱ.
 在
在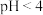 并加热的条件下极不稳定。
并加热的条件下极不稳定。ⅲ.碘的化合物主要以
 和
和 的形式存在。
的形式存在。ⅳ.酸性条件下
 不能氧化
不能氧化 ,可以氧化
,可以氧化 。
。(1)
 的电子式为:
的电子式为:(2)实验Ⅰ中溶液变为浅黄色的离子方程式是
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
①提出假设a:
 在碱性溶液中不能存在。
在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,补充实验Ⅲ的操作及现象:向
②提出假设b:
 可将
可将 氧化为
氧化为 。
。进行实验也证实了假设b成立。
(4)检验实验Ⅱ所得溶液中的
 :取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的
:取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的 。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在
。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在 。
。①产生的黄绿色气体是
②有同学认为此实验不能说明实验Ⅱ所得溶液中存在
 ,理由是
,理由是 ,改进的实验方案是
,改进的实验方案是③实验Ⅱ中反应的离子方程式是
您最近一年使用:0次
8 . 将足量SO2通入AgNO3溶液中,产生沉淀。探究反应原理及沉淀成分,装置如下(加热,夹持等装置略)。
资料:i.Ag2SO4微溶于水;Ag2SO3难溶于水。
ii.Ag2SO4、Ag2SO3均溶于氨水。

(1)①A中反应的化学方程式是___________ 。
②用NaOH溶液吸收尾气中的SO2产物是___________ 。
(2)探究沉淀成分。实验发现,沉淀的颜色与取样时间有关,对比实验记录如下:
推测白色沉淀(t1)可能为Ag2SO4、Ag2SO3或混合物。探究如下:

实验证实,白色沉淀(t1)中不含Ag2SO4,含Ag2SO3。
①试剂a是___________ 。
②产生白色沉淀Y的原因是___________ 。
(3)推测灰黑色沉淀(t2)含Ag。探究如下:
取灰黑色沉淀,加入氨水,部分沉淀溶解,过滤,洗涤。向洗净的沉淀中加入浓HNO3,证实沉淀含Ag。现象是___________ 。
(4)通过检测 探究产生Ag的原因。
探究产生Ag的原因。
①实验: (已排除O2的影响)
(已排除O2的影响)
t2时,C中H2SO3的作用是___________ 。(用化学方程式表示)
②t1时,C中产生白色沉淀的离子方程式是___________ 。
综上可知,化学反应的产物与反应速率和限度有关。
资料:i.Ag2SO4微溶于水;Ag2SO3难溶于水。
ii.Ag2SO4、Ag2SO3均溶于氨水。

(1)①A中反应的化学方程式是
②用NaOH溶液吸收尾气中的SO2产物是
(2)探究沉淀成分。实验发现,沉淀的颜色与取样时间有关,对比实验记录如下:
| 时间 | 反应开始时(t1) | 一段时间后(t2) | 较长时间后(t3) |
| 颜色 | 白色 | 灰黑色 | 灰黑色加深 |

实验证实,白色沉淀(t1)中不含Ag2SO4,含Ag2SO3。
①试剂a是
②产生白色沉淀Y的原因是
(3)推测灰黑色沉淀(t2)含Ag。探究如下:
取灰黑色沉淀,加入氨水,部分沉淀溶解,过滤,洗涤。向洗净的沉淀中加入浓HNO3,证实沉淀含Ag。现象是
(4)通过检测
 探究产生Ag的原因。
探究产生Ag的原因。①实验:
 (已排除O2的影响)
(已排除O2的影响)t2时,C中H2SO3的作用是
②t1时,C中产生白色沉淀的离子方程式是
综上可知,化学反应的产物与反应速率和限度有关。
您最近一年使用:0次
名校
解题方法
9 . 已知,在室温下1体积的水能溶解约40体积的 ,用试管收集
,用试管收集 后进行如图所示的实验,下列对实验现象的分析正确的是
后进行如图所示的实验,下列对实验现象的分析正确的是

 ,用试管收集
,用试管收集 后进行如图所示的实验,下列对实验现象的分析正确的是
后进行如图所示的实验,下列对实验现象的分析正确的是
A.试管内液面上升,证明 与 与 发生了反应 发生了反应 |
B.试管中剩余少量气体,是因为 的溶解已达饱和 的溶解已达饱和 |
C.取出试管中溶液,加入品红溶液,褪色,证明与品红溶液发生反应的是 |
| D.取出试管中溶液,在空气中放置一段时间后pH下降,原因是发生了氧化还原反应 |
您最近一年使用:0次
名校
10 . 某小组同学在实验室制备高铁酸钾(K2FeO4),并探究制备的适宜条件。制备K2FeO4的实验装置如下(夹持装置略)。

资料:K2FeO4为紫色固体,微溶于KOH溶液。
(1)装置A中产生Cl2的化学方程式是_______ (锰被还原为Mn2+)。
(2)研究试剂a对K2FeO4产率的影响,对比实验如下。
上述实验中,溶液总体积、FeCl3和Fe(NO3)3的物质的量、Cl2的通入量均相同。
①实验Ⅱ、Ⅲ产生K2FeO4,将方程式补充完整。
还原反应:_______ 。
氧化反应:_______ 。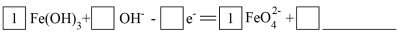
②对实验Ⅰ未产生K2FeO4而实验Ⅱ能产生的原因提出假设:实验Ⅱ溶液碱性较强,增强+3价铁的还原性。以下实验证实了该假设。
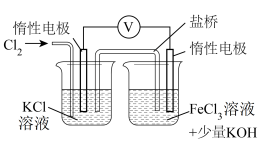
步骤1:通入Cl2,电压表示数为V1;
步骤2:向右侧烧杯中加入_______ (填试剂),电压表示数为V2(V2>V1)。
③反思装置B的作用:用饱和NaCl溶液除去HCl,用平衡移动原理解释_______ 。
④实验Ⅱ中K2FeO4的产率比实验Ⅲ低,试解释原因:_______ 。
(3)向实验Ⅱ所得紫色溶液中继续通入Cl2,观察到溶液紫色变浅。可能原因是通入Cl2后发生_______ (填离子方程式)而使溶液碱性减弱,进而导致K2FeO4分解。

资料:K2FeO4为紫色固体,微溶于KOH溶液。
(1)装置A中产生Cl2的化学方程式是
(2)研究试剂a对K2FeO4产率的影响,对比实验如下。
| 实验编号 | 试剂a | 实验现象 |
| Ⅰ | FeCl3和少量KOH | 无明显现象 |
| Ⅱ | FeCl3和过量KOH | 得到紫色溶液,无紫色固体 |
| Ⅲ | Fe(NO3)3和过量KOH | 得到紫色溶液(颜色比Ⅱ深),有紫色固体 |
①实验Ⅱ、Ⅲ产生K2FeO4,将方程式补充完整。
还原反应:
氧化反应:
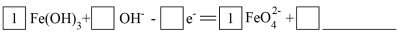
②对实验Ⅰ未产生K2FeO4而实验Ⅱ能产生的原因提出假设:实验Ⅱ溶液碱性较强,增强+3价铁的还原性。以下实验证实了该假设。

步骤1:通入Cl2,电压表示数为V1;
步骤2:向右侧烧杯中加入
③反思装置B的作用:用饱和NaCl溶液除去HCl,用平衡移动原理解释
④实验Ⅱ中K2FeO4的产率比实验Ⅲ低,试解释原因:
(3)向实验Ⅱ所得紫色溶液中继续通入Cl2,观察到溶液紫色变浅。可能原因是通入Cl2后发生
您最近一年使用:0次



