解题方法
1 . 某化学小组探究硫酸铁铵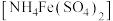 与
与 、
、 的反应。
的反应。
已知: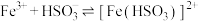 (棕红)
(棕红)
(1)①实验Ⅰ中产生红褐色沉淀与气泡的离子方程式为___________ 。
②由实验Ⅰ可得出与 结合的能力:
结合的能力:
___________  (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
(2)资料显示, 可以氧化
可以氧化 。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。
。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。
①实验Ⅲ中 与
与 反应生成
反应生成 的离子方程式为
的离子方程式为___________ 。
②结合化学反应原理解释实验Ⅱ、Ⅳ中现象存在差异的可能原因___________ 。
(3)针对实验Ⅲ、Ⅳ的现象差异,小组同学提出猜想:pH影响了 的氧化性或
的氧化性或 的还原性,并实施实验。
的还原性,并实施实验。
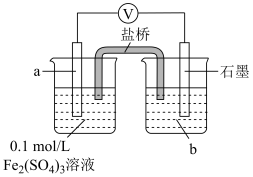
①a、b分别是___________ 。
②结合电极反应解释步骤3中电压表示数减小的原因___________ 。
③补充实验Ⅵ:向实验Ⅱ得到的棕红色液体中加入3滴10%稀硫酸,棕红色迅速变黄,检测到 。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因
。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因___________ 。
(4)综合以上实验,盐溶液间反应的多样性与___________ 有关。
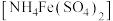 与
与 、
、 的反应。
的反应。| 实验 | 操作 | 现象 |
| Ⅰ | 向2mL 溶液(pH=2.03)中逐滴加入 溶液(pH=2.03)中逐滴加入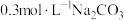 溶液 溶液 | 迅速产生大量红褐色沉淀和大量气泡;继续滴加,当气泡量明显减少时,试管口的湿润红色石蕊试纸开始逐渐变蓝 |
| Ⅱ | 向2mL 溶液(pH=2.03)中逐滴加入 溶液(pH=2.03)中逐滴加入 溶液 溶液 | 溶液立即变棕红(无丁达尔现象),继续滴加 溶液至过量,溶液依然为棕红色,放置两天无明显变化 溶液至过量,溶液依然为棕红色,放置两天无明显变化 |
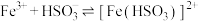 (棕红)
(棕红)(1)①实验Ⅰ中产生红褐色沉淀与气泡的离子方程式为
②由实验Ⅰ可得出与
 结合的能力:
结合的能力:
 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。(2)资料显示,
 可以氧化
可以氧化 。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。
。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。| 实验 | 操作 | 现象 |
| Ⅲ | 向2mL 溶液(pH=1.78)中加入0.5mL 溶液(pH=1.78)中加入0.5mL 溶液 溶液 | 溶液立即变棕红色,约2小时后,棕红色变为黄色,检测到 |
| Ⅳ | 向2mL 溶液(pH=2.03)中加入0.5mL 溶液(pH=2.03)中加入0.5mL 溶液 溶液 | 溶液立即变棕红色,约5小时后,棕红色变为黄色,检测到 |
 与
与 反应生成
反应生成 的离子方程式为
的离子方程式为②结合化学反应原理解释实验Ⅱ、Ⅳ中现象存在差异的可能原因
(3)针对实验Ⅲ、Ⅳ的现象差异,小组同学提出猜想:pH影响了
 的氧化性或
的氧化性或 的还原性,并实施实验。
的还原性,并实施实验。| 实验 | 实验装置 | 实验步骤及现象 |
| Ⅴ |
| 1.按如图搭好装置,接通电路,电压表读数为0.6V; 2.向a电极附近滴加3滴10%稀硫酸,电压表读数不变; 3.向石墨电极附近滴加3滴10%稀硫酸,电压表读数变为0.5V。 |
②结合电极反应解释步骤3中电压表示数减小的原因
③补充实验Ⅵ:向实验Ⅱ得到的棕红色液体中加入3滴10%稀硫酸,棕红色迅速变黄,检测到
 。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因
。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因(4)综合以上实验,盐溶液间反应的多样性与
您最近一年使用:0次
2 . 钠的燃烧产物中混有黑色物质,研究小组进行如下图所示的实验探究。下列推测不正确的是
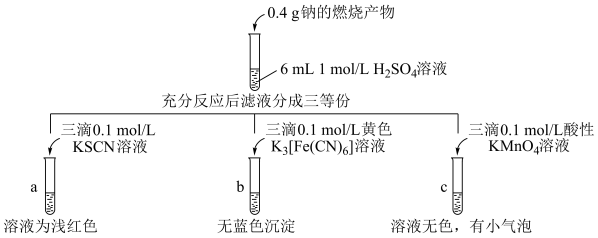
已知:K3[Fe(CN)6]能与Fe2+产生蓝色沉淀,是检验Fe2+的一种方法。

已知:K3[Fe(CN)6]能与Fe2+产生蓝色沉淀,是检验Fe2+的一种方法。
| A.过氧化钠与硫酸的反应可能有:Na2O2+2H+=2Na++H2O2 |
| B.a试管中的现象说明燃烧前钠块中含有铁元素 |
C.c试管的溶液为无色,推测发生的反应为:5H2O2+6H++2MnO =2Mn2++5O2↑+8H2O =2Mn2++5O2↑+8H2O |
| D.根据以上实验可判定:该实验中钠的燃烧产物里含Fe2O3,不含Fe3O4 |
您最近一年使用:0次
名校
3 . 某研究小组探究酸碱性对 和
和 反应的影响。
反应的影响。
资料: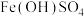 为黄色固体,难溶于水,可溶于酸。
为黄色固体,难溶于水,可溶于酸。
Ⅰ.无外加酸碱时,实验如下。
实验ⅰ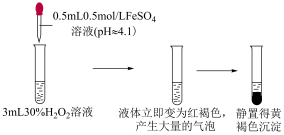
实验ⅱ
(1)根据_____ ,可证实实验ⅰ中红褐色液体为胶体。
(2)已知黄褐色沉淀中有 ,还可能存在
,还可能存在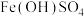 ,设计实验证实
,设计实验证实_____ 。(填操作和现象)
(3)结合化学用语,解释无外加酸碱时反应结束后 降低的原因
降低的原因_____ 。
Ⅱ.外加酸碱条件下,实验如下。
(4)根据实验ⅲ,推测立即产生大量气体的原因。
猜想一: 催化
催化 分解。
分解。
猜想二:_____ 。
设计实验_____ ,证实猜想一不是立即产生大量气体的主要原因。
(5) 是产生氧气的主要微粒。请结合反应机理分析酸性条件下产生气体少的原因
是产生氧气的主要微粒。请结合反应机理分析酸性条件下产生气体少的原因_____ 。
主要反应机理:
注: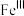 代表
代表 的化合价为+3
的化合价为+3
(6)已知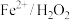 体系在废水净化中,具有一般化学氧化法无法比拟的优势,主要是由于
体系在废水净化中,具有一般化学氧化法无法比拟的优势,主要是由于 有强氧化性,根据以上实验探究,配制该体系最好控制在
有强氧化性,根据以上实验探究,配制该体系最好控制在_____ 条件下。
 和
和 反应的影响。
反应的影响。资料:
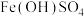 为黄色固体,难溶于水,可溶于酸。
为黄色固体,难溶于水,可溶于酸。Ⅰ.无外加酸碱时,实验如下。
实验ⅰ

实验ⅱ

(1)根据
(2)已知黄褐色沉淀中有
 ,还可能存在
,还可能存在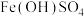 ,设计实验证实
,设计实验证实(3)结合化学用语,解释无外加酸碱时反应结束后
 降低的原因
降低的原因Ⅱ.外加酸碱条件下,实验如下。
| 实验编号 | 实验操作 | 现象 |
| ⅲ | 取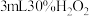 溶液于试管中,滴加 溶液于试管中,滴加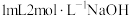 溶液,再滴加 溶液,再滴加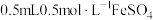 溶液 溶液 | 液体变为红褐色,立即产生大量气体,有液体喷出试管,最终产生大量红褐色沉淀 |
| ⅳ | 取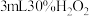 溶液于试管中,滴加 溶液于试管中,滴加 稀硫酸,再滴加 稀硫酸,再滴加 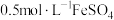 溶液 溶液 | 溶液呈黄色,有少量气泡产生,静置无沉淀产生 |
(4)根据实验ⅲ,推测立即产生大量气体的原因。
猜想一:
 催化
催化 分解。
分解。猜想二:
设计实验
(5)
 是产生氧气的主要微粒。请结合反应机理分析酸性条件下产生气体少的原因
是产生氧气的主要微粒。请结合反应机理分析酸性条件下产生气体少的原因主要反应机理:
①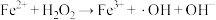 | ② ( ( 的水解) 的水解) |
③ | ④ |
⑤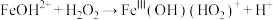 | ⑥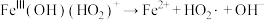 |
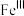 代表
代表 的化合价为+3
的化合价为+3(6)已知
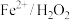 体系在废水净化中,具有一般化学氧化法无法比拟的优势,主要是由于
体系在废水净化中,具有一般化学氧化法无法比拟的优势,主要是由于 有强氧化性,根据以上实验探究,配制该体系最好控制在
有强氧化性,根据以上实验探究,配制该体系最好控制在
您最近一年使用:0次
2024-01-21更新
|
110次组卷
|
2卷引用:北京市丰台区2023-2024学年高二上学期期末考试化学试题
名校
解题方法
4 . 某小组同学探究FeSO4溶液与NaClO溶液的反应。
实验Ⅰ:向敞口容器中加入一定体积0.1mol·L-1FeSO4溶液,不断搅拌,逐滴加入pH≈13的84消毒液,溶液pH变化曲线如下图所示(从B点开始滴入84消毒液)。

B~C段,开始时产生红褐色沉淀,随后沉淀消失,溶液变为暗红色;
C点之后,逐渐产生大量黄色沉淀,有刺激性气味气体产生,溶液颜色明显变浅。
已知:25℃,饱和NaClO溶液的pH约为11,Fe3+完全沉淀时的pH≈13。
(1)Cl2通入NaOH溶液可得上述84消毒液,该84消毒液中阴离子主要有___________ 。
(2)A~B段,FeSO4溶液在搅拌下pH略有下降,用离子方程式解释原因___________ 。
(3)B~C段,产生红褐色沉淀的离子方程式为___________ 。查阅资料可知,暗红色物质为聚合硫酸铁,是一种无机高分子化合物,其主要阳离子的结构为如下所示,该阳离子中Fe的配位数为___________ 。
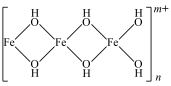
(4)取少量C点溶液,加入___________ (补充试剂和现象),证明溶液中无Fe2+。C点之后产生的黄色沉淀经检验为铁黄(FeOOH),写出暗红色物质转化为黄色沉淀的离子方程式___________ 。
实验Ⅱ:向敞口容器中加入一定体积的pH≈13的84消毒液,不断搅拌,逐滴加入0.1mol·L-1FeSO4溶液,溶液pH变化曲线如下图所示。

E→H段,迅速产生大量红褐色沉淀且逐渐增多,H后开始产生有刺激性气味的气体,最终得到暗红色溶液和大量黄色沉淀。
已知:Cl2、HClO、ClO-在不同pH条件下的百分含量如下图:

(5)G→H段pH骤降的原因是___________ (用离子方程式表示)。
(6)综合以上实验,FeSO4溶液与NaClO溶液的反应产物与___________ 有关。
实验Ⅰ:向敞口容器中加入一定体积0.1mol·L-1FeSO4溶液,不断搅拌,逐滴加入pH≈13的84消毒液,溶液pH变化曲线如下图所示(从B点开始滴入84消毒液)。

B~C段,开始时产生红褐色沉淀,随后沉淀消失,溶液变为暗红色;
C点之后,逐渐产生大量黄色沉淀,有刺激性气味气体产生,溶液颜色明显变浅。
已知:25℃,饱和NaClO溶液的pH约为11,Fe3+完全沉淀时的pH≈13。
(1)Cl2通入NaOH溶液可得上述84消毒液,该84消毒液中阴离子主要有
(2)A~B段,FeSO4溶液在搅拌下pH略有下降,用离子方程式解释原因
(3)B~C段,产生红褐色沉淀的离子方程式为

(4)取少量C点溶液,加入
实验Ⅱ:向敞口容器中加入一定体积的pH≈13的84消毒液,不断搅拌,逐滴加入0.1mol·L-1FeSO4溶液,溶液pH变化曲线如下图所示。

E→H段,迅速产生大量红褐色沉淀且逐渐增多,H后开始产生有刺激性气味的气体,最终得到暗红色溶液和大量黄色沉淀。

已知:Cl2、HClO、ClO-在不同pH条件下的百分含量如下图:

(5)G→H段pH骤降的原因是
(6)综合以上实验,FeSO4溶液与NaClO溶液的反应产物与
您最近一年使用:0次
2023-11-06更新
|
212次组卷
|
3卷引用:北京市丰台区2023-2024学年高三上学期期中练习化学试题
5 . 某兴趣小组同学用图1所示装置,向一定体积的0.01mol/LBa(OH)2溶液中逐滴滴加0.2mol/LH2SO4溶液,不断搅拌并测定溶液导电能力的变化,实验测得混合溶液的导电能力随时间变化的曲线如图2所示。
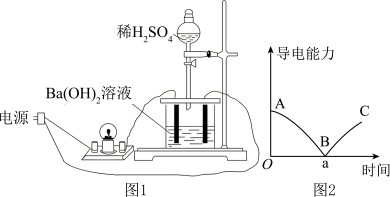
(1)用化学用语解释未滴加硫酸时,接通电源后灯泡变亮的原因:_______ ;
(2)实验过程中观察到的现象是:烧杯中_______ ,小灯泡_______ 。
(3)写出Ba(OH)2溶液与稀H2SO4反应的离子方程式_______ 。
(4)B点代表反应恰好完全,用Na2SO4溶液替代H2SO4溶液,重复上述实验进行对照,分析二者现象上的不同之处为_______ 。

(1)用化学用语解释未滴加硫酸时,接通电源后灯泡变亮的原因:
(2)实验过程中观察到的现象是:烧杯中
(3)写出Ba(OH)2溶液与稀H2SO4反应的离子方程式
(4)B点代表反应恰好完全,用Na2SO4溶液替代H2SO4溶液,重复上述实验进行对照,分析二者现象上的不同之处为
您最近一年使用:0次
6 . 小组利用如下装置探究氯气与水反应的产物。
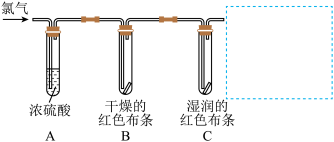
(1)浓硫酸的作用是_______ 。
(2)实验时,根据_______ 现象,甲同学得出初步结论:氯气与水反应生成的产物具有漂白性。
(3)Cl2与H2O反应的离子方程式为_______ 。
(4)乙同学们分析后,认为用该实验装置不能得出“HClO是漂白性物质”的结论,理由是_______ 。为了进一步证明该结论,应补充设计实验:_______ 。
(5)图中所示的实验设计还存在不足,请根据相关物质的性质,在图中的虚框内补充有关实验装置_______ ,并用离子方程式表示该原理_______ 。

(1)浓硫酸的作用是
(2)实验时,根据
(3)Cl2与H2O反应的离子方程式为
(4)乙同学们分析后,认为用该实验装置不能得出“HClO是漂白性物质”的结论,理由是
(5)图中所示的实验设计还存在不足,请根据相关物质的性质,在图中的虚框内补充有关实验装置
您最近一年使用:0次
7 . 某实验小组探究 和
和 的反应。实验操作及现象如下。
的反应。实验操作及现象如下。
(1)取实验2后的溶液,进行如下实验:
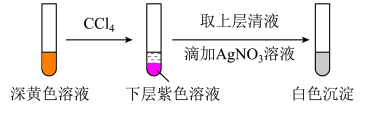
①根据______ 现象,判断实验2中有I2生成,因此反应后溶液显黄色。
②经检验,上述白色沉淀是AgCl。补全实验2中发生反应的离子方程式:_____ 。
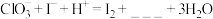
(2)查阅资料:一定条件下, 和I2都可以被氧化成
和I2都可以被氧化成 。
。
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是______ 。
进行实验:
取少量实验4中的无色溶液进行以下实验,证实假设成立。
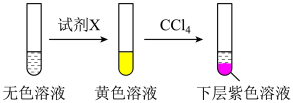
其中试剂X可以是______ (填字母)。
a.碘水 b.KMnO4溶液 c.NaHSO3溶液
 和
和 的反应。实验操作及现象如下。
的反应。实验操作及现象如下。实验及试剂 | 编号 | 无色NaClO3溶液用量 | 试管中溶液颜色 |
| 1 | 0.05mL | 浅黄色 |
2 | 0.02mL | 深黄色 | |
3 | 0.25mL | 浅黄色 | |
4 | 0.30mL | 无色 |

①根据
②经检验,上述白色沉淀是AgCl。补全实验2中发生反应的离子方程式:
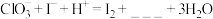
(2)查阅资料:一定条件下,
 和I2都可以被氧化成
和I2都可以被氧化成 。
。作出假设:NaClO3溶液用量增加导致溶液褪色的原因是
进行实验:
取少量实验4中的无色溶液进行以下实验,证实假设成立。

其中试剂X可以是
a.碘水 b.KMnO4溶液 c.NaHSO3溶液
您最近一年使用:0次
8 . 向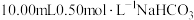 溶液中滴加不同浓度的
溶液中滴加不同浓度的 溶液,观察到明显产生浑浊时,停止滴加;取少量所得浑浊液加热,记录实验现象。下列说法不正确的是
溶液,观察到明显产生浑浊时,停止滴加;取少量所得浑浊液加热,记录实验现象。下列说法不正确的是
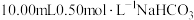 溶液中滴加不同浓度的
溶液中滴加不同浓度的 溶液,观察到明显产生浑浊时,停止滴加;取少量所得浑浊液加热,记录实验现象。下列说法不正确的是
溶液,观察到明显产生浑浊时,停止滴加;取少量所得浑浊液加热,记录实验现象。下列说法不正确的是| 实验 | 序号 | 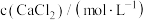 | 滴加 溶液时的实验现象 溶液时的实验现象 | 加热浑浊液时的实验现象 |
 溶液 溶液 | ① | 0.05 | 至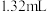 时产生明显浑浊,但无气泡产生 时产生明显浑浊,但无气泡产生 | 有较多气泡生成 |
| ② | 0.005 | 至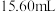 时产生明显浑浊,但无气泡产生 时产生明显浑浊,但无气泡产生 | 有少量气泡生成 | |
| ③ | 0.0005 | 至 未见浑浊 未见浑浊 | — |
A.①中产生浑浊的原因是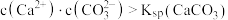 |
B.未加热前①和②中发生了反应: |
C.加热浊液产生气泡主要是因为 受热分解产生了更多的 受热分解产生了更多的 |
D.向上述 溶液中加入足量 溶液中加入足量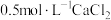 溶液,可能同时产生浑浊和气泡 溶液,可能同时产生浑浊和气泡 |
您最近一年使用:0次
2023-02-03更新
|
327次组卷
|
14卷引用:北京十中2022-2023学年高三上学期期末统练3化学试题
北京十中2022-2023学年高三上学期期末统练3化学试题北京市海淀区2020届高三上学期期末考试化学试题北京市八一学校2019-2020学年高二下学期期末考试化学试题湖北省武汉市蔡甸区汉阳一中2020届高三全国高等学校仿真模拟(一)考试理综化学试题江苏省常熟市2021-2022学年高三上学期阶段性抽测一化学试题江苏省盐城市阜宁中学2021-2022学年高三下学期第三次综合测试化学试题北京市第八中学2021-2022学年高二上学期期末考试化学试题浙江省衢州五校联盟2022-2023学年高二上学期期末联考(普通班)化学试题(已下线)北京市海淀区2023届高三上学期期末考试变式汇编(8-14)(已下线)第一部分 二轮专题突破 专题14 溶液中的三大平衡及应用(已下线)T13-实验方案的设计与评价浙江省衢温“5+1”联盟2022-2023学年高二上学期期末联考化学试题北京市第十五中学2023-2024学年高二上学期期中考试化学试题2024届吉林省长春市高三下学期质量监测(四)化学试题
名校
9 . 碳酸亚铁(白色固体,难溶于水)可用于制备补血剂乳酸亚铁,也可用作可充电电池的电极。某研究小组设计实验制备 ,依次进行了实验I、II、III,方案如下:
,依次进行了实验I、II、III,方案如下:
资料:ⅰ.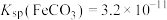 ,
,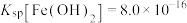
ⅱ. 吸附
吸附 后会呈现茶色
后会呈现茶色
ⅲ.
(1)实验I中的白色沉淀是______ 。
甲同学从理论上解释了该沉淀不是 的原因
的原因____________________________________ 。
(2)请结合化学用语解释 溶液呈碱性的原因
溶液呈碱性的原因________________________________ 。
(3)写出实验II中“产生白色沉淀及气泡”的离子方程式_____________________________ 。
(4)与实验I和II对比,实验Ⅲ使用 溶液的优点有
溶液的优点有________________________ 。
【实验反思】乙同学进一步确认实验I中红褐色沉淀的成分,进行了如下实验:
取沉淀溶于足量的硫酸,向其中通入 气体至饱和,溶液变为红棕色,放置12小时后溶液呈浅绿色。
气体至饱和,溶液变为红棕色,放置12小时后溶液呈浅绿色。
(5)请结合化学用语解释“先出现红棕色,12小时后变为浅绿色”的原因________________________ 。
 ,依次进行了实验I、II、III,方案如下:
,依次进行了实验I、II、III,方案如下:0.8 mol/L 溶液 溶液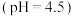
| 实验 | 试管内试剂 | 现象 |
Ⅰ | 1 mol/L  溶液 溶液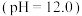 | 产生白色沉淀后很快变为灰绿色沉淀,5 min后出现明显的红褐色 | |
Ⅱ | 1 mol/L  溶液 溶液 | 产生白色沉淀后逐渐变茶色,有小气泡生成 | |
Ⅲ | 1 mol/L  溶液 溶液 | 产生白色沉淀及无色气泡,较长时间保持白色 |
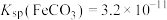 ,
,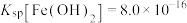
ⅱ.
 吸附
吸附 后会呈现茶色
后会呈现茶色ⅲ.

(1)实验I中的白色沉淀是
甲同学从理论上解释了该沉淀不是
 的原因
的原因(2)请结合化学用语解释
 溶液呈碱性的原因
溶液呈碱性的原因(3)写出实验II中“产生白色沉淀及气泡”的离子方程式
(4)与实验I和II对比,实验Ⅲ使用
 溶液的优点有
溶液的优点有【实验反思】乙同学进一步确认实验I中红褐色沉淀的成分,进行了如下实验:
取沉淀溶于足量的硫酸,向其中通入
 气体至饱和,溶液变为红棕色,放置12小时后溶液呈浅绿色。
气体至饱和,溶液变为红棕色,放置12小时后溶液呈浅绿色。(5)请结合化学用语解释“先出现红棕色,12小时后变为浅绿色”的原因
您最近一年使用:0次
10 . 某小组研究Na2S 溶液与KMnO4溶液反应,探究过程如下。
资料:i. 在强酸性条件下被还原为Mn2+,在近中性条件下被还原为
在强酸性条件下被还原为Mn2+,在近中性条件下被还原为 。
。
ii.单质硫可溶于硫化钠溶液,溶液呈淡黄色。
(1)根据实验可知,Na2S具有_______ 性。
(2)甲同学预测实验I中S2-被氧化成 。
。
①根据实验现象,乙同学认为甲的预测不合理,理由是_______ 。
②乙同学取实验I中少量溶液进行实验,检测到有 ,得出S2-被氧化成
,得出S2-被氧化成 的结论,丙同学否定了该结论,理由是
的结论,丙同学否定了该结论,理由是_______ 。
③同学们经讨论后,设计了如下实验,证实该条件下 的确可以将S2-氧化成
的确可以将S2-氧化成 。
。
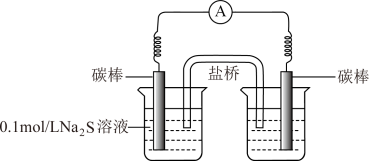
a.右侧烧杯中的溶液是_______ 。
b.连通后电流计指针偏转,一段时间后,_______ (填操作和现象)。
(3)实验I的现象与资料ⅰ存在差异,其原因是新生成的产物(Mn2+)与过量的反应物( )发生反应,该反应的离子方程式是
)发生反应,该反应的离子方程式是_______ 。
(4)实验II的现象与资料也不完全相符,丁同学猜想其原因与(3)相似,经验证猜想成立,他的实验方案是_______ 。
(5)反思该实验,反应物相同,而现象不同,体现了物质变化不仅与其自身的性质有关,还与_______ 因素有关。
| 实验序号 | I | II |
| 实验过程 | 加10滴(约0.3mL)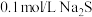 溶液 溶液  酸性KMnO4溶液( 酸性KMnO4溶液( 酸化至 酸化至 ) ) | 滴加10滴约(0.3mL)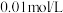 酸性KMnO4溶液( 酸性KMnO4溶液( 酸化至 酸化至 ) )  溶液 溶液 |
| 实验现象 | 紫色变浅( ),生成棕褐色沉淀( ),生成棕褐色沉淀( ) ) | 溶液呈淡黄色(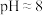 ),生成浅粉色沉淀( ),生成浅粉色沉淀( ) ) |
 在强酸性条件下被还原为Mn2+,在近中性条件下被还原为
在强酸性条件下被还原为Mn2+,在近中性条件下被还原为 。
。ii.单质硫可溶于硫化钠溶液,溶液呈淡黄色。
(1)根据实验可知,Na2S具有
(2)甲同学预测实验I中S2-被氧化成
 。
。 ①根据实验现象,乙同学认为甲的预测不合理,理由是
②乙同学取实验I中少量溶液进行实验,检测到有
 ,得出S2-被氧化成
,得出S2-被氧化成 的结论,丙同学否定了该结论,理由是
的结论,丙同学否定了该结论,理由是③同学们经讨论后,设计了如下实验,证实该条件下
 的确可以将S2-氧化成
的确可以将S2-氧化成 。
。
a.右侧烧杯中的溶液是
b.连通后电流计指针偏转,一段时间后,
(3)实验I的现象与资料ⅰ存在差异,其原因是新生成的产物(Mn2+)与过量的反应物(
 )发生反应,该反应的离子方程式是
)发生反应,该反应的离子方程式是(4)实验II的现象与资料也不完全相符,丁同学猜想其原因与(3)相似,经验证猜想成立,他的实验方案是
(5)反思该实验,反应物相同,而现象不同,体现了物质变化不仅与其自身的性质有关,还与
您最近一年使用:0次