名校
解题方法
1 . 为了预防传染性疾病,不少地方都采用了“84”消毒液进行消毒。“84”消毒液(有效成分为NaClO)可用于消毒和漂白。下列对相关实验现象的分析,不正确 的是


| 实验 | I | II | III |
| 滴管中的液体 | 1mL的蒸馏水 | 1mL0.0002mol•L-1的H2SO4 | 1mL2mol•L-1的H2SO4 |
| 实验现象 | 混合后溶液的pH=9.9,短时间内未褪色,一段时间后蓝色褪去 | 混合后溶液的pH=5.0,蓝色迅速褪去,无气体产生 | 混合后溶液的pH=3.2,蓝色迅速褪去,并产生大量气体,使湿润的淀粉碘化钾试纸变蓝 |
| A.对比实验I和II,II中蓝色迅速褪去的原因是发生了反应:ClO-+H+=HClO |
| B.对比实验II和III,溶液的pH可能会影响ClO-的氧化性或Cl-的还原性 |
| C.实验III中产生的气体是Cl2,由HClO分解得到:2HClO=Cl2↑+H2O |
| D.加酸可以提高“84”消毒液的漂白效果,但需合适的pH才能安全使用 |
您最近一年使用:0次
解题方法
2 . 某小组同学为研究有机物的官能团以及化学键的活性,完成下列对比实验。
(1)实验I、实验II使用到的两种有机物的关系是_______ 。
(2)实验I中发生反应的化学方程式是_______ 。
(3)对比分析实验I和实验II,从结构角度解释发生不同现象的原因_______ 。
(4)该小组同学欲验证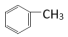

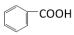 ,进一步探究有机化合物基团之间的相互影响。完成下表实验,请将实验方案和实验现象补充完整。
,进一步探究有机化合物基团之间的相互影响。完成下表实验,请将实验方案和实验现象补充完整。
实验结论:_______ 。
| 实验I | 实验II | |
| 实验方案与 现象 | 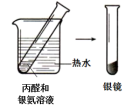 | 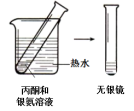 |
(2)实验I中发生反应的化学方程式是
(3)对比分析实验I和实验II,从结构角度解释发生不同现象的原因
(4)该小组同学欲验证


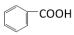 ,进一步探究有机化合物基团之间的相互影响。完成下表实验,请将实验方案和实验现象补充完整。
,进一步探究有机化合物基团之间的相互影响。完成下表实验,请将实验方案和实验现象补充完整。| 实验方案 | 实验现象 |
| ①将过量CH4气体通入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液不褪色 |
| ②向盛有2mL甲苯的试管中加入5滴酸性高锰酸钾溶液,用力振荡,静置 | |
| ③ | 酸性高锰酸钾溶液不褪色 |
您最近一年使用:0次
2021-08-13更新
|
205次组卷
|
2卷引用:北京市延庆区2020-2021学年高二下学期期末考试化学试题
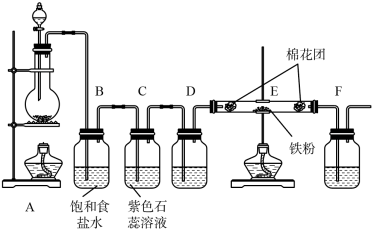
3 . 某化学兴趣小组同学为验证氯气的性质并制备少量干燥的氯化铁,设计并进行如下实验:
回答下列问题:
(1)写出A中制取氯气的化学方程式__________________________________ 。
(2)B装置的作用是_____________ 。
(3)实验时C中可观察到的现象是_________________________ ,氯气与水发生反应的离子方程式是_____________________________ 。
(4)D瓶盛放的试剂是_______________ 。
(5)E中发生反应的化学方程式是_________ 。
(6)F瓶溶液的作用是______ ,写出发生反应的离子方程式___________ 。

回答下列问题:
(1)写出A中制取氯气的化学方程式
(2)B装置的作用是
(3)实验时C中可观察到的现象是
(4)D瓶盛放的试剂是
(5)E中发生反应的化学方程式是
(6)F瓶溶液的作用是
您最近一年使用:0次
2020-09-10更新
|
226次组卷
|
3卷引用:北京市延庆区2021届高三上学期统测(9月)考试化学试题
名校
4 . 下列“实验结论”与“实验操作及现象”不相符 的一组是( )
| 项 | 实验操作及现象 | 实验结论 |
| A | 向KI-淀粉溶液中滴加氯水,溶液变成蓝色 | 氧化性:Cl2>I2 |
| B | 将钠放入热坩埚中加热燃烧,生成淡黄色固体 | 反应有Na2O2生成 |
| C | 将湿润的有色纸条放入盛有干燥氯气的集气瓶中,盖上玻璃片,一段时间后纸条褪色 | 氯气具有漂白性 |
| D | 向某溶液中加入几滴AgNO3溶液,有白色沉淀生成,再加入少量稀硝酸,沉淀不溶解 | 溶液中可能含有Cl- |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-09-10更新
|
587次组卷
|
5卷引用:北京市延庆区2021届高三上学期统测(9月)考试化学试题
名校
解题方法
5 . 为探究Na2O2与H2O的反应,进行了如下实验:有关说法不正确 的是( )


| A.实验ⅰ中发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑ |
| B.实验ⅲ中MnO2做H2O2分解反应的催化剂 |
| C.综合实验ⅰ和ⅲ可以说明Na2O2与H2O反应有H2O2生成 |
| D.综合实验表明,实验ⅱ酚酞褪色的原因是溶液碱性变弱 |
您最近一年使用:0次
2020-09-10更新
|
1437次组卷
|
17卷引用:北京市延庆区2021届高三上学期统测(9月)考试化学试题
北京市延庆区2021届高三上学期统测(9月)考试化学试题山东省德州市齐河县实验中学2021届高三第一次月考化学试题吉林省大安市第一中学校2021届高三上学期第二次月考化学试题北京市第十二中学2020-2021学年高一上学期期中考试化学试题黑龙江省鸡西市第一中学2020-2021学年高一上学期第一次月考化学试题北京市第二十中学2021-2022学年高一上学期期中考试化学试题北京市东直门中学2021-2022学年高一上学期期中考试化学试题广东省佛山市第一中学2021-2022学年高一上学期期中考试化学试题吉林省长春市十一高中2021-2022学年高一上学期第二学程考试化学试卷江苏省泰州中学2021-2022学年高一上学期期末考试化学试题(已下线)2.1.2 钠的氧化物与焰色试验-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)河北省石家庄市第十五中学2022-2023学年高一上学期期中考试化学试题四川省泸县第四中学2022-2023学年高一上学期第三次月考化学试题广东省深圳市福田区红岭中学2022-2023学年高一上学期第二学段期末考试化学试题(已下线)【知识图鉴】单元讲练测必修第一册第二单元03巩固练江苏省前黄高级中学2022-2023学年高一下学期综合素质测试化学试题(已下线)专题05 金属钠及钠的化合物-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)
名校
解题方法
6 . 某研究性小组为探究铜丝与过量浓硫酸的反应,设计了如图所示装置进行有关实验,最后发现试管中铜有剩余。请回答:
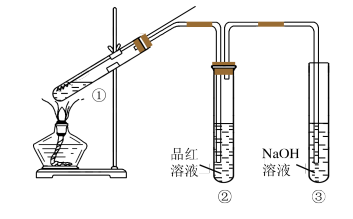
(1)试管①中发生反应的化学方程式是________ ,该反应体现了浓硫酸的______ (填“氧化性”或“还原性”)。
(2)试管②中的实验现象是______________ 。
(3)试管③中,NaOH的作用是____________ 。反应的化学方程式是______ 。
(4)该小组认为还应有一定的硫酸剩余,请说明铜丝未完全溶解并仍有一定量余酸的原因_______ 。
(5)为证明反应结束后的试管中确实有余酸,可选用下列药品中的______________ 。
A.锌粒 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(6)若想使铜继续反应可以向试管①中加入一种物质,该物质可能是_______ (填序号)
A.NaNO3 B. Na2SO4 C. NaCl D.FeCl2
试写出该反应的离子方程式____________________________________________ 。

(1)试管①中发生反应的化学方程式是
(2)试管②中的实验现象是
(3)试管③中,NaOH的作用是
(4)该小组认为还应有一定的硫酸剩余,请说明铜丝未完全溶解并仍有一定量余酸的原因
(5)为证明反应结束后的试管中确实有余酸,可选用下列药品中的
A.锌粒 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(6)若想使铜继续反应可以向试管①中加入一种物质,该物质可能是
A.NaNO3 B. Na2SO4 C. NaCl D.FeCl2
试写出该反应的离子方程式
您最近一年使用:0次
2020-07-07更新
|
168次组卷
|
2卷引用:北京市延庆区2019-2020学年高一下学期期中考试化学试题
名校
解题方法
7 . 硝酸铁具有较强的氧化性,易溶于水,乙醇等,微溶于浓硝酸。可用于金属表面化学抛光剂。
(1)制备硝酸铁
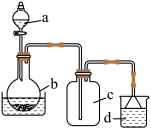
取100mL 8mol· L-1硝酸于a中,取 5.6g铁屑于b中,水浴保持反应温度不超过70℃。
①b中硝酸与铁屑混合后,铁屑溶解,溶液变黄色,液面上方有红棕色气体。写出b中发生反应的离子方程式:_______ 。
②若用实验制得的硝酸铁溶液,获取硝酸铁晶体,应进行的操作是:将溶液小心加热浓缩、_________ 、___________ ,用浓硝酸洗涤、干燥。
(2)探究硝酸铁的性质。用硝酸铁晶体配制0.1mol·L-1硝酸铁溶液,溶液呈黄色,进行实验如下:
实验一:硝酸铁溶液与银反应:
i.测0.1mol·L-1硝酸铁溶液pH约等于1.6 。
ii.将5mL 0.1mol·L-1硝酸铁溶液加到有银镜的试管中,约1min银镜完全溶解。使银镜溶解的反应原理有两个反应:
a. Fe3+使银镜溶解 b. NO3-使银镜溶解
①证明Fe3+使银镜溶解,应辅助进行的实验操作是_________ 。
②用5mL__________ 溶液,加到有银镜的试管中,约1.2min银镜完全溶解。证明NO3-使银镜溶解。
③为进一步研究溶解过程,用5mLpH约等于1.6的0.05mol·L-1硫酸铁溶液,加到有银镜的试管中,约10min银镜完全溶解。
实验二:硝酸铁溶液与二氧化硫反应,用如图所示装置进行实验:
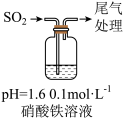
i.缓慢通入SO2,溶液液面上方出现红棕色气体,溶液仍呈黄色。
ii.继续持续通入SO2,溶液逐渐变为深棕色。
已知:Fe2++NO⇌[Fe(NO)]2+(深棕色)
④步骤i反应开始时,以NO3-氧化SO2为主,理由是:_________ 。
⑤步骤ii后期反应的离子方程式是__________ 。
(3)由以上探究硝酸铁的性质实验得出的结论是__________ 。
(1)制备硝酸铁

取100mL 8mol· L-1硝酸于a中,取 5.6g铁屑于b中,水浴保持反应温度不超过70℃。
①b中硝酸与铁屑混合后,铁屑溶解,溶液变黄色,液面上方有红棕色气体。写出b中发生反应的离子方程式:
②若用实验制得的硝酸铁溶液,获取硝酸铁晶体,应进行的操作是:将溶液小心加热浓缩、
(2)探究硝酸铁的性质。用硝酸铁晶体配制0.1mol·L-1硝酸铁溶液,溶液呈黄色,进行实验如下:
实验一:硝酸铁溶液与银反应:
i.测0.1mol·L-1硝酸铁溶液pH约等于1.6 。
ii.将5mL 0.1mol·L-1硝酸铁溶液加到有银镜的试管中,约1min银镜完全溶解。使银镜溶解的反应原理有两个反应:
a. Fe3+使银镜溶解 b. NO3-使银镜溶解
①证明Fe3+使银镜溶解,应辅助进行的实验操作是
②用5mL
③为进一步研究溶解过程,用5mLpH约等于1.6的0.05mol·L-1硫酸铁溶液,加到有银镜的试管中,约10min银镜完全溶解。
实验二:硝酸铁溶液与二氧化硫反应,用如图所示装置进行实验:

i.缓慢通入SO2,溶液液面上方出现红棕色气体,溶液仍呈黄色。
ii.继续持续通入SO2,溶液逐渐变为深棕色。
已知:Fe2++NO⇌[Fe(NO)]2+(深棕色)
④步骤i反应开始时,以NO3-氧化SO2为主,理由是:
⑤步骤ii后期反应的离子方程式是
(3)由以上探究硝酸铁的性质实验得出的结论是
您最近一年使用:0次
2020-04-20更新
|
309次组卷
|
4卷引用:北京市延庆区2020届高三统测化学试题
北京市延庆区2020届高三统测化学试题北京市延庆区2020届高三一模化学试题(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编:科学探究北京首都师范大学附属中学2021-2022学年高三上学期10月月考化学试题
名校
8 . 某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为_____ 。
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10 mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论_________________ 。
②同学们在两烧杯中还观察到以下现象。其中,属于盛放Na2CO3的烧杯中出现的现象的是______ (填字母序号)。
a.溶液温度下降 b.溶液温度升高 c.滴入酚酞后呈浅红色 d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中。
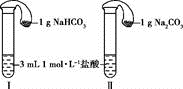
①两试管中均产生气体,__________ (填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈。
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是__________ 。
a.装置Ⅰ的气球体积较大
b.装置Ⅱ的气球体积较大
c.生成气体的体积根据盐酸计算
d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象作出预测:
实际实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体。则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为_______________________________ 。
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10 mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论
②同学们在两烧杯中还观察到以下现象。其中,属于盛放Na2CO3的烧杯中出现的现象的是
a.溶液温度下降 b.溶液温度升高 c.滴入酚酞后呈浅红色 d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中。

①两试管中均产生气体,
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是
a.装置Ⅰ的气球体积较大
b.装置Ⅱ的气球体积较大
c.生成气体的体积根据盐酸计算
d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象作出预测:
| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2 mLNa2CO3溶液中滴加1mL 0.5mol·L-1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32—浓度较大,能与CaCl2发生反应 |
| 操作2:向2 mLNaHCO3溶液中滴加1 mL 0.5mol·L-1CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32—浓度很小,不能与CaCl2反应 |
您最近一年使用:0次
2016-12-09更新
|
1754次组卷
|
8卷引用:北京市延庆区2021届高三上学期统测(9月)考试化学试题
北京市延庆区2021届高三上学期统测(9月)考试化学试题(已下线)2014届北京市海淀区高三上学期期中考试化学试卷(已下线)2013-2014学年河南省洛阳市高一上学期期末检测化学试卷(A)2017届河北省涞水县波峰中学高三8月月考化学试卷人教版2017-2018学年高一化学必修1:第三章 金属及其化合物-金属钠及其化合物 专项训练习题2020届高三化学二轮复习实验题必练-碱金属及其化合物(已下线)【教材实验热点】03 碳酸钠和碳酸氢钠性质的研究 北京市八一学校2021-2022学年高一上学期期中考试化学试题



