1 . 氧化还原反应可拆分为氧化和还原两个“半反应”,某小组同学从“半反应”的角度探究反应规律。
(1)已知: 的转化在酸性条件下才能发生。
的转化在酸性条件下才能发生。
①该转化的还原半反应是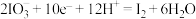 ,则相应的氧化半反应是
,则相应的氧化半反应是___________ 。
②分析上述还原半反应可知:增大 可促进
可促进 得到电子,使其
得到电子,使其___________ 性增强,进而与 发生反应。
发生反应。
(2)探究 与浓盐酸能否发生反应。
与浓盐酸能否发生反应。
①有同学认为 与浓盐酸不能发生反应产生氢气,其依据是
与浓盐酸不能发生反应产生氢气,其依据是___________ 。
用如下装置进行实验【硫酸与浓盐酸中 接近】。
接近】。
②甲实验的目的是___________ 。
③a.丙中气球变鼓是因为生成了___________ 气体(填化学式)。
b.经检测,丙中反应后溶液中存在 。从物质性质角度分析丙中反应能够发生的原因:
。从物质性质角度分析丙中反应能够发生的原因:___________ 。
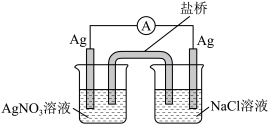
(3)探究以下原电池的工作原理。
实验结果:产生电流,左侧 电极表面有
电极表面有 析出。
析出。
①该装置中左侧  电极作
电极作___________ (填“正”或“负”)极。
②写出该装置右侧 烧杯中的电极反应式___________ 。
对该原电池的电极反应和总反应的反应类型进行分析,发现两极上分别发生氧化和还原反应,而总反应不一定是氧化还原反应。
③结合上述实验思考,仅由以下实验用品能否设计成原电池__________ 。
 片、
片、 浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
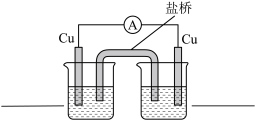
a.若能,在右装置图中填写烧杯中的试剂,并标出电子的移动方向 。
b.若不能,说明原因。
(1)已知:
 的转化在酸性条件下才能发生。
的转化在酸性条件下才能发生。①该转化的还原半反应是
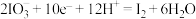 ,则相应的氧化半反应是
,则相应的氧化半反应是②分析上述还原半反应可知:增大
 可促进
可促进 得到电子,使其
得到电子,使其 发生反应。
发生反应。(2)探究
 与浓盐酸能否发生反应。
与浓盐酸能否发生反应。①有同学认为
 与浓盐酸不能发生反应产生氢气,其依据是
与浓盐酸不能发生反应产生氢气,其依据是用如下装置进行实验【硫酸与浓盐酸中
 接近】。
接近】。| 装置 | 序号 | 试管内药品 | 现象 |
 | 甲 | 浓盐酸 | 24小时后仍无明显变化 |
| 乙 |  粉+硫酸 粉+硫酸 | 24小时后仍无明显变化 | |
| 丙 |  粉+浓盐酸 粉+浓盐酸 | 24小时后气球变鼓 |
③a.丙中气球变鼓是因为生成了
b.经检测,丙中反应后溶液中存在
 。从物质性质角度分析丙中反应能够发生的原因:
。从物质性质角度分析丙中反应能够发生的原因:(3)探究以下原电池的工作原理。
实验结果:产生电流,左侧
 电极表面有
电极表面有 析出。
析出。①该装置中
 电极作
电极作②写出该装置

对该原电池的电极反应和总反应的反应类型进行分析,发现两极上分别发生氧化和还原反应,而总反应不一定是氧化还原反应。
③结合上述实验思考,仅由以下实验用品能否设计成原电池
 片、
片、 浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
a.若能,在右装置图中填写烧杯中的试剂,
b.若不能,说明原因。
您最近一年使用:0次
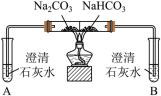
2 . 某小组同学进行Na2CO3和NaHCO3性质的探究,实验如下(夹持装置已略去,气密性已检验)。
【实验一】
(1)实验I,能够证明Na2CO3的热稳定性强于NaHCO3的证据是___________ 。
(2)实验II,试剂a为___________ 。
(3)实验II,持续一段时间后,观察到饱和Na2CO3溶液中有细小晶体析出,用化学方程式表示产生细小晶体的原因:___________ 。
【实验二】
【查阅资料】pH越小,c(OH-)越小,溶液碱性越弱。
(4)实验I中,溶解时吸收热量的物质是___________ (写化学式)。
(5)实验II中,Na2CO3溶液和澄清石灰水反应的离子方程式为___________ ,(OH-未参与该反应的实验证据是___________ 。
(6)实验II中,滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,原因是滴加NaHCO3溶液的烧杯中,参与反应的离子有___________ 。
【实验一】
| 实验I | 实验II |
 |  |
(2)实验II,试剂a为
(3)实验II,持续一段时间后,观察到饱和Na2CO3溶液中有细小晶体析出,用化学方程式表示产生细小晶体的原因:
【实验二】
【查阅资料】pH越小,c(OH-)越小,溶液碱性越弱。
| 编号 | 实验操作 | 实验数据 |
| 实验I | 测量下述实验过程的温度变化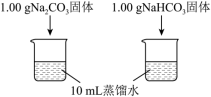 |  |
| 实验操作 | 实验数据 | |
| 实验II | 测量下述实验过程的pH变化 | ②和③中均产生白色沉淀。 各烧杯中pH变化如下图所示 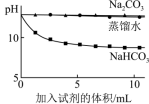 |
(5)实验II中,Na2CO3溶液和澄清石灰水反应的离子方程式为
(6)实验II中,滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,原因是滴加NaHCO3溶液的烧杯中,参与反应的离子有
您最近一年使用:0次
解题方法
3 . 钠与水反应、铁与水蒸气反应的实验装置图如下。
下列说法不正确 的是
Ⅰ.钠与水反应 | Ⅱ.铁与水蒸气反应 |
|
|
| A.Ⅰ中钠熔化成小球说明反应放热和钠的熔点低 |
B.Ⅰ中钠与水反应的离子方程式: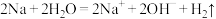 |
| C.Ⅱ中有肥皂泡产生说明有H2生成 |
D.Ⅱ中铁与水蒸气反应的化学方程式: |
您最近一年使用:0次
解题方法
4 . 实验小组对Mg与NH4Cl溶液的反应进行探究。
(1)用pH计测定1.0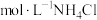 溶液约为4.6,分析NH4Cl溶液呈酸性的原因
溶液约为4.6,分析NH4Cl溶液呈酸性的原因______ (用化学用语表示)。
(2)探究镁与NH4Cl溶液的反应:实验Ⅰ、Ⅱ所取镁粉质量均为0.5g,分别加入选取的实验试剂中。
①实验Ⅰ中发生反应的化学方程式为______ 。
②经检验实验Ⅱ中刺激性气味气体为NH3和H2的混合气体,用平衡移动原理解释产生NH3的原因______ 。
③已知灰白色沉淀中含有Mg2+、OH-。为研究固体成分,进行实验:将生成的灰白色固体洗涤数次,至洗涤液中滴加AgNO3溶液后无明显浑浊。将洗涤后的固体溶于稀HNO3,再滴加AgNO3溶液,出现白色沉淀。推测沉淀中含有______ ,灰白色固体可能是______ (填化学式)。
④针对实验Ⅱ比实验Ⅰ反应剧烈的原因,小组同学提出了两种假设:
假设l:NH4Cl溶液中的H+溶解了Mg(OH)2;
假设2:NH4Cl溶液中的 溶解了Mg(OH)2。
溶解了Mg(OH)2。
为证明假设的合理性.小组同学做了如下对比实验:
实验结论是______ 。
(3)甲同学通过深入思考,认为Mg与NH4Cl溶液反应剧烈.可能还与 有关.并通过设计实验,证明了猜想的正确性.他设计的实验方案和实验证据为
有关.并通过设计实验,证明了猜想的正确性.他设计的实验方案和实验证据为______ 。
(4)由上述实验得出的结论是______ 。
(1)用pH计测定1.0
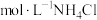 溶液约为4.6,分析NH4Cl溶液呈酸性的原因
溶液约为4.6,分析NH4Cl溶液呈酸性的原因(2)探究镁与NH4Cl溶液的反应:实验Ⅰ、Ⅱ所取镁粉质量均为0.5g,分别加入选取的实验试剂中。
实验 | 实验试剂 | 实验现象 |
Ⅰ | 5mL蒸馏水 | 反应缓慢,有少量气泡产生(经检验为H2) |
Ⅱ | 5mL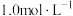 NH4Cl溶液(pH=4.6) | 剧烈反应,产生刺激性气味气体和灰白色难溶固体 |
②经检验实验Ⅱ中刺激性气味气体为NH3和H2的混合气体,用平衡移动原理解释产生NH3的原因
③已知灰白色沉淀中含有Mg2+、OH-。为研究固体成分,进行实验:将生成的灰白色固体洗涤数次,至洗涤液中滴加AgNO3溶液后无明显浑浊。将洗涤后的固体溶于稀HNO3,再滴加AgNO3溶液,出现白色沉淀。推测沉淀中含有
④针对实验Ⅱ比实验Ⅰ反应剧烈的原因,小组同学提出了两种假设:
假设l:NH4Cl溶液中的H+溶解了Mg(OH)2;
假设2:NH4Cl溶液中的
 溶解了Mg(OH)2。
溶解了Mg(OH)2。为证明假设的合理性.小组同学做了如下对比实验:
实验 | 实验方案 | 实验现象 |
Ⅲ | 取2根覆盖了Mg(OH)2的Mg条,分别同时放入相同体积相同pH的盐酸和饱和NH4Cl溶液中。 | 饱和NH4Cl溶液中反应更剧烈。 |
Ⅳ | 向饱和NH4Cl溶液中滴加浓氨水,使溶液呈中性或略显碱性,再放入覆盖了Mg(OH)2的镁条。 | 剧烈反应,但是比实验Ⅲ饱和NH4Cl溶液略慢,产生刺激性气味气体和灰白色难溶固体。 |
(3)甲同学通过深入思考,认为Mg与NH4Cl溶液反应剧烈.可能还与
 有关.并通过设计实验,证明了猜想的正确性.他设计的实验方案和实验证据为
有关.并通过设计实验,证明了猜想的正确性.他设计的实验方案和实验证据为(4)由上述实验得出的结论是
您最近一年使用:0次
2024-01-24更新
|
83次组卷
|
2卷引用:北京市顺义区2023-2024学年高二上学期期末质量监测化学试题
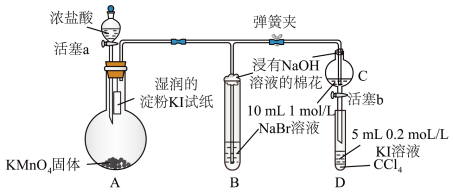
5 . 实验小组用如图装置探究 、
、 、
、 的氧化性强弱(夹持装置和加热装置已省略,气密性已检验)。
的氧化性强弱(夹持装置和加热装置已省略,气密性已检验)。 遇淀粉溶液变蓝
遇淀粉溶液变蓝
实验过程:
Ⅰ.打开弹簧夹 和
和 ,通入一段时间
,通入一段时间 ,再将导管插入
,再将导管插入 中,继续通入
中,继续通入 一段时间,然后夹紧
一段时间,然后夹紧 ;
;
Ⅱ.打开活塞 ,滴加一定量浓盐酸后关闭活塞
,滴加一定量浓盐酸后关闭活塞 ,给
,给 加热;
加热;
Ⅲ.当 中的溶液变为黄色时,停止加热,夹紧
中的溶液变为黄色时,停止加热,夹紧 ;
;
Ⅳ.打开活塞 ,将少量
,将少量 中溶液滴入
中溶液滴入 中,关闭活塞
中,关闭活塞 。
。
(1) 中发生反应的化学方程式是
中发生反应的化学方程式是______ 。
(2)浸有 溶液的棉花上发生反应的离子方程式是
溶液的棉花上发生反应的离子方程式是______ 。
(3) 中溶液变黄说明氧化性
中溶液变黄说明氧化性 ,反应的离子方程式是
,反应的离子方程式是______ 。
(4)为探究 和
和 的氧化性强弱,甲、乙、丙三位同学分别完成了上述实验,并检测
的氧化性强弱,甲、乙、丙三位同学分别完成了上述实验,并检测 中黄色溶液和
中黄色溶液和 中混合溶液中的
中混合溶液中的部分 微粒,结果如表所示(忽略空气中 的影响)。
的影响)。
①检验 中黄色溶液中含有
中黄色溶液中含有 的试剂是
的试剂是______ 。
②进一步检验 的实验操作及现象是
的实验操作及现象是______ 。
③能证明该实验条件下氧化性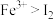 的有
的有______ (填“甲”“乙”或“丙”)。不能证明的请说明理由:______ 。
 、
、 、
、 的氧化性强弱(夹持装置和加热装置已省略,气密性已检验)。
的氧化性强弱(夹持装置和加热装置已省略,气密性已检验)。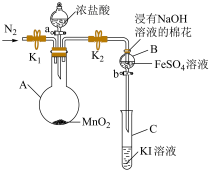
 遇淀粉溶液变蓝
遇淀粉溶液变蓝实验过程:
Ⅰ.打开弹簧夹
 和
和 ,通入一段时间
,通入一段时间 ,再将导管插入
,再将导管插入 中,继续通入
中,继续通入 一段时间,然后夹紧
一段时间,然后夹紧 ;
;Ⅱ.打开活塞
 ,滴加一定量浓盐酸后关闭活塞
,滴加一定量浓盐酸后关闭活塞 ,给
,给 加热;
加热;Ⅲ.当
 中的溶液变为黄色时,停止加热,夹紧
中的溶液变为黄色时,停止加热,夹紧 ;
;Ⅳ.打开活塞
 ,将少量
,将少量 中溶液滴入
中溶液滴入 中,关闭活塞
中,关闭活塞 。
。(1)
 中发生反应的化学方程式是
中发生反应的化学方程式是(2)浸有
 溶液的棉花上发生反应的离子方程式是
溶液的棉花上发生反应的离子方程式是(3)
 中溶液变黄说明氧化性
中溶液变黄说明氧化性 ,反应的离子方程式是
,反应的离子方程式是(4)为探究
 和
和 的氧化性强弱,甲、乙、丙三位同学分别完成了上述实验,并检测
的氧化性强弱,甲、乙、丙三位同学分别完成了上述实验,并检测 中黄色溶液和
中黄色溶液和 中混合溶液中的
中混合溶液中的 的影响)。
的影响)。
|
| |
甲 | 既有 | 有 |
乙 | 有 | 有 |
丙 | 有 | 有 |
 中黄色溶液中含有
中黄色溶液中含有 的试剂是
的试剂是②进一步检验
 的实验操作及现象是
的实验操作及现象是③能证明该实验条件下氧化性
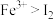 的有
的有
您最近一年使用:0次
2024-01-20更新
|
137次组卷
|
2卷引用:北京市西城区2023-2024学年高一上学期期末考试化学试卷
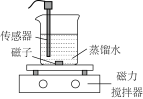
6 . 常温下,某小组同学用如下实验探究 的沉淀溶解平衡
的沉淀溶解平衡
已知:酚酞的变色范围:pH<8.2无色;8.2≤pH≤10.0粉红色;pH>10红色
下列说法不正确 的是
 的沉淀溶解平衡
的沉淀溶解平衡实验装置 |
| |
实验序号 | Ⅰ | Ⅱ |
| 传感器种类 | 导电率传感器 | pH传感器 |
| 实验操作 | 向蒸馏水中加入足量的 粉末,一段时间后再加蒸馏水 粉末,一段时间后再加蒸馏水 | 向滴有酚酞的蒸馏水中加入 粉末,隔一段时间后,再向所得悬浊液中加入一定量稀硫酸 粉末,隔一段时间后,再向所得悬浊液中加入一定量稀硫酸 |
| 实验数据 |  | 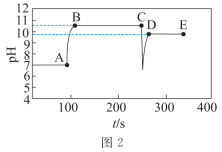 |
下列说法
A.图1中a点导电率不为0的原因是: |
B.图1中d点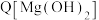 小于 小于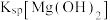 |
| C.实验Ⅱ中,溶液颜色先变红,后变为无色,最后溶液呈粉红色 |
D.实验Ⅱ中:加入 的物质的量小于加入硫酸的物质的量 的物质的量小于加入硫酸的物质的量 |
您最近一年使用:0次
2024-01-20更新
|
73次组卷
|
2卷引用:北京市顺义区2023-2024学年高二上学期期末质量监测化学试题
7 . 某化学小组以铜为阳极、石墨为阴极,研究在不同的电解质溶液中铜被氧化的价态及产物。实验装置如图所示(电源装置略去)。

资料:i.Cu2O为砖红色,CuCl为白色,CuOH为黄色且易分解
ii.[Cu(NH3)2]+为无色,在空气中易被氧化为深蓝色[Cu(NH3)4]2+
iii.25 ℃时,Ksp(CuCl)=1.2×10-6,Ksp(CuOH)= 1.2×10-14
实验记录如下:
(1)I中铜电极的电极反应式是___________ 。
(2)II中沉淀由黄色变为砖红色的化学方程式是___________ 。
(3)将III中所得白色沉淀过滤,充分洗涤,进行下列实验,证实该沉淀为CuCl。

①证明III中所得白色沉淀中有Cu+的证据是___________ 。
②步骤iii的操作是___________ 。
(4)III中下端白色沉淀最终变为砖红色的原因是:白色沉淀为CuCl,___________ ,CuOH不稳定易分解为砖红色的Cu2O。
(5)IV中Cu未被氧化的原因是________ 。
(6)综上,铜被氧化的价态及产物与________ 有关。

资料:i.Cu2O为砖红色,CuCl为白色,CuOH为黄色且易分解
ii.[Cu(NH3)2]+为无色,在空气中易被氧化为深蓝色[Cu(NH3)4]2+
iii.25 ℃时,Ksp(CuCl)=1.2×10-6,Ksp(CuOH)= 1.2×10-14
实验记录如下:
| 实验 | 电解质溶液(3 mol/L) | 现象 | |
| 铜电极附近 | 石墨电极 | ||
| I | H2SO4 | 溶液变蓝 | 产生无色气泡,一段时间后有少量红色金属析出 |
| II | NaOH | 出现黄色浑浊,很快变为砖红色 | 产生无色气泡 |
| III | NaCl | 出现白色浑浊,浑浊向下扩散,一段时间后,下端白色沉淀变黄,最终为砖红色 | 产生无色气泡 |
| IV | KI | 迅速产生棕褐色的物质,滴入1 滴淀粉溶液, 立即变为蓝色;取出铜电极洗净检验,无变化 | 产生无色气泡 |
(2)II中沉淀由黄色变为砖红色的化学方程式是
(3)将III中所得白色沉淀过滤,充分洗涤,进行下列实验,证实该沉淀为CuCl。

①证明III中所得白色沉淀中有Cu+的证据是
②步骤iii的操作是
(4)III中下端白色沉淀最终变为砖红色的原因是:白色沉淀为CuCl,
(5)IV中Cu未被氧化的原因是
(6)综上,铜被氧化的价态及产物与
您最近一年使用:0次
名校
解题方法
8 . 钠及其化合物在认识物质转化规律以及生产生活中均有重要应用。
(1)金属与水的反应
①Na的原子结构示意图是___________ 。
②钠与水反应的化学方程式是___________ 。
③钠与水的反应放出热量的现象是___________ 。
④钠、镁与水均能反应,通过比较反应的难易程度,可知钠的金属性强于镁。
(2)钠、钾失火时,可用不同的灭火剂灭火。如金属钠失火,可用Na2CO3干粉灭火,但不能用NaHCO3灭火,结合反应方程式说明原因___________ 。
(3)Na2CO3和NaHCO3是两种常见的钠盐。下列关于Na2CO3和NaHCO3的说法中,正确的是___________ (填字母)。
a.Na2CO3和NaHCO3的溶液均显碱性
b.相同温度下,NaHCO3的溶解度大于Na2CO3
c.向等质量的Na2CO3和NaHCO3固体中分别滴加足量的盐酸,相同条件下产生CO2的体积也相同
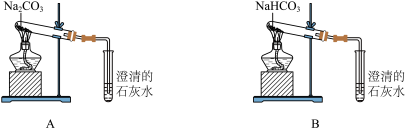
(4)按下图所示装置实验,可得到“Na2CO3的热稳定性比NaHCO3强”的结论,证据是________ 。
(1)金属与水的反应

①Na的原子结构示意图是
②钠与水反应的化学方程式是
③钠与水的反应放出热量的现象是
④钠、镁与水均能反应,通过比较反应的难易程度,可知钠的金属性强于镁。
(2)钠、钾失火时,可用不同的灭火剂灭火。如金属钠失火,可用Na2CO3干粉灭火,但不能用NaHCO3灭火,结合反应方程式说明原因
(3)Na2CO3和NaHCO3是两种常见的钠盐。下列关于Na2CO3和NaHCO3的说法中,正确的是
a.Na2CO3和NaHCO3的溶液均显碱性
b.相同温度下,NaHCO3的溶解度大于Na2CO3
c.向等质量的Na2CO3和NaHCO3固体中分别滴加足量的盐酸,相同条件下产生CO2的体积也相同
(4)按下图所示装置实验,可得到“Na2CO3的热稳定性比NaHCO3强”的结论,证据是

您最近一年使用:0次
9 . 为验证卤素单质氧化性:Cl2>Br2>I2,某小组用下图所示装置进行实验。(夹持仪器已略去,气密性已检验)
资料: i.CCl4为无色液体,与水不互溶;
ii.Cl2、Br2、I2均易溶于CCl4液体,溶液颜色分别为浅黄绿色、橙黄色和紫红色。
实验过程:
I.打开弹簧夹,打开活塞a,滴加浓盐酸。
II.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
III.当B中溶液由黄色变为棕红色时,关闭活塞a。
IV.……
(1)A中产生黄绿色气体,离子方程式为___________ 。
(2)验证氯气的氧化性强于碘的实验现象是___________ 。
(3)B中溶液发生反应的离子方程式是___________ 。
(4)为验证溴的氧化性强于碘,过程IV的操作和现象是___________ 。
(5)过程III实验的目的是___________ 。

资料: i.CCl4为无色液体,与水不互溶;
ii.Cl2、Br2、I2均易溶于CCl4液体,溶液颜色分别为浅黄绿色、橙黄色和紫红色。
实验过程:
I.打开弹簧夹,打开活塞a,滴加浓盐酸。
II.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
III.当B中溶液由黄色变为棕红色时,关闭活塞a。
IV.……
(1)A中产生黄绿色气体,离子方程式为
(2)验证氯气的氧化性强于碘的实验现象是
(3)B中溶液发生反应的离子方程式是
(4)为验证溴的氧化性强于碘,过程IV的操作和现象是
(5)过程III实验的目的是
您最近一年使用:0次
2023-12-15更新
|
146次组卷
|
3卷引用:北京师范大学2023--2024学年附属实验中学高一上学期化学12月统练
名校
解题方法
10 . 研究小组探究 与水反应。取
与水反应。取 粉末加入到
粉末加入到 水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。
水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。
下列说法不正确的是
 与水反应。取
与水反应。取 粉末加入到
粉末加入到 水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。
水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。编号 | ① | ② | ③ | ④ |
操作 |
|
|
|
|
现象 | 溶液变红色,20秒后褪色 | ⅰ.产生大量能使带火星木条复燃的气体 ⅱ.溶液变红色,10分钟后褪色 | ⅰ.溶液变红色,10分钟后溶液褪色 ⅱ.变红色 | 溶液变红色,2小时后无明显变化 |
A.由②中现象ⅰ可知, 与水反应有 与水反应有 生成 生成 |
B.由③、④可知,②中溶液红色褪去是因为 大 大 |
C.由②、③、④可知,①中溶液红色褪去的主要原因不是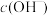 大 大 |
D.向①中褪色后的溶液中滴加5滴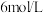 盐酸,溶液最终变成红色 盐酸,溶液最终变成红色 |
您最近一年使用:0次
2023-12-15更新
|
105次组卷
|
21卷引用:北京市海淀区2021届高三上学期期中考试化学试题
北京市海淀区2021届高三上学期期中考试化学试题北京师范大学附属实验中学2020-2021学年高一上学期期末考试化学试题北京一零一中学2021-2022学年高三上学期 9月开学练习化学试题北京交通大学附属中学2021-2022学年高一上学期期中考试化学试题(已下线)北京市第四中学2022-2023学年高一上学期期中考试化学试题北京市首都师范大学附属中学2022-2023学年高一上学期12月月考化学试题北京师范大学附属实验中学2021-2022学年高一上学期1月期末测试化学试题北京市第八中学2022-2023学年高一下学期期末考试化学试题北京市清华大学附属中学2023-2024学年高三上学期开学考试化学(A)试题北京市第二十中学2023-2024学年高一上学期期中考试化学试题北京市第一○一中学2023-2024学年高二上学期12月统练四化学试题北京市日坛中学2023-2024学年高一上学期期中考试化学试题北京市第一○一中学2023-2024学年高二上学期12月统练四化学试题北京师范大学燕化附属中学2023-2024学年高一上学期期中考试化学试卷北京市第一五九中学2023-2024学年高一上学期期中考试化学试题安徽省示范高中培优联盟2020-2021学年高一上学期冬季联赛化学试题四川省德阳市德阳五中2021-2022学年高一上学期期末考试化学试题福建省厦门外国语学校2023-2024学年高一上学期10月第一次月考化学试题天津市第一中学2023-2024学年高一上学期11月期中化学试题河南省唐河县鸿唐高级中学2023-2024学年高三上学期9月月考化学试题山东省菏泽市郓城县第一中学2023-2024学年高一上学期9月月考化学试题