名校
解题方法
1 . 某化学兴趣小组在实验室用除去表面氧化物的铁钉(碳素钢)与浓硫酸共热制取SO2并完成相关性质探究(不考虑水蒸气)。(已知:C+2H2SO4(浓) CO2+2SO2↑+2H2O)
CO2+2SO2↑+2H2O)
(1)有同学认为制得的SO2中可能混有杂质,其化学式为___________ 。
(2)为验证气体成分,兴趣小组同学设计了如图所示装置进行了实验探究。___________ ;装置C中品红溶液的作用是___________ 。
②装置H的作用为___________ 。
(3)兴趣小组设计如图装置验证二氧化硫的化学性质。___________ ;
②为验证SO2的还原性,取试管b中充分反应后的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液加入品红溶液,红色褪去;
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀;
方案Ⅲ:向第三份溶液中加入AgNO3溶液,有白色沉淀生成。
上述方案中合理的是___________ (填Ⅰ、Ⅱ或Ⅲ);试管b中发生反应的离子方程式为___________ 。
 CO2+2SO2↑+2H2O)
CO2+2SO2↑+2H2O)(1)有同学认为制得的SO2中可能混有杂质,其化学式为
(2)为验证气体成分,兴趣小组同学设计了如图所示装置进行了实验探究。

②装置H的作用为
(3)兴趣小组设计如图装置验证二氧化硫的化学性质。

②为验证SO2的还原性,取试管b中充分反应后的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液加入品红溶液,红色褪去;
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀;
方案Ⅲ:向第三份溶液中加入AgNO3溶液,有白色沉淀生成。
上述方案中合理的是
您最近一年使用:0次
2024-02-28更新
|
676次组卷
|
7卷引用:河北省石家庄市河北正定中学2023-2024学年高一下学期第一次月考(3月)化学试题
河北省石家庄市河北正定中学2023-2024学年高一下学期第一次月考(3月)化学试题江西省丰城中学2023-2024学年高一下学期开学化学试题(已下线)专题03 常见气体的实验室制取(考题猜想)(6大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)江西省南昌市第十九中学2023-2024学年高一下学期3月月考化学试题辽宁省长海县高级中学2023-2024下学期第一次月考高一化学试卷湖南省常德市第一中学2023-2024学年高一下学期第一次月考化学试题天津市武清区黄花店中学2023-2024学年高一下学期第一次月考化学试题(理科)
2 . ClO2是一种新型的环保饮用水消毒剂。为了收集ClO2并探究其性质,某课题小组拟选择下列部分装置进行实验(装置不可重复使用):
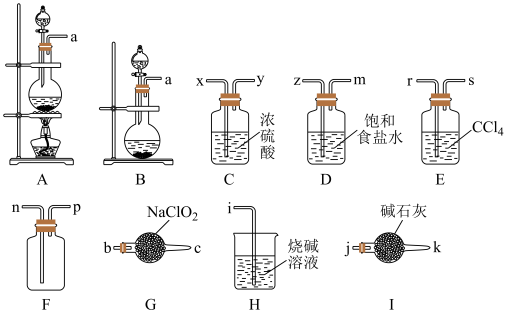
已知:①常温下,NaClO2固体与Cl2反应生成ClO2和NaCl;
②饱和食盐水可除去氯气中混有的氯化氢气体;
③Cl2易溶于有机溶剂,ClO2是一种易溶于水而难溶于有机溶剂的气体,氧化性比氯气强。
回答下列问题:
探究ClO2的制备实验:
(1)实验室中常用二氧化锰与浓盐酸制取氯气,故上述发生装置应选择_____ (填“A”或“B”),该反应的化学方程式为________ 。
(2)用上图装置制备二氧化氯:导管口连接顺序为:__________ ,a→___→__→___→___→___→___→___→___→n→p→j;本实验选择装置I而不选择装置H的原因是:___________ 。写出装置G中发生反应的化学方程式:___________ 。
(3)探究ClO2与少量Na2S的反应:
将上述收集到的ClO2用N2稀释以增强其稳定性,并将适量的稀释后的C1O2通入如图所示装置中充分反应,得到无色澄清溶液。
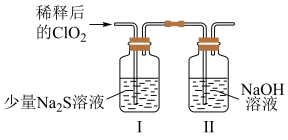
一段时间后,通过下列实验探究I中反应的产物(已知:二氧化硫或亚硫酸能使品红溶液褪色)。
③若C1O2中氯元素被还原为Cl-,则ClO2与少量Na2S反应的离子方程式为___________ 。

已知:①常温下,NaClO2固体与Cl2反应生成ClO2和NaCl;
②饱和食盐水可除去氯气中混有的氯化氢气体;
③Cl2易溶于有机溶剂,ClO2是一种易溶于水而难溶于有机溶剂的气体,氧化性比氯气强。
回答下列问题:
探究ClO2的制备实验:
(1)实验室中常用二氧化锰与浓盐酸制取氯气,故上述发生装置应选择
(2)用上图装置制备二氧化氯:导管口连接顺序为:
(3)探究ClO2与少量Na2S的反应:
将上述收集到的ClO2用N2稀释以增强其稳定性,并将适量的稀释后的C1O2通入如图所示装置中充分反应,得到无色澄清溶液。

一段时间后,通过下列实验探究I中反应的产物(已知:二氧化硫或亚硫酸能使品红溶液褪色)。
| 操作步骤 | 实验现象 | 结论 |
| 取少量I中反应后的溶液放入试管甲中,滴加品红溶液和盐酸 | 品红溶液始终不褪色 | ①无 |
| 另取少量I中反应后的溶液放入试管乙中,加入Ba(OH)2溶液振荡 | ② | 有 生成 生成 |
您最近一年使用:0次
名校
解题方法
3 . 下列是某兴趣小组根据课本实验设计的一个能说明Na2CO3与NaHCO3热稳定性的套管实验。请观察如图实验装置并分析实验原理,判断下列说法错误的是
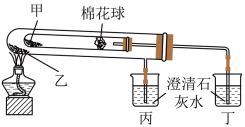
| A.Na2CO3热稳定性大于NaHCO3 |
| B.甲为Na2CO3,乙为NaHCO3 |
| C.要证明物质受热能产生水,可在两支试管内塞上沾有无水硫酸铜粉末的棉花球 |
| D.整个实验过程中可以看到丙烧杯的澄清石灰水不变浑浊 |
您最近一年使用:0次
2024-01-16更新
|
107次组卷
|
4卷引用:河北省石家庄市第一中学西校区2023-2024高一上学期期末考试化学试题
名校
4 . 模拟氨催化氧化法制硝酸的装置如图所示(无水CaCl2可用于吸收氨气),下列说法错误的是
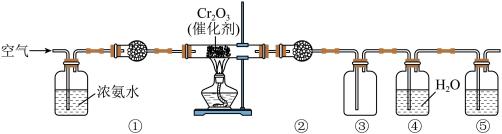
| A.装置①、②、⑤依次盛装碱石灰、无水CaCl2、NaOH溶液 |
| B.装置③中气体呈红棕色 |
| C.通空气的主要作用是鼓出氨气,空气可用N2代替 |
| D.装置④中溶液可使紫色石蕊溶液变红,说明有HNO3生成 |
您最近一年使用:0次
2023-06-27更新
|
558次组卷
|
5卷引用:河北省邢台市清河中学2023-2024学年高一下学期第一次月考化学试题
5 . 某实验小组学习了乙醇的化学性质后,在老师的指导下设计了如下实验验证课堂所学的乙醇的化学性质。下列说法错误的是
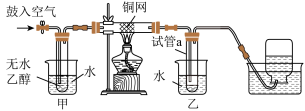
| A.甲、乙烧杯中均为78℃以上的热水 | B.铜网降低了乙醇和氧气反应的活化能 |
| C.试管a中得到的溶液可能使锌粒溶解 | D.铜网上出现红色和黑色交替现象 |
您最近一年使用:0次
名校
解题方法
6 . 实验室用如下图所示装置探究 与
与 溶液的反应(实验前先通入
溶液的反应(实验前先通入 排除装置中的空气)。下列说法不正确的是
排除装置中的空气)。下列说法不正确的是
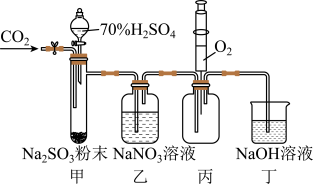
 与
与 溶液的反应(实验前先通入
溶液的反应(实验前先通入 排除装置中的空气)。下列说法不正确的是
排除装置中的空气)。下列说法不正确的是
A.用装置甲产生 |
B.装置乙中无明显现象,则 与 与 未发生反应 未发生反应 |
C.装置丙中注入 ,产生红棕色气体,说明装置乙中 ,产生红棕色气体,说明装置乙中 发生了氧化反应 发生了氧化反应 |
| D.装置丁吸收尾气并防止空气进入装置丙 |
您最近一年使用:0次
2023-03-23更新
|
1374次组卷
|
7卷引用:专题12 化学实验基础
2014高三·全国·专题练习
名校
解题方法
7 . 某兴趣小组为了探究SO2气体还原Fe3+的反应,他们使用的药品和装置如下图所示,下列说法不合理的是
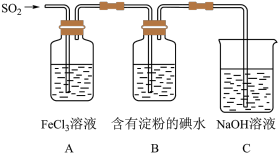
| A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色 |
| B.装置C的作用是吸收SO2尾气,防止污染空气 |
| C.为了验证A中发生了氧化还原反应,加入酸性KMnO4溶液,紫色褪去 |
| D.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀 |
您最近一年使用:0次
2023-02-21更新
|
957次组卷
|
56卷引用:2015-2016学年河北石家庄一中高一下学情反馈一化学卷
2015-2016学年河北石家庄一中高一下学情反馈一化学卷2017届河北省衡水中学高三上期中化学卷河北省衡水市桃城区第十四中学2019-2020学年高一下学期第五次综合测试化学试题(已下线)2014年高考化学鲁科版3.3硫的转化练习卷2015-2016学年黑龙江省大庆铁人中学高一上期末化学试卷2015-2016学年吉林省松原市油田高中高二下期末化学试卷2017届广东省中山一中高三上学期第一次统测化学试卷2017届黑龙江省牡丹江高级中学高三10月月考化学卷2017届山东省莱芜一中高三上学期10月月考化学试卷2017届河南省南阳一中高三上第三次周考化学卷福建省泰宁第一中学2018届高三上学期第一阶段考试化学试题宁夏石嘴山市第三中学2018届高三上学期期中考试化学试题(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第3讲 硫及其化合物【押题专练】(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第3讲 硫及其化合物【教学案】【全国百强校】黑龙江省牡丹江市第一高级中学2019届高三上学期期中考试化学试题山东省东营市第二中学2019届高三上学期模块考试(期中)化学试题贵州省剑河县第二中学2018-2019学年高一上学期12月份考试化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高一上学期期末考试化学试题甘肃省甘谷第一中学2020届高三上学期第一次检测化学试题云南省西畴县二中2019-2020学年高二上学期开学考试化学试题安徽省滁州市定远县重点中学2018-2019学年高一上学期期末考试化学试题苏教版高中化学必修1专题4《硫 氮可持续发展》测试卷云南省丽江市宁蒗县第一中学2019—2020学年高一上学期期末考试化学试题云南省曲靖市罗平县第三中学2019-2020学年高一上学期期末考试化学试题云南省曲靖市沾益县炎方一中2019-2020学年高一上学期期末考试化学试题河南省商丘市第一高级中学2020届高三上学期期中考试化学试题河南省开封市第二十五中2019-2020高一下学期初分科考试化学试卷(已下线)专题4.3 硫及其化合物(练)——2020年高考化学一轮复习讲练测(已下线)第四单元 非金属及其化合物测试题-2021年高考化学一轮复习名师精讲练(已下线)第15讲 硫及其化合物(精练)-2021年高考化学一轮复习讲练测福建省福州市闽江口联盟校2021届高三上学期期中联考化学试题(已下线)练习9 硫和二氧化硫-2020-2021学年【补习教材·寒假作业】高一化学(人教版2019)浙江省温州市瑞安市上海新纪元高级中学2021-2022学年高一9月份月考(5-6班)化学试题(已下线)4.2.1 含硫物质之间的转化(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)河南省林州市第一中学2021-2022学年高一下学期开学检测化学试题课后-5.1.3 不同价态含硫物质的转化-人教2019必修第二册广东省佛山市第一中学2021-2022学年高一下学期第一次段考(3月)化学试题湖南省常德市安乡县第一中学2021-2022 学年高二下学期期中考试化学试题湖南省湘潭市湘潭县第一中学2021-2022学年高三下学期期中考试化学试题上海交通大学附属中学2022-2023学年高二上学期开学摸底考试化学试题湖北省公安县第三中学2021-2022学年高三上学期8月质量检测化学试题安徽省宿州市第二中学2022-2023学年高一上学期第一次月考化学试题安徽省阜阳市第一中学2022-2023学年高一下学期第一次月考化学试题安徽省安庆市第一中学2022-2023学年高一下学期第一次月考化学试题安徽省亳州市第一中学2022-2023学年高一下学期第一次月考化学试题河南省郑州外国语学校2022-2023学年高一下学期第一次月考化学试题安徽省阜阳市太和中学2022-2023学年高一下学期第一次质量检测化学试题四川省广安市育才学校2022-2023学年高一下学期3月月考化学试题广东省广州市培英中学2022-2023学年高一下学期期中考试化学试题湖南省衡阳县第四中学2022-2023学年高一下学期第一次(3月)月考化学试题湖南省株洲市炎陵县2022-2023学年高一下学期3月月考化学试题安徽省淮北市树人高级中学2023-2024学年高一下学期开学考试化学试题北京师范大学第二附属中学2023-2024学年高一下学期3月化学测试题安徽省芜湖市第一中学2022-2023学年高一下学期3月份教学质量诊断测试化学试卷山西省大同市第一中学校2023-2024学年高一下学期4月期中考试化学试题云南省丽江润泽高级中学2023-2024学年高一下学期3月月中考试化学试题
名校
解题方法
8 . 某小组探究S单质与 溶液加热后得到的产物。向5
溶液加热后得到的产物。向5
 溶液中加入少量硫粉,加热至固体全部溶解,冷却后,得到淡黄色溶液A(
溶液中加入少量硫粉,加热至固体全部溶解,冷却后,得到淡黄色溶液A( )。
)。
【资料】1. 溶液无色,
溶液无色, 能与
能与 反应生成
反应生成 (臭鸡蛋气味气体),能与
(臭鸡蛋气味气体),能与 反应生成
反应生成 (黑色固体)。
(黑色固体)。
2.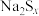 溶液呈黄色,
溶液呈黄色,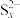 能与
能与 反应生成S和
反应生成S和 ,能与
,能与 反应生成S和
反应生成S和 。
。
3. 和
和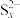 均不能使品红褪色,
均不能使品红褪色, 或高浓度
或高浓度 能使品红褪色。
能使品红褪色。
(1)如图所示,进行实验I和Ⅱ,证实了产物中含 。
。

①补全实验Ⅱ的方案_______ (在横线上填写试剂)。
②证实产物中含 的现象是
的现象是_______ 。
(2)依据产物中含 ,甲同学认为产物还应该有
,甲同学认为产物还应该有 ,请依据氧化还原反应的规律进行解释:
,请依据氧化还原反应的规律进行解释:_______ 。
(3)甲同学推测溶液A中可能还含有 ,因为
,因为 在加热过程中可能与空气中氧气反应。
在加热过程中可能与空气中氧气反应。
针对此观点继续实验Ⅲ:取溶液A于试管中,加入足量稀盐酸,立即出现淡黄色浑浊,同时产生臭鸡蛋气味的气体,离心沉淀(固液分离),得到无色溶液B和淡黄色固体。取无色溶液B,_______ (填操作和现象),证实溶液A中存在 。
。
(4)甲同学根据溶液A呈淡黄色猜想其中还存在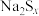 ,并认为实验Ⅲ中的现象可做为证据。但乙同学认为实验Ⅲ中的现象不能说明,理由是
,并认为实验Ⅲ中的现象可做为证据。但乙同学认为实验Ⅲ中的现象不能说明,理由是_______ 。
(5)继续进行实验Ⅳ,验证了溶液A中存在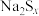 。
。
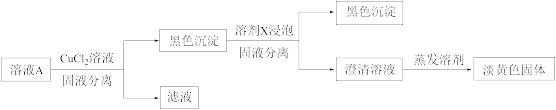
①溶剂X是_______ (填化学式)。
②证明溶液中含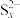 的实验证据是
的实验证据是_______ 。
进一步实验,得到结论:硫单质在碱性条件下歧化反应的产物主要为 和
和 ,溶液中还会生成少量的
,溶液中还会生成少量的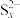 、
、 和
和 。
。
 溶液加热后得到的产物。向5
溶液加热后得到的产物。向5
 溶液中加入少量硫粉,加热至固体全部溶解,冷却后,得到淡黄色溶液A(
溶液中加入少量硫粉,加热至固体全部溶解,冷却后,得到淡黄色溶液A( )。
)。【资料】1.
 溶液无色,
溶液无色, 能与
能与 反应生成
反应生成 (臭鸡蛋气味气体),能与
(臭鸡蛋气味气体),能与 反应生成
反应生成 (黑色固体)。
(黑色固体)。2.
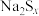 溶液呈黄色,
溶液呈黄色,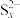 能与
能与 反应生成S和
反应生成S和 ,能与
,能与 反应生成S和
反应生成S和 。
。3.
 和
和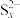 均不能使品红褪色,
均不能使品红褪色, 或高浓度
或高浓度 能使品红褪色。
能使品红褪色。(1)如图所示,进行实验I和Ⅱ,证实了产物中含
 。
。
①补全实验Ⅱ的方案
②证实产物中含
 的现象是
的现象是(2)依据产物中含
 ,甲同学认为产物还应该有
,甲同学认为产物还应该有 ,请依据氧化还原反应的规律进行解释:
,请依据氧化还原反应的规律进行解释:(3)甲同学推测溶液A中可能还含有
 ,因为
,因为 在加热过程中可能与空气中氧气反应。
在加热过程中可能与空气中氧气反应。针对此观点继续实验Ⅲ:取溶液A于试管中,加入足量稀盐酸,立即出现淡黄色浑浊,同时产生臭鸡蛋气味的气体,离心沉淀(固液分离),得到无色溶液B和淡黄色固体。取无色溶液B,
 。
。(4)甲同学根据溶液A呈淡黄色猜想其中还存在
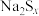 ,并认为实验Ⅲ中的现象可做为证据。但乙同学认为实验Ⅲ中的现象不能说明,理由是
,并认为实验Ⅲ中的现象可做为证据。但乙同学认为实验Ⅲ中的现象不能说明,理由是(5)继续进行实验Ⅳ,验证了溶液A中存在
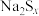 。
。
①溶剂X是
②证明溶液中含
 的实验证据是
的实验证据是进一步实验,得到结论:硫单质在碱性条件下歧化反应的产物主要为
 和
和 ,溶液中还会生成少量的
,溶液中还会生成少量的 、
、 和
和 。
。
您最近一年使用:0次
2023-01-06更新
|
675次组卷
|
3卷引用:河北省保定市部分学校2023-2024学年高一上学期1月月考化学试题
9 . 某同学研究 和
和 溶液的反应。
溶液的反应。
资料:一定条件下, 和
和 都可以被氧化成
都可以被氧化成 。
。
实验一:
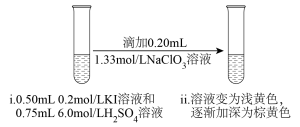
(1)取实验一ⅱ中的溶液于试管中,滴加硝酸银溶液,产生白色沉淀,经检验白色沉淀中含有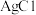 。写出实验一反应的离子方程式
。写出实验一反应的离子方程式___________ 。
实验二:取实验一ⅱ中溶液,进行如下实验。
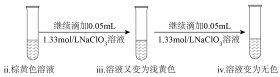
(2)探究溶液棕黄色褪去的原因
①重复实验二操作,并在实验过程中做如下对比实验:
a、将湿润淀粉 试纸置于ⅱ试管口,实验过程中,试纸逐渐变蓝。
试纸置于ⅱ试管口,实验过程中,试纸逐渐变蓝。
b、将湿润的淀粉试纸置于ⅱ试管口,实验过程中,试纸始终没有明显变化。
此对比实验的目的是___________ 。
②取少量ⅳ中的无色溶液进行以下实验,证实其中含有 。
。
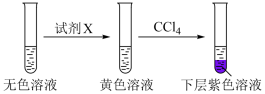
其中试剂X可以是___________ (填标号)。
a、碘水b、 溶液c、
溶液c、 溶液
溶液
③请写出棕黄色溶液褪色时发生反应的离子方程式___________ 。
综上可知, 和
和 溶液产物的生成与反应物的用量有关。
溶液产物的生成与反应物的用量有关。
 和
和 溶液的反应。
溶液的反应。资料:一定条件下,
 和
和 都可以被氧化成
都可以被氧化成 。
。实验一:

(1)取实验一ⅱ中的溶液于试管中,滴加硝酸银溶液,产生白色沉淀,经检验白色沉淀中含有
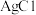 。写出实验一反应的离子方程式
。写出实验一反应的离子方程式实验二:取实验一ⅱ中溶液,进行如下实验。

(2)探究溶液棕黄色褪去的原因
①重复实验二操作,并在实验过程中做如下对比实验:
a、将湿润淀粉
 试纸置于ⅱ试管口,实验过程中,试纸逐渐变蓝。
试纸置于ⅱ试管口,实验过程中,试纸逐渐变蓝。b、将湿润的淀粉试纸置于ⅱ试管口,实验过程中,试纸始终没有明显变化。
此对比实验的目的是
②取少量ⅳ中的无色溶液进行以下实验,证实其中含有
 。
。
其中试剂X可以是
a、碘水b、
 溶液c、
溶液c、 溶液
溶液③请写出棕黄色溶液褪色时发生反应的离子方程式
综上可知,
 和
和 溶液产物的生成与反应物的用量有关。
溶液产物的生成与反应物的用量有关。
您最近一年使用:0次
2023-01-06更新
|
263次组卷
|
3卷引用:河北省邯郸市魏县2022-2023学年高一上学期1月期末测试化学试题
10 . 用如图所示装置进行Fe与水蒸气反应的实验,下列有关说法正确的是

| A.实验时,先点燃酒精喷灯再点燃酒精灯 |
| B.反应中H2O作氧化剂,发生反应的化学方程式为2Fe+3H2O=Fe2O3+3H2 |
| C.干燥管中加入的固体干燥剂可以是无水氯化钙 |
| D.收集反应产生的气体选用装置② |
您最近一年使用:0次
2022-07-18更新
|
1162次组卷
|
13卷引用:河北省衡水市第十四中学2020-2021学年高一下学期摸底考试化学试题
河北省衡水市第十四中学2020-2021学年高一下学期摸底考试化学试题湖北省十堰市2020-2021学年高一上学期期末考试化学试题吉林省磐石一中、伊通一中、梅河口五中、四平一中等2020-2021学年高一上学期期末考试化学试题安徽省皖西南联盟2020-2021学年高一上学期期末考试化学试题江西省抚州市2020-2021学年高一上学期学生学业发展水平测试(期末考试) 化学(B卷) 试题(已下线)新人教必修1第3章第一节第1课时铁的单质(课后)(已下线)《新教材变化解读及考法剖析 》(人教版2019必修第一册)第三章黑龙江省哈尔滨师范大学附属中学2021-2022学年高一下学期期末考试化学试题(已下线)第三章 铁 金属材料(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)福建省龙岩第一中学2022-2023学年高一上学期第二次月考化学试题(已下线)考点巩固卷03 金属及其化合物(4大考点48题)-2024年高考化学一轮复习考点通关卷(新高考通用)吉林省吉林市第一中学2023-2024学年高一上学期11月期中化学试题(已下线)【定心卷】3.1.1 铁的单质随堂练习-人教版2023-2024学年必修第一册



