1 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
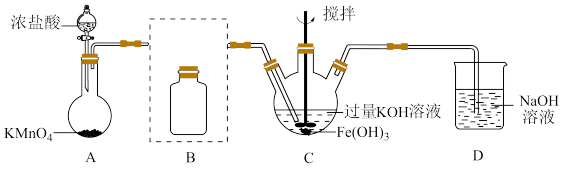
①A为氯气发生装置。A中反应方程式是________________ (锰被还原为Mn2+)。
②将除杂装置B补充完整并标明所用试剂。_______
③C中得到紫色固体和溶液,C中Cl2发生的反应有
3Cl2+2Fe(OH)3+10KOH 2K2FeO4+6KCl+8H2O,另外还有
2K2FeO4+6KCl+8H2O,另外还有________________ 。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
Ⅰ.由方案Ⅰ中溶液变红可知a中含有______ 离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________ 产生(用方程式表示)。
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是________________ 。
②根据K2FeO4的制备实验得出:氧化性Cl2________  (填“>”或“<”),而方案Ⅱ实验表明,Cl2和
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是________________ 。
③资料表明,酸性溶液中的氧化性 >
> ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性 >
> 。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:________________ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中反应方程式是
②将除杂装置B补充完整并标明所用试剂。
③C中得到紫色固体和溶液,C中Cl2发生的反应有
3Cl2+2Fe(OH)3+10KOH
 2K2FeO4+6KCl+8H2O,另外还有
2K2FeO4+6KCl+8H2O,另外还有(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是
②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),而方案Ⅱ实验表明,Cl2和
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是③资料表明,酸性溶液中的氧化性
 >
> ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性 >
> 。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
您最近一年使用:0次
2018-06-09更新
|
9672次组卷
|
31卷引用:2018年全国普通高等学校招生统一考试化学(北京卷)
2018年全国普通高等学校招生统一考试化学(北京卷)北京一零一中学2023-2024学年高一上学期11月统练三化学试卷(已下线)2018年高考题及模拟题汇编 专题16 化学实验综合题(已下线)高考母题题源18 化学实验设计与探究(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第3讲 铁及其化合物 (教学案)(已下线)2019年高考总复习巅峰冲刺-专题03 氧化还原反应 离子反应应试策略(已下线)《2019年高考总复习巅峰冲刺》专题10 化学实验基础应试策略吉林省吉林市第五十五中学2018-2019学年高二下学期期末考试化学试题(已下线)专题10.3 化学实验方案的设计与评价 (讲)-《2020年高考一轮复习讲练测》宁夏回族自治区吴忠市青铜峡市高级中学2020届高三上学期第二次月考化学试题(已下线)专题3.3 铁及其重要化合物(讲)——2020年高考化学一轮复习讲练测(已下线)专题3.3 铁及其重要化合物(练)——2020年高考化学一轮复习讲练测(已下线)第11讲 铁及其重要化合物(精讲)——2021年高考化学一轮复习讲练测(已下线)专题讲座(三)“铁三角”综合实验题解题策略(精讲)——2021年高考化学一轮复习讲练测高一必修第一册(鲁科2019)第3章 第1节 铁的多样性 高考帮人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物 高考帮河南省洛阳市第一高级中学2021届高三上学期10月月考化学试题(已下线)易错22 气体实验装置的设计-备战2021年高考化学一轮复习易错题(已下线)专题讲座(九) 热点实验综合探究 (精练)-2021年高考化学一轮复习讲练测(已下线)考点32 化学实验方案设计与评价-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第7讲 铁及其化合物(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向14 物质制备探究-备战2022年高考化学一轮复习考点微专题四川省遂宁市射洪中学2021-2022学年高一下学期第一次月考化学试题(强基班)(已下线)第07讲 铁及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第28讲 定性、定量实验(练)-2023年高考化学一轮复习讲练测(新教材新高考)天津市耀华中学2023届高三第一次统练化学试题云南省玉溪市华宁县第二中学2021-2022年高一下学期开学考试化学试题第三章 金属及其化合物 第14讲 铁及其化合物的转化关系(已下线)第一部分 化学综合实验 热点6 物质性质探究实验河北省石家庄二中实验学校2023-2024学年高一上学期12月月考化学试题
2022·北京·高考真题
2 . 某小组同学探究不同条件下氯气与二价锰化合物的反应。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。
ⅱ、浓碱条件下,MnO 可被OH-还原为MnO
可被OH-还原为MnO 。
。
ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
(1)B中试剂是_____ 。
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为_____ 。
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是_____ 。
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO 氧化为MnO
氧化为MnO 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因:_____ ,但通过实验测定溶液的碱性变化很小。
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为_____ ,溶液绿色缓慢加深,原因是MnO2被_____ (填化学式)氧化,可证明实验Ⅲ的悬浊液中氧化剂过量。
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是_____ 。
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:_____ 。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO
 (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。ⅱ、浓碱条件下,MnO
 可被OH-还原为MnO
可被OH-还原为MnO 。
。ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
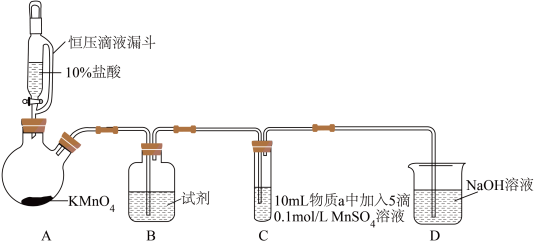
| 实验 | 物质a | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 40%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO
 氧化为MnO
氧化为MnO 。
。①用化学方程式表示可能导致溶液碱性减弱的原因:
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
您最近一年使用:0次
2023-11-29更新
|
830次组卷
|
29卷引用:2022年北京市高考真题化学试题(部分试题)
(已下线)2022年北京市高考真题化学试题(部分试题)2022年北京市高考真题化学试题(已下线)2022年北京高考真题变式题1-14(已下线)2022年北京高考真题化学试题变式题(实验探究题)北京一零一中学2023-2024学年高三上学期11月统练五化学试题北京市日坛中学2023-2024学年高三上学期10月检测化学试题北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)四川省成都市树德中学2022-2023学年高三上学期入学考试理综化学试题(已下线)第28讲 定性、定量实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点09 氯元素及其化合物-备战2023年高考化学考试易错题(已下线)专题三 离子反应-实战高考·二轮复习核心突破突破超重点 高效突破综合实验 实验4 创新探究实验角度1控制变量法探究(已下线)题型46 实验原理探究型综合实验(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 氯气和卤族元素(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)新疆乌鲁木齐市第101中学2022-2023学年高一上学期12月月考化学试题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)微专题 物质性质综合实验探究江苏省苏州市工业园区星海实验高级中学2023-2024学年高一上学期12月调研化学试题山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题
名校
解题方法
3 . 为了探究铁及其化合物的氧化性和还原性,某同学设计如下实验方案,其中符合实验要求且正确的是( )
| 选项 | 实验操作 | 实验现象 | 离子反应 | 实验结论 |
| A | 在氯化亚铁溶液中滴加新制氯水 | 浅绿色溶液变成棕黄色溶液 | 2Fe2++Cl2=2Fe3++2Cl- | Fe2+具有氧化性 |
| B | 在氯化亚铁溶液中加入锌片 | 浅绿色溶液变成无色溶液 | Fe2++Zn=Fe+Zn2+ | Zn具有还原性 |
| C | 在氯化铁溶液中加入铁粉 | 棕黄色溶液变成浅绿色溶液 | Fe3++Fe=2Fe2+ | 铁单质具有还原性 |
| D | 在氯化铁溶液中加入铜粉 | 棕黄色溶液变成蓝色溶液 | 2Fe3++Cu=2Fe2++Cu2+ | Fe3+具有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-12-08更新
|
685次组卷
|
4卷引用:北京市2019—2020学年高一年级11月月考化学试题
北京市2019—2020学年高一年级11月月考化学试题广东省汕头市金山中学2019-2020学年高一上学期期末考试化学试题(已下线)第03章 铁 金属材料(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)专题9 本专题达标检测-高中化学必修第二册苏教版2019
4 . 浓硫酸分别和三种钠盐反应,下列分析正确的是
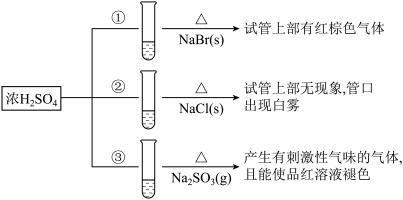
| A.对比①和②可以说明还原性Br->Cl- |
| B.①和③相比可说明氧化性Br2>SO2 |
| C.②中试管口白雾是HCl遇水蒸气所致,说明酸性H2SO4>HCl |
| D.③中浓H2SO4被还原成SO2 |
您最近一年使用:0次
2020-11-07更新
|
1199次组卷
|
33卷引用:北京首都师范大学第二附属中学2021届高三9月月考化学试题
北京首都师范大学第二附属中学2021届高三9月月考化学试题2016-2017学年甘肃省天水市第一中学高一下学期第一阶段考试化学试卷上海市徐汇区2018届高三化学二模试卷(已下线)2019年8月19日《每日一题》2020年高考一轮复习—— 浓硫酸的性质山西大学附中2020届高三上学期第二次模块诊断化学试题安徽省怀宁中学2020届高三上学期第二次月考化学试题夯基提能2020届高三化学选择题对题专练——氧化还原反应的基本概念(基础过关)山东省淄博市2020届高三下学期第二次网考化学试题山东省济宁市汶上圣泽中学2019-2020学年高一下学期第二次月考化学试题专题4 第一单元 第2课时硫酸的制备与性质-高中化学苏教2019版必修第一册(已下线)5.1.3 不同价态含硫物质的转化(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)广东省汕头市金山中学2021届高三下学期学科素养测试化学试题辽宁省大连市普兰店区第三十八中学2020-2021学年高一下学期第一次考试化学试题河北省承德市隆化县存瑞中学2020-2021学年高二下学期期末联考化学试题(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)黑龙江省双鸭山市第一中学2020-2021学年高一下学期第一次月考化学试题新疆哈密市第十五中学2021-2022学年高三上学期第一次月考化学试题山东省泰安市2021-2022年高三上学期期中统考化学试题山东省泰安市2022届高三上学期期中考试化学试题(已下线)4.1.2 硫酸的工业制备 浓硫酸的性质(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)上海外国语大学附属浦东外国语学校2021-2022学年高一下学期线上诊断化学试题黑龙江省七台河市勃利县高级中学2021-2022学年高一下学期期中考试化学试题上海市川沙中学2020-2021学年高一下学期期中线上测试化学试题广州大学附属中学2021-2022学年高一下学期5月月考化学试题(已下线)考点10 硫及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)3.1.2 浓硫酸和硫酸盐-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)河南省安阳市第二中学2021-2022学年高一下学期第一次段考化学试题(已下线)第15讲 硫酸-【暑假自学课】2023年新高一化学暑假精品课(鲁科版2019必修第一册)(已下线)考点10 硫及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第4讲 浓硫酸 不同价态含硫物质的转化上海市川沙中学2023-2024学年高一下学期期中考试化学试卷 吉林省通化市辉南县第六中学2023-2024学年高一下学期3月半月考化学试卷
名校
5 . 某小组同学欲探究H2O2的性质,经历如下探究过程:
预测:聚焦H2O2中的O作为核心元素,因此预测H2O2既具有氧化性,也具有还原性。
(1)预测其具有氧化性的思路是_________ 。
实验和观察:小组同学分别选用酸性KMnO4溶液、酸化的KI溶液与5% H2O2溶液反应以验证预测。
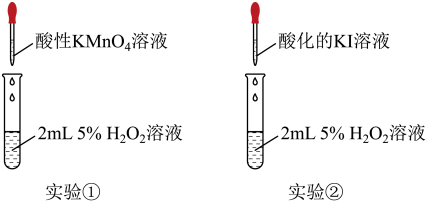
(2)实验①利用了酸性高锰酸钾的_________ 性质,该实验中,证明KMnO4溶液与H2O2反应的现象除了溶液颜色变浅或褪色外,还有________ 。
(3)实验②是为了验证H2O2的_________ 性质,在反应后的溶液中加入淀粉溶液,可观察到溶液变蓝,写出该反应的离子方程式____________ 。
解释和结论:
(4)以上实验可得出的结论是______________________ 。
预测:聚焦H2O2中的O作为核心元素,因此预测H2O2既具有氧化性,也具有还原性。
(1)预测其具有氧化性的思路是
实验和观察:小组同学分别选用酸性KMnO4溶液、酸化的KI溶液与5% H2O2溶液反应以验证预测。

(2)实验①利用了酸性高锰酸钾的
(3)实验②是为了验证H2O2的
解释和结论:
(4)以上实验可得出的结论是
您最近一年使用:0次
2020-01-10更新
|
613次组卷
|
8卷引用:北京市昌平区2019-2020学年高一上学期期末考试化学试题
6 . 为验证卤素单质氧化性:Cl2>Br2>I2,某小组用下图所示装置进行实验。(夹持仪器已略去,气密性已检验)
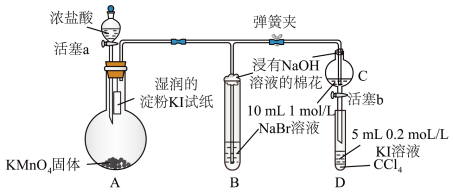
资料: i.CCl4为无色液体,与水不互溶;
ii.Cl2、Br2、I2均易溶于CCl4液体,溶液颜色分别为浅黄绿色、橙黄色和紫红色。
实验过程:
I.打开弹簧夹,打开活塞a,滴加浓盐酸。
II.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
III.当B中溶液由黄色变为棕红色时,关闭活塞a。
IV.……
(1)A中产生黄绿色气体,离子方程式为___________ 。
(2)验证氯气的氧化性强于碘的实验现象是___________ 。
(3)B中溶液发生反应的离子方程式是___________ 。
(4)为验证溴的氧化性强于碘,过程IV的操作和现象是___________ 。
(5)过程III实验的目的是___________ 。

资料: i.CCl4为无色液体,与水不互溶;
ii.Cl2、Br2、I2均易溶于CCl4液体,溶液颜色分别为浅黄绿色、橙黄色和紫红色。
实验过程:
I.打开弹簧夹,打开活塞a,滴加浓盐酸。
II.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
III.当B中溶液由黄色变为棕红色时,关闭活塞a。
IV.……
(1)A中产生黄绿色气体,离子方程式为
(2)验证氯气的氧化性强于碘的实验现象是
(3)B中溶液发生反应的离子方程式是
(4)为验证溴的氧化性强于碘,过程IV的操作和现象是
(5)过程III实验的目的是
您最近一年使用:0次
2023-12-15更新
|
148次组卷
|
3卷引用:北京师范大学2023--2024学年附属实验中学高一上学期化学12月统练
名校
7 . 实验小组探究某补铁口服液中铁元素的价态。
【查阅资料】
KSCN中的硫元素为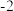 价,易被氧化为
价,易被氧化为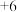 价。
价。
【实验过程】
【分析与解释】
(1)由实验Ⅰ可得出的结论是___________ 。
(2)根据实验Ⅱ中的现象,可以断定该补铁口服液中铁元素的价态为 价,滴加
价,滴加 溶液后
溶液后 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(3)一段时间后,发现实验Ⅱ中溶液红色褪去,可能的原因是___________ ;小组同学为证实自己的猜想,设计如下对照实验:向1mL 0.1 KSCN溶液中加入足量5%
KSCN溶液中加入足量5%  溶液,再加入
溶液,再加入 溶液,观察到
溶液,观察到___________ ,证实了小组同学的猜想是正确的。
【查阅资料】
KSCN中的硫元素为
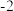 价,易被氧化为
价,易被氧化为 价。
价。【实验过程】
| 编号 | 实验操作 | 实验现象 |
| 实验Ⅰ |  | 无明显变化 |
| 实验Ⅱ |  | 溶液变红 |
(1)由实验Ⅰ可得出的结论是
(2)根据实验Ⅱ中的现象,可以断定该补铁口服液中铁元素的价态为
 价,滴加
价,滴加 溶液后
溶液后 发生反应的离子方程式为
发生反应的离子方程式为(3)一段时间后,发现实验Ⅱ中溶液红色褪去,可能的原因是
 KSCN溶液中加入足量5%
KSCN溶液中加入足量5%  溶液,再加入
溶液,再加入 溶液,观察到
溶液,观察到
您最近一年使用:0次
2021-06-20更新
|
609次组卷
|
5卷引用:北京市海淀区2020-2021学年高一下学期学业水平合格性考试适应练习化学试题
北京市海淀区2020-2021学年高一下学期学业水平合格性考试适应练习化学试题北京市第十一中学2021-2022学年高一下学期6月月考化学试题(已下线)周末培优4 金属及其化合物的实验题和工艺流程题-2021-2022学年高一化学课后培优练(人教版2019必修第一册)(已下线)易错专题23 Fe2+和Fe3+的检验与转化-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)(已下线)第三章 铁 金属材料(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)
名校
解题方法
8 . 为检验淀粉水解的情况,进行如下图所示的实验,试管甲和丙均用60~80 ℃的水浴加热5~6 min,试管乙不加热。待试管甲、丙中的溶液冷却后再进行后续实验。
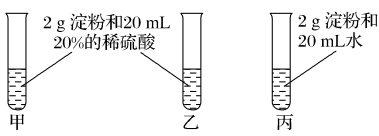
实验1:取少量甲中溶液,加入新制氢氧化铜,加热,没有红色沉淀出现。
实验2:取少量乙中溶液,滴加几滴碘水,溶液变为蓝色,但取少量甲中溶液做此实验时,溶液不变蓝色。
实验3:取少量丙中溶液加入NaOH溶液调节至碱性,再滴加碘水,溶液颜色无明显变化。
(1)写出淀粉水解的化学方程式:___________ 。
(2)设计甲和乙是为了探究___________ 对淀粉水解的影响,设计甲和丙是为了探究___________ 对淀粉水解的影响。
(3)实验1失败的原因是___________ 。
(4)实验3中溶液的颜色无明显变化的原因是___________ 。
(5)下列结论合理的是___________(填字母)。

实验1:取少量甲中溶液,加入新制氢氧化铜,加热,没有红色沉淀出现。
实验2:取少量乙中溶液,滴加几滴碘水,溶液变为蓝色,但取少量甲中溶液做此实验时,溶液不变蓝色。
实验3:取少量丙中溶液加入NaOH溶液调节至碱性,再滴加碘水,溶液颜色无明显变化。
(1)写出淀粉水解的化学方程式:
(2)设计甲和乙是为了探究
(3)实验1失败的原因是
(4)实验3中溶液的颜色无明显变化的原因是
(5)下列结论合理的是___________(填字母)。
| A.淀粉水解需要在催化剂和一定温度下进行 |
| B.欲检验淀粉是否完全水解,最好在冷却后的水解液中直接加碘 |
| C.欲检验淀粉的水解产物具有还原性,应先在水解液中加入氢氧化钠中和稀硫酸至溶液呈碱性,再加入新制氢氧化铜并加热 |
| D.若用唾液代替稀硫酸,则实验1可能出现预期的现象 |
您最近一年使用:0次
2021-11-30更新
|
703次组卷
|
15卷引用:2015届北京市海淀区高三4月模拟练习化学试卷
2015届北京市海淀区高三4月模拟练习化学试卷江西省高安中学2017-2018学年高二1月月考化学试题(已下线)2018年5月29日 淀粉水解程度的判断及水解产物的检验——《每日一题》2017-2018学年高二化学人教选修5(已下线)2019年5月14日 《每日一题》人教选修5—— 淀粉水解程度的判断及水解产物的检验广东省蕉岭县蕉岭中学2018-2019学年高二下学期第三次月考化学试题(已下线)2019年10月30日 《每日一题》2020年高考一轮复习-淀粉水解程度的判断及水解产物的检验高二选择性必修3(人教版2019)第四章 生物大分子 第一节 糖类(已下线)专题09 常见有机物及其应用——备战2021年高考化学纠错笔记(已下线)4.1 糖类(C级检测练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修3)(已下线)4.2 糖类(C级检测练)-2020-2021学年高二化学章节分层检测ABC(人教版选修5)福建省莆田市2020-2021学年高二下学期第二次月考化学(B卷) 试题河北省石家庄市藁城新冀明中学2020-2021学年高二下学期5月月考化学试题(已下线)专题08 常见有机物及其应用-备战2022年高考化学学霸纠错(全国通用)专题6 生命活动的物质基础——糖类、油脂、蛋白质 第一单元 糖类和油脂 第1课时 糖类6.1.1糖类 课后
9 . 某小组为探究氯水的成分与性质,进行实验并观察到以下现象,由实验现象得出的结论不合理的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向NaHCO3溶液中滴加氯水 | 产生能使澄清石灰水变浑浊的气体 | 氯水中含有H+ |
| B | 向稀HNO3酸化的AgNO3溶液中滴加氯水 | 产生白色沉淀 | 氯水中含有Cl- |
| C | 向Na2S溶液中滴加氯水 | 产生黄色沉淀 | 氯水既具有氧化性又具有还原性 |
| D | 向加入淀粉的KI溶液中逐滴中滴加氯水至过量 | 先变蓝后褪色 | 氯水可能氧化碘单质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-01-05更新
|
185次组卷
|
2卷引用:北京市昌平区2022-2023学年高一上学期期末考试化学试题
10 . 下列气体的制备和性质实验中,由现象得出的结论错误的是
| 选项 | 试剂 | 试纸或试液 | 现象 | 结论 |
| A | 浓氨水、生石灰 | 红色石蕊试纸 | 变蓝 | NH3为碱性气体 |
| B | 浓盐酸、浓硫酸 | pH试纸 | 变红 | HCl为酸性气体 |
| C | 浓盐酸、二氧化锰 | 淀粉碘化钾试液 | 变蓝 | Cl2具有氧化性 |
| D | 亚硫酸钠、硫酸 | 品红试液 | 褪色 | SO2具有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-01-30更新
|
2730次组卷
|
30卷引用:北京市清华大学附属中学2023-2024学年高三上学期开学考试化学(B)试题
北京市清华大学附属中学2023-2024学年高三上学期开学考试化学(B)试题2016年全国普通高等学校招生统一考试化学(上海卷精编版)2015-2016学年湖南省五市十校教研教改共同体高二下期末化学试卷2017届四川省龙泉中学、温江中学等五校高三上第一次联考化学卷2017届内蒙古临河区巴彦淖尔一中高三上9月月考化学卷2017届河南省开封市高三上学期10月定位考试化学试卷2017届河南省郑州一中高三上期中化学试卷2017届辽宁省六校协作体高三上学期期中化学试卷2016-2017学年天津市第一中学高一上期末化学卷内蒙古集宁一中(东校区)2016-2017学年高二下学期期末考试化学试题江苏省溧水高级中学2018届高三上学期期初模拟考试化学试题广东省汕头市潮南实验学校2018届高三上学期入学摸底考试化学试题湖南省长郡中学2017-2018学年高二上学期第一次模块检测化学试题1贵州省遵义航天高级中学2018届高三第二次模拟(10月)理科综合化学试题天津市静海县第一中学2017-2018学年高一上学期期末终结性检测化学试题云南省腾冲市第八中学2017-2018学年高一下学期第一次月考化学试题江苏省常州市田家炳高级中学2019届高三上学期10月月考化学试题四川省成都市七中实验学校2019届高三上学期10月月考化学试题(已下线)解密17 物质的检验分离与提纯(教师版)——备战2018年高考化学之高频考点解密2016年全国普通高等学校招生统一考试化学(上海卷参考版)2019年秋高三化学复习强化练习—— 硫及其化合物人教版(2019)必修第二册第五章 模拟高考高一必修第一册(鲁科2019)考试帮 3 核心素养解读必修第二册RJ第5章挑战区 模拟高考(已下线)易错20 表格类化学实验选择题-备战2021年高考化学一轮复习易错题四川省峨眉第二中学校2021-2022学年高一下学期3月月考化学试题上海市川沙中学2021-2022学年高三下学期5月月考化学试题陕西省黄陵中学2021-2022学年高一上学期期末考试化学试题上海市嘉定区2023届高三一模化学试题陕西省安康中学2023-2024学年高一下学期3月月考化学试卷



