名校
1 . 如图是实验室研究潜水艇中供氧体系反应机理的装置图(夹持仪器略)。
(1)B装置可除去A装置中可能挥发出的_______ ,反应的离子方程式为_______ 。
(2)C装置为O2的发生装置,发生反应的化学方程式有_______ 、_______ 。
(3)D装置可除去C装置中未发生反应的_______ ,反应的离子方程式为_______ 。
(4)C装置中固体由淡黄色完全变为白色,检验固体成分的实验方案为取少量C装置中反应后的固体溶于水,向溶液中滴入过量_______ 溶液,若有白色沉淀生成,则证明固体中含有_______ ;过滤,向滤液中滴入几滴酚酞试液,若_______ 且不褪色,则证明固体中含有_______ 。

(1)B装置可除去A装置中可能挥发出的
(2)C装置为O2的发生装置,发生反应的化学方程式有
(3)D装置可除去C装置中未发生反应的
(4)C装置中固体由淡黄色完全变为白色,检验固体成分的实验方案为取少量C装置中反应后的固体溶于水,向溶液中滴入过量
您最近一年使用:0次
2 . (一)某化学实验小组拟用如图装置进行钠与氧气反应的实验。
(1)将一小块钠放在石棉网上加热,能观察到的实验现象有_______ ,写出发生反应的化学方程式:_______ 。
(2)上述实验中还观察到有黑色固体物质生成,其原因可能为2Na+CO2 C+Na2O2或4Na+3CO2
C+Na2O2或4Na+3CO2 C+2Na2CO3,这两个化学方程式的反应类型既属于基本反应类型中的
C+2Na2CO3,这两个化学方程式的反应类型既属于基本反应类型中的_______ 反应,也属于_______ (填“氧化还原”或“非氧化还原”)反应。
(二)该实验小组对中学课本中可生成氢气的反应进行了研究,总结出两个可以生成H2的反应:①Zn+盐酸,②Na+水。为点燃上述两个反应生成的H2,他们设计了图示装置。请回答下列问题:
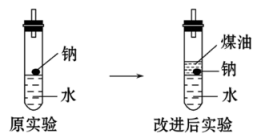
(3)写出Na与H2O反应的化学方程式:_______ 。
(4)实验小组在点燃用上述装置制得的H2时,①实验获得成功,②却失败了。他们分析认为失败的原因是Na的用量太少,Na与H2O的反应速率太快。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是_______ 。
(5)实验小组查阅钠、煤油、水的密度分别为0.97g·cm-3、0.80g·cm-3、1.00g·cm-3,并据此对实验进行改进。在改进后的实验中H2的生成速率减慢,原因是_______ 。

(1)将一小块钠放在石棉网上加热,能观察到的实验现象有
(2)上述实验中还观察到有黑色固体物质生成,其原因可能为2Na+CO2
 C+Na2O2或4Na+3CO2
C+Na2O2或4Na+3CO2 C+2Na2CO3,这两个化学方程式的反应类型既属于基本反应类型中的
C+2Na2CO3,这两个化学方程式的反应类型既属于基本反应类型中的(二)该实验小组对中学课本中可生成氢气的反应进行了研究,总结出两个可以生成H2的反应:①Zn+盐酸,②Na+水。为点燃上述两个反应生成的H2,他们设计了图示装置。请回答下列问题:

(3)写出Na与H2O反应的化学方程式:
(4)实验小组在点燃用上述装置制得的H2时,①实验获得成功,②却失败了。他们分析认为失败的原因是Na的用量太少,Na与H2O的反应速率太快。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是
(5)实验小组查阅钠、煤油、水的密度分别为0.97g·cm-3、0.80g·cm-3、1.00g·cm-3,并据此对实验进行改进。在改进后的实验中H2的生成速率减慢,原因是
您最近一年使用:0次
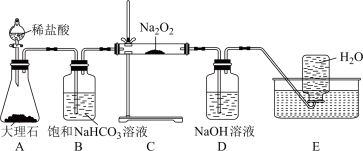
3 . 某学校兴趣小组采用如图装置制取 及无水
及无水 固体(容易潮解,在100℃左右升华)。
固体(容易潮解,在100℃左右升华)。
回答下列问题:
(1)上述装置从左至右的连接顺序为___________ →cbgf(填字母,必要的装置可重复使用)。
(2)饱和NaCl溶液的作用为___________ ;棉花球的作用为___________ ; 与Fe粉反应的化学方程式为
与Fe粉反应的化学方程式为___________ 。
(3)NaOH溶液的作用是___________ 。
(4)将干燥的 依次通过干燥的有色布条、湿润的有色布条,可观察到的现象是
依次通过干燥的有色布条、湿润的有色布条,可观察到的现象是___________ ,得出的结论是___________ 。
(5)实验结束后,从盛有NaOH溶液的广口瓶中取少量溶液于烧杯中,加入足量浓盐酸后,会产生一种黄绿色气体,写出生成该气体的离子方程式___________ 。
 及无水
及无水 固体(容易潮解,在100℃左右升华)。
固体(容易潮解,在100℃左右升华)。
回答下列问题:
(1)上述装置从左至右的连接顺序为
(2)饱和NaCl溶液的作用为
 与Fe粉反应的化学方程式为
与Fe粉反应的化学方程式为(3)NaOH溶液的作用是
(4)将干燥的
 依次通过干燥的有色布条、湿润的有色布条,可观察到的现象是
依次通过干燥的有色布条、湿润的有色布条,可观察到的现象是(5)实验结束后,从盛有NaOH溶液的广口瓶中取少量溶液于烧杯中,加入足量浓盐酸后,会产生一种黄绿色气体,写出生成该气体的离子方程式
您最近一年使用:0次
2021-11-15更新
|
59次组卷
|
2卷引用:贵州省遵义市2021-2022学年高一上学期期中联合考试化学试题
解题方法
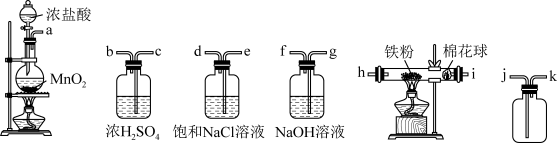
4 . 某化学兴趣小组在实验室探究SO2的相关性质
Ⅰ.制备并收集SO2仪器
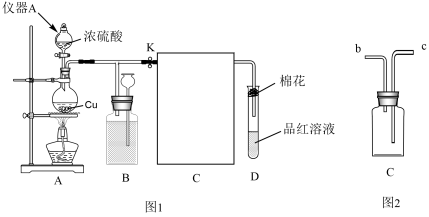
(1)仪器a名称为___ ,装置A中发生反应的化学方程式为___ 。
(2)把图2装置C接回图1装置中,按照从左往右的顺序应该先连接____ (填b或c),当D中出现____ 现象时,证明气体已集满,停止加热。装置D中试管口的棉花应提前在___ 溶液(填化学式)中浸湿。
(3)当D处有明显的现象时,关闭旋塞K,移去酒精灯。但由于余热的作用,A处仍有气体产生,B中盛放的液体是____ (填字母)。
a.水 b.酸性高锰酸钾溶液 c.饱和NaHSO3溶液 d.浓硫酸
Ⅱ.探究SO2和Na2O2的反应

(4)将实验Ⅰ中收集的SO2直接通入E中,将带火星的木条靠近F的试管口,发现木条复燃,据此现象甲同学认为SO2和CO2性质相似,其产物应为Na2SO3和O2,但是乙同学不赞同,他认为木条复燃可能另有原因,请用化学方程式来解释乙的观点____ 。
(5)丙同学认为两种盐都有,取 中完全反应后所得的固体进行如下操作:
中完全反应后所得的固体进行如下操作:
充分反应之后,将沉淀过滤、洗涤、干燥、称量最后剩余固体质量为bg,则Na2SO3在原固体中所占质量分数为____ (用含a和b的计算式表达。已知BaSO4的摩尔质量为223g/mol;Na2SO4的摩尔质量为142g/mol)。
Ⅰ.制备并收集SO2仪器

(1)仪器a名称为
(2)把图2装置C接回图1装置中,按照从左往右的顺序应该先连接
(3)当D处有明显的现象时,关闭旋塞K,移去酒精灯。但由于余热的作用,A处仍有气体产生,B中盛放的液体是
a.水 b.酸性高锰酸钾溶液 c.饱和NaHSO3溶液 d.浓硫酸
Ⅱ.探究SO2和Na2O2的反应

(4)将实验Ⅰ中收集的SO2直接通入E中,将带火星的木条靠近F的试管口,发现木条复燃,据此现象甲同学认为SO2和CO2性质相似,其产物应为Na2SO3和O2,但是乙同学不赞同,他认为木条复燃可能另有原因,请用化学方程式来解释乙的观点
(5)丙同学认为两种盐都有,取
 中完全反应后所得的固体进行如下操作:
中完全反应后所得的固体进行如下操作:| 操作 | 现象 | 结论 | |
| ⅰ | 取agE中固体溶于水,加入足量BaCl2溶液 | 有白色沉淀产生 | |
| ⅱ | 将浊液过滤,然后向沉淀中加入过量盐酸 | 丙同学假设成立 |
您最近一年使用:0次
名校
解题方法
5 . 某研究性学习小组请你参与“研究铁与水蒸气反应所得固体物质的成分、性质及再利用”实验探究,并回答下列问题:
探究一:设计如图所示装置进行“铁与水蒸气反应”的实验(夹持仪器略)。
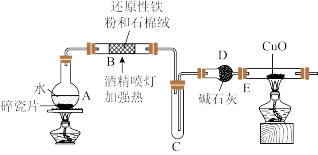
(1)硬质玻璃管 B 中发生反应的化学方程式为:___________ 。
探究二:设计如下实验方案确定反应后硬质玻璃管 B 中黑色固体的成分。(已知酸性 KMnO4 溶液能与盐酸发生反应生成氯气)
(2)待硬质玻璃管 B 冷却后,取少许其中的固体继续进行如图实验

①试剂 A 是___________ ,试剂 B 是___________ ,现象 2 为___________ 。
②若现象1 中溶液未变红色,请从硬质玻璃管B 中固体物质的成分分析可能的原因:___________ 。
(3)将铜片放入 0.1mol•L-1FeCl3溶液中,反应一定时间后取出铜片,溶液中 c (Fe3+):c(Fe2+)=2:3,则 Cu2+与 Fe3+的物质的量之比为___________ 。
探究一:设计如图所示装置进行“铁与水蒸气反应”的实验(夹持仪器略)。

(1)硬质玻璃管 B 中发生反应的化学方程式为:
探究二:设计如下实验方案确定反应后硬质玻璃管 B 中黑色固体的成分。(已知酸性 KMnO4 溶液能与盐酸发生反应生成氯气)
(2)待硬质玻璃管 B 冷却后,取少许其中的固体继续进行如图实验

①试剂 A 是
②若现象1 中溶液未变红色,请从硬质玻璃管B 中固体物质的成分分析可能的原因:
(3)将铜片放入 0.1mol•L-1FeCl3溶液中,反应一定时间后取出铜片,溶液中 c (Fe3+):c(Fe2+)=2:3,则 Cu2+与 Fe3+的物质的量之比为
您最近一年使用:0次
6 . 已知:①氮的氧化物能与红热的铜反应;②Cu2O在酸性条件下能迅速发生反应:Cu2O+2H+=Cu+Cu2++H2O。某小组设计实验探究NO和Cu反应的氧化产物(设Cu全部被氧化),装置如图所示(部分夹持装置未画出):

请回答下列问题:
(1)装置E中倒置在水槽中的仪器名称为__ ;装置B中试剂为__ 。
(2)装置A中a的作用是__ ;写出A中反应的离子方程式__ 。
(3)实验开始时,先打开A中分液漏斗活塞,过一会儿,点燃D处酒精灯,这样操作的目的是__ 。若观察到D中红色粉末变为黑色,说明D中有__ (填化学式)生成。
(4)对D中氧化产物提出如下假设:
假设1:氧化产物是CuO;
假设2:氧化产物是CuO和Cu2O的混合物。
为了探究氧化产物是否含有Cu2O,设计如下方案:
(甲)取少量完全反应后的产物,加入足量的稀硝酸,观察是否溶解
(乙)取少量完全反应后的产物,加入足量的稀硫酸,观察是否溶解
(丙)取少量完全反应后的产物,加入足量的浓硝酸,观察是否溶解
(丁)取少量完全反应后的产物,,在加热条件下通入乙醇蒸气,观察是否变为红色其中,能达到实验目的的是__ (填代号)。
(5)若氧化产物为CuO和Cu2O的混合物,为测定其组成,取混合物5.92g与足量稀硝酸反应,测得生成448mL标准状况下NO气体,则混合物中CuO和Cu2O的物质的量之比为___ 。

请回答下列问题:
(1)装置E中倒置在水槽中的仪器名称为
(2)装置A中a的作用是
(3)实验开始时,先打开A中分液漏斗活塞,过一会儿,点燃D处酒精灯,这样操作的目的是
(4)对D中氧化产物提出如下假设:
假设1:氧化产物是CuO;
假设2:氧化产物是CuO和Cu2O的混合物。
为了探究氧化产物是否含有Cu2O,设计如下方案:
(甲)取少量完全反应后的产物,加入足量的稀硝酸,观察是否溶解
(乙)取少量完全反应后的产物,加入足量的稀硫酸,观察是否溶解
(丙)取少量完全反应后的产物,加入足量的浓硝酸,观察是否溶解
(丁)取少量完全反应后的产物,,在加热条件下通入乙醇蒸气,观察是否变为红色其中,能达到实验目的的是
(5)若氧化产物为CuO和Cu2O的混合物,为测定其组成,取混合物5.92g与足量稀硝酸反应,测得生成448mL标准状况下NO气体,则混合物中CuO和Cu2O的物质的量之比为
您最近一年使用:0次
解题方法
7 . 某化学兴趣小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(部分装置已略去)。图中K为止水夹,M是半空的注射器。请回答有关问题:

(1)装置A的目的是利用生成的 将整个装内的空气排尽。避免空气的干扰,装置A中所发生反应的离子方程式为
将整个装内的空气排尽。避免空气的干扰,装置A中所发生反应的离子方程式为_______ ;当装置内空气已经排尽时。可观察到的现象是_______ 。
(2)B装置中稀硝酸发生反应主要表现出的化学性质有_______ 。
(3)为实现装置C的作用,应采用的操作和观察到的现象为_______ 。
(4)将28.8g铜与140mL一定浓度的硝酸反应,铜完全溶解。产生的NO和 混合气体在标准状况下的体积为11.2L,其中NO的体积为
混合气体在标准状况下的体积为11.2L,其中NO的体积为_______ L。

(1)装置A的目的是利用生成的
 将整个装内的空气排尽。避免空气的干扰,装置A中所发生反应的离子方程式为
将整个装内的空气排尽。避免空气的干扰,装置A中所发生反应的离子方程式为(2)B装置中稀硝酸发生反应主要表现出的化学性质有
(3)为实现装置C的作用,应采用的操作和观察到的现象为
(4)将28.8g铜与140mL一定浓度的硝酸反应,铜完全溶解。产生的NO和
 混合气体在标准状况下的体积为11.2L,其中NO的体积为
混合气体在标准状况下的体积为11.2L,其中NO的体积为
您最近一年使用:0次
名校
解题方法
8 . 如图在A处通入 Cl2,当关闭B阀时,C处湿润的红色布条没有明显变化,当打开B阀时,C处湿润的红色布条逐渐褪色,则D瓶中所装的液体是
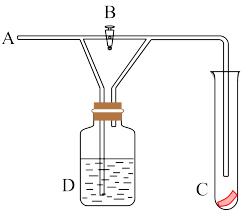

| A.水 | B.浓硫酸 |
| C.NaOH溶液 | D.饱和NaCl溶液 |
您最近一年使用:0次
2020-11-03更新
|
563次组卷
|
40卷引用:贵州省凯里市第一中学2021-2022学年高一上学期期中考试化学试题
贵州省凯里市第一中学2021-2022学年高一上学期期中考试化学试题(已下线)【浙江新东方】【2021.4.27】【宁波】【高一上】【高中化学】【00139】广东省梅州市大埔县虎山中学2021-2022学年高一上学期第一次段考(11月)化学试题黑龙江省鸡东县第二中学2021-2022学年高一上学期期中考试(B班)化学试题黑龙江省鸡东县第二中学2021-2022学年高一上学期期中考试(实验班)化学试题吉林省洮南市第一中学2021-2022学年高一上学期第三次月考化学试题(已下线)2011届山东省实验中学高三上学期第一次诊断性测试化学卷(已下线)2010年上海市吴淞中学高一上学期期中考试化学试卷(已下线)2010年浙江省绍兴一中高一上学期期中考试化学试题(已下线)2010-2011学年山西省临汾一中高一上学期期末考试化学试卷(已下线)2011-2012学年浙江省瑞安中学高一上学期期中考试化学试卷(已下线)2012-2013学年广东省汕头四中高一上学期期末考试化学试卷(已下线)2013-2014学年浙江省湖州市属九校高一12月联考化学试卷2015-2016学年广东省仲元中学高一上学期期末化学试卷浙江省慈溪实验高级中学2017-2018学年高一上学期第一次月考化学试题黑龙江省牡丹江市第一高级中学2017-2018学年高二上学期期中考试化学(文)试题山东省济南市历城第二中学2017-2018学年高一上学期第三次调研化学试题江西省鹰潭市2017-2018学年高一上学期期末质量检测化学试题安徽省定远重点中学2018-2019学年高二上学期开学考试化学试题江西省遂川中学、吉安县中2017-2018学年高一上学期联考化学试题河南省登封实验高中2019-2020学年高一年级上学期第二次月考化学试题上海市华东师范大学附属天山中学2018-2019学年高一第一学期期中考试化学试题山东省济南外国语学校三箭分校2019-2020学年高一上学期期中考试化学试题山东省济南外国语学校2019-2020学年高一上学期期中考试化学试题步步为赢 高一化学寒假作业:作业十三 富集在海水中的元素——氯湖南省长沙市南雅中学2019-2020学年高一下学期入学考试化学试题(已下线)【新东方】2020-30上海市普通高中三校联考2019-2020学年高一上学期期中化学试卷(已下线)江西省宜丰中学2018_2019学年高一化学上学期期末考试试卷安徽省蚌埠市第二中学2020-2021学年高一10月月考化学(文)试题安徽省蚌埠市第二中学2020-2021学年高一10月月考化学(理)试题安徽省滁州市定远县重点中学2020-2021学年高一10月月考化学试题黑龙江省绥化市第一中学2020-2021学年高一上学期第二次月考化学试题吉林省白城市洮南一中2020-2021学年高一上学期期中考试化学试题(已下线)第15单元 实验设计与评价(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷广东实验中学2020-2021学年高一上学期期中考试化学试题云南衡水实验中学2021-2022学年高一上学期期末考试化学试题上海市南汇中学2022-2023学年高一上学期期末考试化学试题(已下线)【新东方】高一化学二轮班期中诊断试题卷 B1河北省石家庄市正定县弘文中学2023-2024学年高一上学期期中考试化学试题
9 . 某同学利用下图进行喷泉实验,已知圆底烧瓶内充满X气体,胶头滴管内装有少量Y液体,烧杯内装有足量Z液体,下列组合能进行喷泉实验且最终液体一定能充满整个烧瓶的是( )

| X气体 | Y试剂 | Z试剂 | |
| A. | NO2 | H2O | H2O |
| B. | CO2 | H2O | H2O |
| C. | HCl | 饱和食盐水 | 水 |
| D. | NO2 和O2 | H2O | H2O |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2016-02-19更新
|
352次组卷
|
6卷引用:贵州省毕节市金沙县第一中学2020-2021学年高一上学期期末考试化学试题



