1 . 为了更深刻地认识卤素的性质,某化学小组对卤素的制备和性质进行如下探究实验,根据实验回答问题。
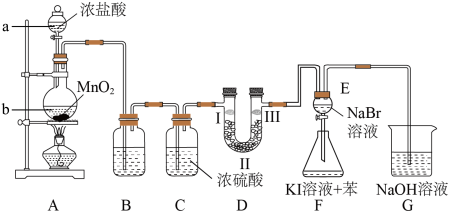
(1)仪器b的名称是__________ ,装置A制取氯气的化学方程式为________________ 。
(2)浓盐酸在反应中显示出来的性质是______________ ,若产生0.5 mol Cl2则被氧化的HCl____ mol,转移电子数约为____ 个(NA表示阿伏加德罗常数)
(3)装置D的作用是验证氯气是否具有漂白性,为此D中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是_____ (填字母编号)。
(4)装置F的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开E中活塞,将装置E中少量溶液加入装置F中,振荡,观察到的现象是_______________________ ,该现象______ (填“能”或“不能”)说明溴单质的氧化性强于碘单质,原因是_____________ 。
(5)实验室也可以用高锰酸钾和浓盐酸反应来制备氯气,将反应的化学方程式配平:__________ 。
KMnO4+ HCl(浓)= KCl + MnCl2+ Cl2↑ + H2O,有126. 4 g的KMnO4参加反应,若将生成的氯气全部通入足量的石灰乳中,理论上可得到次氯酸钙的质量为_____ g;制得的漂白粉应密封保存否则容易失效,其失效的原因是_______________ 。(用化学方程式表示)

(1)仪器b的名称是
(2)浓盐酸在反应中显示出来的性质是
(3)装置D的作用是验证氯气是否具有漂白性,为此D中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是
| 编号 | Ⅰ | Ⅱ | Ⅲ |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水氯化钙 | 湿润的有色布条 |
| c | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)装置F的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开E中活塞,将装置E中少量溶液加入装置F中,振荡,观察到的现象是
(5)实验室也可以用高锰酸钾和浓盐酸反应来制备氯气,将反应的化学方程式配平:
KMnO4+ HCl(浓)= KCl + MnCl2+ Cl2↑ + H2O,有126. 4 g的KMnO4参加反应,若将生成的氯气全部通入足量的石灰乳中,理论上可得到次氯酸钙的质量为
您最近一年使用:0次
2 . 已知浓硫酸和木炭粉在加热条件下可发生化学反应。
(1)上述反应的化学方程式为_______ 。
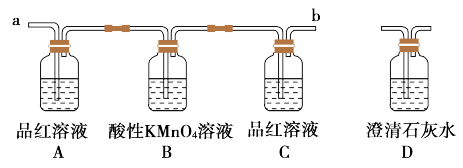
(2)试用如图所列各装置设计一个实验,来验证上述反应所产生的各种产物。
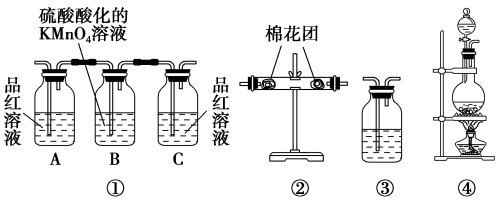
这些装置的连接顺序(按产物气流从左到右的方向)是_______→_______→_______→_______(填装置的序号) ,_______
(3)实验时可观察到装置①中A瓶中的溶液褪色,C瓶中的溶液不褪色。A瓶中的溶液的作用是_______ ;B瓶中的溶液的作用是_______ ;C瓶中的溶液的作用是_______ 。
(4)装置②中所加固体药品是无水硫酸铜。可验证的产物是_______ 。
(5)装置③中所盛溶液是澄清石灰水,可验证的产物_______ 。
(1)上述反应的化学方程式为
(2)试用如图所列各装置设计一个实验,来验证上述反应所产生的各种产物。

这些装置的连接顺序(按产物气流从左到右的方向)是_______→_______→_______→_______(填装置的序号) ,
(3)实验时可观察到装置①中A瓶中的溶液褪色,C瓶中的溶液不褪色。A瓶中的溶液的作用是
(4)装置②中所加固体药品是无水硫酸铜。可验证的产物是
(5)装置③中所盛溶液是澄清石灰水,可验证的产物
您最近一年使用:0次
3 . 已知三氯化铁的熔点为306 ℃,沸点为315 ℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验:

(1)碱石灰的作用是_______ 。
(2)饱和食盐水的作用是_______
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
 (同时有氧气生成)
(同时有氧气生成)
①淡黄色溶液中加入试剂X生成淡红色溶液的离子反应方程式为_______ 。
②淡红色溶液中加入过量H2O2后溶液红色加深的原因是_______

(1)碱石灰的作用是
(2)饱和食盐水的作用是
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
 (同时有氧气生成)
(同时有氧气生成)①淡黄色溶液中加入试剂X生成淡红色溶液的离子反应方程式为
②淡红色溶液中加入过量H2O2后溶液红色加深的原因是
您最近一年使用:0次
4 . 某化学兴趣小组用如图Ⅰ所示的装置进行制取乙烯的实验CH3CH2OH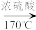 CH2=CH2↑+H2O。当温度迅速上升后,可观察到试管中的溴水褪色,反应混合液变为黑色且产生的气体有刺激性气味。
CH2=CH2↑+H2O。当温度迅速上升后,可观察到试管中的溴水褪色,反应混合液变为黑色且产生的气体有刺激性气味。
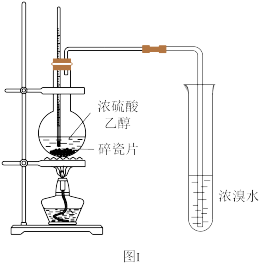
(1)装浓硫酸与乙醇混合液的仪器名称是_______ 。
(2)经分析黑色物质是碳单质,该过程体现了浓硫酸的_______ 性。
(3)写出使溴水褪色可能的化学方程式_______ 、_______ 。
(4)某同学想检验发生装置中是否有CO2产生,准备利用后边的装置进行检验,其中试剂选择明显错误的是_______ (填字母)可以用_______ 代替,可以证明有CO2产生的现象是_______ 。
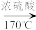 CH2=CH2↑+H2O。当温度迅速上升后,可观察到试管中的溴水褪色,反应混合液变为黑色且产生的气体有刺激性气味。
CH2=CH2↑+H2O。当温度迅速上升后,可观察到试管中的溴水褪色,反应混合液变为黑色且产生的气体有刺激性气味。

(1)装浓硫酸与乙醇混合液的仪器名称是
(2)经分析黑色物质是碳单质,该过程体现了浓硫酸的
(3)写出使溴水褪色可能的化学方程式
(4)某同学想检验发生装置中是否有CO2产生,准备利用后边的装置进行检验,其中试剂选择明显错误的是
您最近一年使用:0次
名校
解题方法
5 . 回答下列问题
I.硫酸亚铁是一种重要的工业原料,同时也可以用于制造补血药物,但其具有毒性,故严禁在食品中滥用硫酸亚铁,请回答下列问题:
(1)下列说法中正确的是___________(填字母)。
Ⅱ.某同学为探究富含硫酸亚铁且保存时间较长的糕点情况,设计了如下实验方案:

(2)试剂1的化学式是___________ 。
(3)加入新制氯水后,溶液红色加深的原因是___________ (用离子方程式表示)
(4)该同学实验中加入过量新制氯水,放置一段时间后,深红色褪去,现对褪色原因进行探究(已知SCN-有还原性)。
①[提出假设]假设1:溶液中的+3价铁被氧化为更高的价态。假设2:___________ 。
②[设计方案]为了对假设2进行验证,简述你的设计方案:___________ 。
(5)FeSO4固体应___________ 保存。
(6)将铜片放入0.1 mol/LFeCl3溶液中,反应一段时间后,取出铜片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为___________ 。
I.硫酸亚铁是一种重要的工业原料,同时也可以用于制造补血药物,但其具有毒性,故严禁在食品中滥用硫酸亚铁,请回答下列问题:
(1)下列说法中正确的是___________(填字母)。
| A.可以使用明矾作糕点膨化剂 |
| B.大量服用FeSO4导致人体中毒可能与其还原性有关 |
| C.向FeSO4溶液中加入铜粉可析出铁单质 |
| D.向FeSO4溶液中加入少许铁粉,其目的是防止Fe2+被还原 |
Ⅱ.某同学为探究富含硫酸亚铁且保存时间较长的糕点情况,设计了如下实验方案:

(2)试剂1的化学式是
(3)加入新制氯水后,溶液红色加深的原因是
(4)该同学实验中加入过量新制氯水,放置一段时间后,深红色褪去,现对褪色原因进行探究(已知SCN-有还原性)。
①[提出假设]假设1:溶液中的+3价铁被氧化为更高的价态。假设2:
②[设计方案]为了对假设2进行验证,简述你的设计方案:
(5)FeSO4固体应
(6)将铜片放入0.1 mol/LFeCl3溶液中,反应一段时间后,取出铜片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为
您最近一年使用:0次
6 . 如图是实验室制备氯气并验证氯气性质的装置(其中夹持装置已省略)。
据此回答下列问题:
(1)已知,装置A是氯气的发生装置。加入适量的浓盐酸充分反应有黄绿色气体生成,写出发生反应的离子方程式:_______ 。
(2)装置B中饱和食盐水的作用是_______ 。装置B也是安全瓶,目的是监测实验进行时装置C中是否发生堵塞,请写出装置C中发生堵塞时装置B中的实验现象:_______ 。
(3)装置C的作用是验证氯气是否具有漂白性,则装置C中I、II、III处依次应放入的物质是_______ (填序号)。
(4)装置D的烧杯内是NaOH溶液,写出烧杯中反应的离子方程式:_______ 。有同学认为装置D中可选用澄清石灰水,你认为是否可行并说明理由:_______ 。

据此回答下列问题:
(1)已知,装置A是氯气的发生装置。加入适量的浓盐酸充分反应有黄绿色气体生成,写出发生反应的离子方程式:
(2)装置B中饱和食盐水的作用是
(3)装置C的作用是验证氯气是否具有漂白性,则装置C中I、II、III处依次应放入的物质是
| 序号 | I | II | III |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
您最近一年使用:0次
解题方法
7 . 某兴趣小组为探究酸性高锰酸钾与铜的反应,设计实验如图,在培养皿中加入足量的酸性高锰酸钾溶液,放入铜珠,实验结果如图:
已知:MnO2是棕黑色固体。下列说法不正确的是
| 实验 | 现象 |
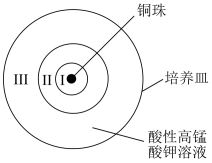 | 一段时间后,培养皿中由铜珠向外侧依次呈现: Ⅰ区澄清且紫色褪色明显 Ⅱ区底部覆盖棕黑色固体 Ⅲ区澄清且紫色变浅 |
A.Ⅰ区铜参加反应方程式为:5Cu+2MnO +16H+=5Cu2++2Mn2++8H2O +16H+=5Cu2++2Mn2++8H2O |
| B.Ⅱ区棕黑色固体是由铜和酸性高锰酸钾反应产生还原产物 |
C.Ⅲ区紫色变浅说明在Ⅲ区MnO 的浓度减小,是因为离子扩散作用 的浓度减小,是因为离子扩散作用 |
| D.如果酸性高锰酸钾过量很多,所有反应完全后,产物中可能没有Mn2+ |
您最近一年使用:0次
8 .  和
和 是两种重要的钠盐。
是两种重要的钠盐。
(1)探究 、
、 的稳定性
的稳定性

如图所示,在加热过程中能观察到产生白色沉淀的烧杯是___________ (填“Ⅰ”或“Ⅱ”),该烧杯中发生反应的离子方程式是___________ ,通过该实验可比较出___________ (填“ ”或“
”或“ ”)更稳定。
”)更稳定。
(2)探究 、
、 溶液分别与盐酸反应过程的热量变化
溶液分别与盐酸反应过程的热量变化
步骤1:分别取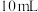 等浓度的
等浓度的 、
、 溶液,测量温度为
溶液,测量温度为 ;
;
步骤2:分别加入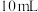 密度约为
密度约为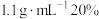 的盐酸(20℃),搅拌,测量温度为
的盐酸(20℃),搅拌,测量温度为 ;
;
步骤3:数据记录:
步骤4:实验分析。甲同学分析上述数据认为两个反应都放出热量,乙同学认为甲同学的分析不严谨,应该补做如下实验:向盛有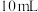 水(20℃)的烧杯中加入
水(20℃)的烧杯中加入___________ ,搅拌,测量温度为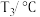 ,再比较
,再比较 和
和 的大小。若
的大小。若___________ ,说明 溶液与盐酸的反应吸收热量,而
溶液与盐酸的反应吸收热量,而 与盐酸的反应放出热量。
与盐酸的反应放出热量。
(3)除去 粉末中混有的少量
粉末中混有的少量 的方法是
的方法是___________ ,所涉及反应的化学方程式为___________ 。
 和
和 是两种重要的钠盐。
是两种重要的钠盐。(1)探究
 、
、 的稳定性
的稳定性
如图所示,在加热过程中能观察到产生白色沉淀的烧杯是
 ”或“
”或“ ”)更稳定。
”)更稳定。(2)探究
 、
、 溶液分别与盐酸反应过程的热量变化
溶液分别与盐酸反应过程的热量变化步骤1:分别取
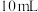 等浓度的
等浓度的 、
、 溶液,测量温度为
溶液,测量温度为 ;
;步骤2:分别加入
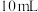 密度约为
密度约为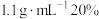 的盐酸(20℃),搅拌,测量温度为
的盐酸(20℃),搅拌,测量温度为 ;
;步骤3:数据记录:
| 温度 试剂 | 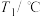 | 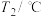 |
 | 20.0 | 23.7 |
 | 20.0 | 20.8 |
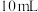 水(20℃)的烧杯中加入
水(20℃)的烧杯中加入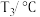 ,再比较
,再比较 和
和 的大小。若
的大小。若 溶液与盐酸的反应吸收热量,而
溶液与盐酸的反应吸收热量,而 与盐酸的反应放出热量。
与盐酸的反应放出热量。(3)除去
 粉末中混有的少量
粉末中混有的少量 的方法是
的方法是
您最近一年使用:0次
2021-12-03更新
|
112次组卷
|
3卷引用:辽宁省朝阳市建平县普通高中2021-2022学年高一上学期期中联考化学试题
名校
解题方法
9 . 为探究新制氯水的性质,某学生做了如表实验。由上述实验可得新制氯水的性质与对应的解释或离子方程式不相符的是
| 实验 | 装置 | 试剂a | 现象 |
| ① |
| 紫色的石蕊试液 | 溶液先变红后褪色 |
| ② |  溶液 溶液 | 产生气泡 | |
| ③ |  酸化的 酸化的 溶液 溶液 | 产生白色沉淀 | |
| ④ |  溶液、淀粉溶液 溶液、淀粉溶液 | 溶液变蓝 |
A.实验①说明新制氯水中含有 、 、 |
B.实验②发生的反应为: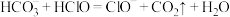 |
C.实验③说明新制氯水中有 , ,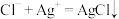 |
D.实验④发生的反应为: |
您最近一年使用:0次
2021-11-05更新
|
620次组卷
|
5卷引用:辽宁省沈阳市郊联体2021-2022学年高一上学期期中考试化学试题
解题方法
10 . 8.34g FeSO4·7H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。回答下列问题:
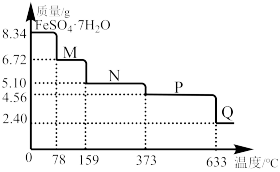
(1)试确定200℃时固体物质N的化学式___________ 。
(2)取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,试写出该反应的化学方程式___________ 。
(3)某兴趣小组用如图所示装置设计实验,验证(2)中生成的气态物质,并测定已分解的P的质量(不考虑装置内空气的影响)。
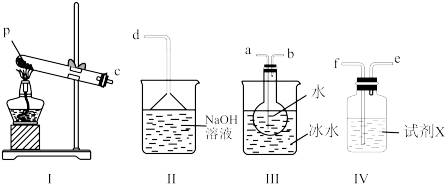
①试剂X的名称是___________ 。
②按气流方向连接仪器,用字母表示接口的连接顺序:c→___________ 。
③充分反应后,利用装置III中圆底烧瓶内混合物测定已分解的P的质量,其操作步骤为:第一步,向圆底烧瓶内逐滴加入BaCl2溶液,直至沉淀完全;第二步,过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重;第三步,继续烘干冷却并称量,直至连续两次称量质量差不超过0. 1g为止。若最终所得沉淀质量为wg,则已分解的P的质量为___________ g.(填计算式)

(1)试确定200℃时固体物质N的化学式
(2)取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,试写出该反应的化学方程式
(3)某兴趣小组用如图所示装置设计实验,验证(2)中生成的气态物质,并测定已分解的P的质量(不考虑装置内空气的影响)。

①试剂X的名称是
②按气流方向连接仪器,用字母表示接口的连接顺序:c→
③充分反应后,利用装置III中圆底烧瓶内混合物测定已分解的P的质量,其操作步骤为:第一步,向圆底烧瓶内逐滴加入BaCl2溶液,直至沉淀完全;第二步,过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重;第三步,继续烘干冷却并称量,直至连续两次称量质量差不超过0. 1g为止。若最终所得沉淀质量为wg,则已分解的P的质量为
您最近一年使用:0次




