名校
解题方法
1 . 氯气是一种重要的工业原料。某校化学实验兴趣小组同学设计了如下图所示的实验装置,利用如下原理探究氯气的某些性质。实验开始一段时间后,观察到D中溶液变为蓝色。

(1)A中产生现象是①___________ ,甲同学认为是 与水反应产生某新物质的结果,写出其中发生的两个反应的化学方程式②
与水反应产生某新物质的结果,写出其中发生的两个反应的化学方程式②___________ 、③___________ ,乙同学则认为A中的现象不足以说明白色沉淀是 与水反应产生新物质的结果,理由是④
与水反应产生新物质的结果,理由是④___________ 。
(2)B和C中出现的不同现象可得出的结论是___________ 。
(3)E是尾气吸收装置,写出其中发生的反应方程式:___________ ;若吸收了标准状况下的22.4mL氯气,则该过程中转移的电子个数为___________ 。

(1)A中产生现象是①
 与水反应产生某新物质的结果,写出其中发生的两个反应的化学方程式②
与水反应产生某新物质的结果,写出其中发生的两个反应的化学方程式② 与水反应产生新物质的结果,理由是④
与水反应产生新物质的结果,理由是④(2)B和C中出现的不同现象可得出的结论是
(3)E是尾气吸收装置,写出其中发生的反应方程式:
您最近一年使用:0次
名校
2 . 某化学兴趣小组为探究碳酸氢钠的热稳定性,并利用其产物验证过氧化钠与二氧化碳的反应,按以下装置图进行实验,按要求填空。

(1) 中反应的化学方程式为
中反应的化学方程式为___________ 。
(2) 中浓硫酸的作用是
中浓硫酸的作用是___________ , 中收集的气体主要是
中收集的气体主要是___________ 。
(3) 中发生反应的化学方程式为
中发生反应的化学方程式为___________ ,反应每生成1个 分子转移
分子转移___________ 个电子。
(4) 中现象是
中现象是___________ ,反应的离子方程式是___________ 。
(5)某次实验结束后, 试管中余下
试管中余下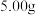 固体,充分加热使其完全分解,固体的质量减少了
固体,充分加热使其完全分解,固体的质量减少了 ,则
,则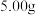 固体中未分解的
固体中未分解的 的质量分数是
的质量分数是___________ 。

(1)
 中反应的化学方程式为
中反应的化学方程式为(2)
 中浓硫酸的作用是
中浓硫酸的作用是 中收集的气体主要是
中收集的气体主要是(3)
 中发生反应的化学方程式为
中发生反应的化学方程式为 分子转移
分子转移(4)
 中现象是
中现象是(5)某次实验结束后,
 试管中余下
试管中余下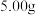 固体,充分加热使其完全分解,固体的质量减少了
固体,充分加热使其完全分解,固体的质量减少了 ,则
,则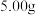 固体中未分解的
固体中未分解的 的质量分数是
的质量分数是
您最近一年使用:0次
名校
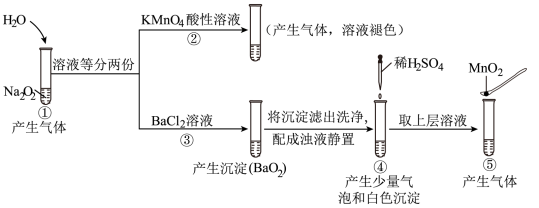
3 . 探究H2O2与水的反应,实验如下。下列分析错误的是
(已知: 、
、 )
)
(已知:
 、
、 )
)
| A.①、⑤中产生的气体都能使带火星的木条复燃 |
B.②中 和⑤中 和⑤中 的所起的作用不同 的所起的作用不同 |
C.通过③能比较酸性: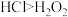 |
| D.④中发生了氧化还原反应和复分解反应 |
您最近一年使用:0次
2021-11-20更新
|
851次组卷
|
3卷引用:甘肃庆阳市宁县2021-2022学年高一上学期期末考试化学试题
名校
解题方法
4 . 某化学小组探究“NO2能与赤热的铜反应生成氧化铜和氮气”。已知:
Ⅰ.NO和Cu不反应
Ⅱ.NO和FeSO4溶液反应:NO + FeSO4= FeSO4·NO(棕色)
Ⅲ.NO和酸性KMnO4溶液反应生成NO 和Mn2+
和Mn2+
设计实验装置如图所示(各装置中液态试剂均足量 )。

回答下列问题:
(1)写出A中发生反应的离子方程式:____________ 。
(2)关闭K1、K3、打开K2,滴加浓硝酸一段时间后关闭K2、打开K3,再点燃C处酒精灯,这样操作的目的是___________ 。
(3)实验过程中观察到下列现象:
①D中浅绿色溶液变成棕色,得出实验结论-NO2的还原产物________ (填代号)。
a.一定是NO和N2b.一定有NO c.一定无NO d.可能有NO
②E中有明显现象,该现象是____________ ,写出发生反应的离子方程式:____________ 。
(4)实验结束时关闭K3,打开K2、将导管末端插入NaOH溶液中,然后熄灭酒精灯,再__________ (填操作),打开K1鼓入大量空气处理装置内污染气体。若实验探究结论成立,E中针筒活塞显示V mL(已换算成标准状况)不再发生变化,此时铜全部被氧化为CuO,则V=____________ (用含 m的代数式表示)。
Ⅰ.NO和Cu不反应
Ⅱ.NO和FeSO4溶液反应:NO + FeSO4= FeSO4·NO(棕色)
Ⅲ.NO和酸性KMnO4溶液反应生成NO
 和Mn2+
和Mn2+设计实验装置如图所示(各装置中

回答下列问题:
(1)写出A中发生反应的离子方程式:
(2)关闭K1、K3、打开K2,滴加浓硝酸一段时间后关闭K2、打开K3,再点燃C处酒精灯,这样操作的目的是
(3)实验过程中观察到下列现象:
①D中浅绿色溶液变成棕色,得出实验结论-NO2的还原产物
a.一定是NO和N2b.一定有NO c.一定无NO d.可能有NO
②E中有明显现象,该现象是
(4)实验结束时关闭K3,打开K2、将导管末端插入NaOH溶液中,然后熄灭酒精灯,再
您最近一年使用:0次
2021-10-21更新
|
273次组卷
|
2卷引用:甘肃省兰州市第二十七中学2022届高三上学期第一次月考化学试题
名校
解题方法
5 . 2021年9月17日 ,搭载聂海胜、刘伯明、汤洪波三位航天英雄的神舟十二号飞船顺利返回东风着陆场。其中黄色的超氧化钾(
,搭载聂海胜、刘伯明、汤洪波三位航天英雄的神舟十二号飞船顺利返回东风着陆场。其中黄色的超氧化钾( )常作为航天飞船舱的氧气来源,某学习小组设计以下实验探究
)常作为航天飞船舱的氧气来源,某学习小组设计以下实验探究 的性质,请回答相关问题:
的性质,请回答相关问题:
(1)Ⅰ.探究 与水的反应
与水的反应
Ⅱ.探究 与
与 的反应
的反应

学习小组的实验操作如下:
①检查装置气密性,然后装入药品
②打开 通入
通入 ,排尽装置内原气体后关闭
,排尽装置内原气体后关闭
③打开分液漏斗活塞 反应
反应
④反应结束后再次打开 通入
通入 ,排尽装置内原气体后关闭
,排尽装置内原气体后关闭
⑤拆卸装置至实验完成
(2)写出 装置发生的化学方程式为
装置发生的化学方程式为___________ 。
(3)甲同学认为利用上述装置验证“ 与
与 反应生成
反应生成 ”存在不足之处,请分析甲同学认为存在不足的原因
”存在不足之处,请分析甲同学认为存在不足的原因___________ (用离子反应方程式说明)。
(4)学习小组听取甲同学的建议改进装置后再实验,待 完全反应后,将装置
完全反应后,将装置 中固体加水溶解,配成
中固体加水溶解,配成 溶液,等分为
溶液,等分为 、
、 两份。
两份。
①向 溶液中加入足量的盐酸酸化的
溶液中加入足量的盐酸酸化的 溶液,充分反应后,将沉淀过滤、洗涤、干燥,称重为
溶液,充分反应后,将沉淀过滤、洗涤、干燥,称重为 。
。
②将 溶液移入
溶液移入___________ (填仪器名称)中,用 酸性
酸性 溶液滴定,终点时消耗酸性
溶液滴定,终点时消耗酸性 溶液
溶液 。
。
③依据上述现象和数据,请写出该实验总反应的化学方程式___________ 。
 ,搭载聂海胜、刘伯明、汤洪波三位航天英雄的神舟十二号飞船顺利返回东风着陆场。其中黄色的超氧化钾(
,搭载聂海胜、刘伯明、汤洪波三位航天英雄的神舟十二号飞船顺利返回东风着陆场。其中黄色的超氧化钾( )常作为航天飞船舱的氧气来源,某学习小组设计以下实验探究
)常作为航天飞船舱的氧气来源,某学习小组设计以下实验探究 的性质,请回答相关问题:
的性质,请回答相关问题:(1)Ⅰ.探究
 与水的反应
与水的反应| 实验操作 | 现象 | 结论与解释 |
(1)取少量 固体于试管中,滴加少量水,将带火星的木条靠近试管口,反应结束后,溶液分成两份 固体于试管中,滴加少量水,将带火星的木条靠近试管口,反应结束后,溶液分成两份 | 快速产生气泡,木条复燃 | 产生的气体是 |
| (2)一份滴加酚酞试液 | 先变红后褪色 | 可能的产物是 |
(3)另一份滴加 溶液 溶液 | 观察到 |
Ⅱ.探究
 与
与 的反应
的反应
学习小组的实验操作如下:
①检查装置气密性,然后装入药品
②打开
 通入
通入 ,排尽装置内原气体后关闭
,排尽装置内原气体后关闭③打开分液漏斗活塞
 反应
反应④反应结束后再次打开
 通入
通入 ,排尽装置内原气体后关闭
,排尽装置内原气体后关闭⑤拆卸装置至实验完成
(2)写出
 装置发生的化学方程式为
装置发生的化学方程式为(3)甲同学认为利用上述装置验证“
 与
与 反应生成
反应生成 ”存在不足之处,请分析甲同学认为存在不足的原因
”存在不足之处,请分析甲同学认为存在不足的原因(4)学习小组听取甲同学的建议改进装置后再实验,待
 完全反应后,将装置
完全反应后,将装置 中固体加水溶解,配成
中固体加水溶解,配成 溶液,等分为
溶液,等分为 、
、 两份。
两份。①向
 溶液中加入足量的盐酸酸化的
溶液中加入足量的盐酸酸化的 溶液,充分反应后,将沉淀过滤、洗涤、干燥,称重为
溶液,充分反应后,将沉淀过滤、洗涤、干燥,称重为 。
。②将
 溶液移入
溶液移入 酸性
酸性 溶液滴定,终点时消耗酸性
溶液滴定,终点时消耗酸性 溶液
溶液 。
。③依据上述现象和数据,请写出该实验总反应的化学方程式
您最近一年使用:0次
2021-10-20更新
|
213次组卷
|
3卷引用:甘肃省兰州市第一中学2021-2022学年高三上学期第一次月考(10月)化学试题
名校
解题方法
6 . 下列实验操作与预期实验现象、所得实验结论一致的是
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向酸性 溶液中通入 溶液中通入 | 紫红色褪去 |  具有漂白性 具有漂白性 |
| B | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
| C | 将 样品溶于稀硫酸后,滴加 样品溶于稀硫酸后,滴加 溶液 溶液 | 溶液变红 |  样品中一定含有 样品中一定含有 |
| D | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 金属铝熔化而不滴落下来 | 金属铝熔点比氧化铝低 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-10-20更新
|
216次组卷
|
2卷引用:甘肃省兰州市第一中学2021-2022学年高三上学期第一次月考(10月)化学试题
名校
7 . 某同学在实验室中进行如下实验:
(1)写出实验Ⅲ中反应的离子方程式:______
(2)写出实验Ⅱ反应后所得蓝色溶液中溶质的电离方程式:______
| 编号 | Ⅰ | Ⅱ | Ⅲ |
| 实验 |  |  |  |
| 现象 | 没有明显变化, 溶液仍为无色 | 有白色沉淀生 成,溶液为蓝色 | 有无色 气泡产生 |
(2)写出实验Ⅱ反应后所得蓝色溶液中溶质的电离方程式:
您最近一年使用:0次
2021-10-12更新
|
57次组卷
|
2卷引用:甘肃省永昌县第一高级中学2021-2022学年高一上学期第一次月考化学试题
名校
解题方法
8 . 如图所示,在坩埚中放一小块钠,加热至熔化,用玻璃棒蘸取少量无水CuSO4 粉末与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成。据此判断下列说法中不正确的是
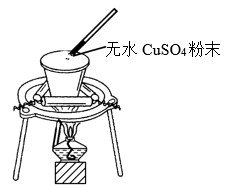

| A.上述反应是置换反应 |
| B.上述反应放出大量的热 |
| C.加热且无水条件下,Na可以与CuSO4反应并生成Cu |
| D.将无水CuSO4粉末改为CuSO4溶液,反应现象相同 |
您最近一年使用:0次
2021-10-11更新
|
179次组卷
|
3卷引用:甘肃省甘谷县第四中学2021-2022学年高一上学期第二阶段考(期中)化学试题
名校
解题方法
9 . 某学生为了探究钠与CO2的反应,利用如图所示装置进行实验。(已知PdCl2能被CO还原得到黑色的金属Pd)
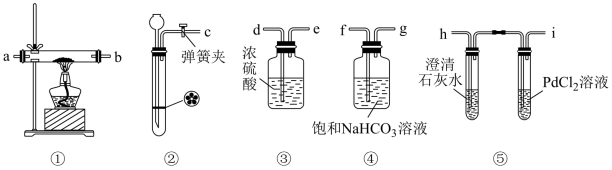
(1)请将图中各装置连接完整(填装置中的字母):c→f→g→______ →______ →a→b→h
(2)若用稀HCl与CaCO3反应制备CO2,向装置②中加入稀HCl后,发现CaCO3接触不到稀HCl,且实验室里的稀HCl已经用完,为使反应能顺利进行,可向长颈漏斗中再加入的试剂是___________
(3)检查装置气密性并装好药品后,点燃酒精灯之前应进行的操作是打开弹簀夹,让CO2充满整个装置,当观察到___________ 时再点燃酒精灯。
(4)若反应过程中CO2足量,探究钠与CO2充分反应后生成物可能的情况,某同学认为生成的物质仅为Na2CO3固体,老师认为仅生成Na2CO3是不可能的,请你说出不可能的理由___________ 。
(5)假设反应过程中有下列两种情况:
I.装置⑤中的PdCl2溶液中观察到有黑色沉淀生成,该反应的离子方程式为___________ ,装置①中的固体成分只有一种,且向该固体中加入稀HCl产生能使澄清石灰水变浑浊的气体,写出钠与CO2反应的化学方程式___________
II.装置①中钠的质量为0.46g,充分反应后,将装置①中的固体加入足量稀HCl中产生224mL(标准状况)CO2气体,且溶液中还有固体残留,写出钠与CO2反应的化学方程式___________ 。

(1)请将图中各装置连接完整(填装置中的字母):c→f→g→
(2)若用稀HCl与CaCO3反应制备CO2,向装置②中加入稀HCl后,发现CaCO3接触不到稀HCl,且实验室里的稀HCl已经用完,为使反应能顺利进行,可向长颈漏斗中再加入的试剂是___________
| A.H2SO4溶液 | B.CCl4 | C.苯 | D.稀HNO3 |
(4)若反应过程中CO2足量,探究钠与CO2充分反应后生成物可能的情况,某同学认为生成的物质仅为Na2CO3固体,老师认为仅生成Na2CO3是不可能的,请你说出不可能的理由
(5)假设反应过程中有下列两种情况:
I.装置⑤中的PdCl2溶液中观察到有黑色沉淀生成,该反应的离子方程式为
II.装置①中钠的质量为0.46g,充分反应后,将装置①中的固体加入足量稀HCl中产生224mL(标准状况)CO2气体,且溶液中还有固体残留,写出钠与CO2反应的化学方程式
您最近一年使用:0次
名校
解题方法
10 . FeBr2是有机催化剂,易潮解。在加热条件下Fe与HBr反应可生成FeBr2。某实验小组用下列装置设计实验制备FeBr2(F的加热装置已省略)。
已知:银氨溶液中存在平衡[Ag(NH3)2]+(aq) Ag+(aq)+2NH3(aq)。
Ag+(aq)+2NH3(aq)。
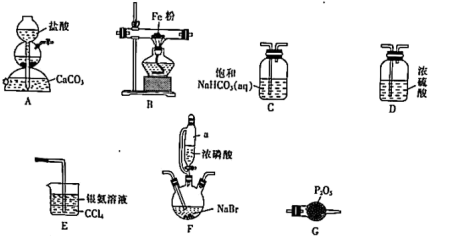
请回答下列问题:
(1)装置A的名称是___ 。
(2)气流从左到右,装置连接顺序为A→______→_____→F→______→______→E(填标号)___ 。
(3)实验中观察到装置E中银氨溶液变浑浊,其原因是____ (用必要的文字和化学用语解释)。
(4)实验室不用浓硝酸与溴化钠反应制备溴化氢,其主要原因是____ 。
(5)设计简易实验检验FeBr2中是否混有Fe单质:___ 。
(6)为了探究FeBr2的性质,设计如下实验:
取21.6gFeBr2溶于水,缓慢通入V1mLCl2 (标准状况),充分反应后,加入适量CCl4,振荡、静置。四氯化碳层呈无色,在水层中滴加KSCN溶液,溶液变红色。由此推知,还原性:Fe2+___ (填“>”“<”或“=”)Br-,V1的最大值为___ 。
(7)测定FeBr2产品纯度:取xgFeBr2产品溶于水,配成250mL溶液,取25.00mL配制的溶液,加入过量的AgNO3溶液中,充分反应后过滤、洗涤、干燥、称重,固体质量为m1g。产品纯度为____ (只列计算式)。
已知:银氨溶液中存在平衡[Ag(NH3)2]+(aq)
 Ag+(aq)+2NH3(aq)。
Ag+(aq)+2NH3(aq)。
请回答下列问题:
(1)装置A的名称是
(2)气流从左到右,装置连接顺序为A→______→_____→F→______→______→E(填标号)
(3)实验中观察到装置E中银氨溶液变浑浊,其原因是
(4)实验室不用浓硝酸与溴化钠反应制备溴化氢,其主要原因是
(5)设计简易实验检验FeBr2中是否混有Fe单质:
(6)为了探究FeBr2的性质,设计如下实验:
取21.6gFeBr2溶于水,缓慢通入V1mLCl2 (标准状况),充分反应后,加入适量CCl4,振荡、静置。四氯化碳层呈无色,在水层中滴加KSCN溶液,溶液变红色。由此推知,还原性:Fe2+
(7)测定FeBr2产品纯度:取xgFeBr2产品溶于水,配成250mL溶液,取25.00mL配制的溶液,加入过量的AgNO3溶液中,充分反应后过滤、洗涤、干燥、称重,固体质量为m1g。产品纯度为
您最近一年使用:0次
2021-10-01更新
|
169次组卷
|
3卷引用:甘肃省白银市靖远县第四中学2022届高三10月月考化学试题



