2022·广东深圳·一模
解题方法
1 . 碘化钾常用作合成有机化合物的原料。某实验小组设计实验探究KI的还原性。
I.配制KI溶液
(1)配制500mL 的KI溶液,需要称取KI的质量为
的KI溶液,需要称取KI的质量为___________ g。
(2)下列关于配制KI溶液的操作错误的是___________(填序号)。
II.探究不同条件下空气中氧气氧化KI的速率。
(3)酸性条件下KI能被空气中氧气氧化,发生反应的离子方程式为___________ 。
(4)通过实验组别1和组别2探究温度对氧化速率的影响。其中a=___________ ,b=___________ 。
(5)设计实验组别3的目的是___________ 。
III.探究反应“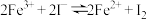 ”为可逆反应。
”为可逆反应。
试剂: KI溶液,
KI溶液,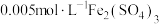 溶液,淀粉溶液,
溶液,淀粉溶液,
 溶液,KSCN溶液。实验如下:
溶液,KSCN溶液。实验如下:
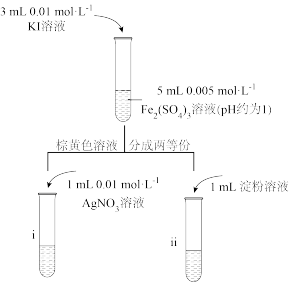
(6)甲同学通过试管i和试管ii中现象结合可证明该反应为可逆反应,则试管i中现象为___________ ;乙同学认为该现象无法证明该反应为可逆反应,原因为___________ 。
(7)请选择上述试剂重新设计实验,证明该反应为可逆反应:___________ 。
I.配制KI溶液
(1)配制500mL
 的KI溶液,需要称取KI的质量为
的KI溶液,需要称取KI的质量为(2)下列关于配制KI溶液的操作错误的是___________(填序号)。
A. | B. | C. | D. |
II.探究不同条件下空气中氧气氧化KI的速率。
| 组别 | 温度 | KI溶液 |  溶液 溶液 | 蒸馏水 | 淀粉溶液 | ||
| c(KI) | V | 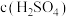 | V | ||||
| 1 | 298K |  | 5mL |  | 5mL | 10mL | 3滴 |
| 2 | 313K |  |  mL mL | 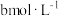 | 5mL | 10mL | 3滴 |
| 3 | 298K |  | 10mL |  | 5mL | 5mL | 3滴 |
(4)通过实验组别1和组别2探究温度对氧化速率的影响。其中a=
(5)设计实验组别3的目的是
III.探究反应“
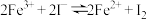 ”为可逆反应。
”为可逆反应。试剂:
 KI溶液,
KI溶液,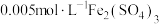 溶液,淀粉溶液,
溶液,淀粉溶液,
 溶液,KSCN溶液。实验如下:
溶液,KSCN溶液。实验如下:
(6)甲同学通过试管i和试管ii中现象结合可证明该反应为可逆反应,则试管i中现象为
(7)请选择上述试剂重新设计实验,证明该反应为可逆反应:
您最近一年使用:0次
2022-08-28更新
|
1038次组卷
|
3卷引用:回归教材重难点11 熟记“五气体”制备实验、“两定量”测定实验-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)
(已下线)回归教材重难点11 熟记“五气体”制备实验、“两定量”测定实验-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)陕西省西安市周至县第六中学2023-2024学年高三上学期11月期中化学试题广东省深圳市光明区2023届高三上学期第一次模拟考试化学试题
2 . 某化学探究活动小组为制备 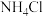 并探究
并探究  的某些性质,进行了以下实验:
的某些性质,进行了以下实验:
(1)该小组用 和HCl合成
和HCl合成 (实验装置如图)。
(实验装置如图)。
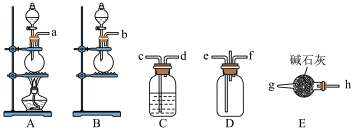
①在A装置中利用浓硫酸和 NaCl制备 HCl,写出用 A 装置制备 HCl时发生反应的化学方程式:___________ 。若B装置的分液漏斗中装浓氨水,烧瓶中盛放的试剂为___________ 。
②为使 和HCl充分混合并反应,上述装置的连接顺序为a→c→d→
和HCl充分混合并反应,上述装置的连接顺序为a→c→d→___________ ,___________ ←g←h←b。
③D装置的不足之处为___________ 。
(2)取0.5g 镁粉加入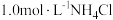 溶液中进行
溶液中进行  性质探究实验,观察到反应剧烈,产生有刺激性气味的气体和灰白色难溶固体。该小组进行以下探究:
性质探究实验,观察到反应剧烈,产生有刺激性气味的气体和灰白色难溶固体。该小组进行以下探究:
①气体成分探究:
用排水(滴加几滴石蕊)法收集一小试管产生的气体,滴有石蕊的水溶液颜色变为___________ ,经检验小试管中气体为 H2。
②沉淀成分探究:
过滤,将得到的灰白色固体洗涤数次,至洗涤液中滴加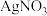 溶液后无明显浑浊。将洗涤后的固体溶于稀 HNO3,再滴加 AgNO3溶液,出现白色沉淀。灰白色固体可能是
溶液后无明显浑浊。将洗涤后的固体溶于稀 HNO3,再滴加 AgNO3溶液,出现白色沉淀。灰白色固体可能是___________ (填化学式)。
③反应机理探究:
猜想一:NH4Cl溶液中c(H⁺)大,与Mg反应快。
猜想二:NH 与Mg反应剧烈,产生氢气。
与Mg反应剧烈,产生氢气。
资料显示:a.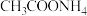 溶液呈中性;b.Cl⁻对该反应几乎无影响。
溶液呈中性;b.Cl⁻对该反应几乎无影响。
为验证猜想一,小组设计如图一实验,分别向两试管中加入0.5g Mg粉,结果两试管反应剧烈程度相当,说明猜想 不合理,试剂X应为___________ 。
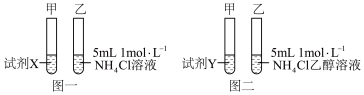
为验证猜想二,小组设计如图二实验,分别向两试管中加入0.5g Mg粉,结果甲试管无现象,乙试管反应剧烈,说明猜想二合理,试剂Y应为___________ 。
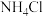 并探究
并探究  的某些性质,进行了以下实验:
的某些性质,进行了以下实验:(1)该小组用
 和HCl合成
和HCl合成 (实验装置如图)。
(实验装置如图)。
①在A装置中利用浓硫酸和 NaCl制备 HCl,写出用 A 装置制备 HCl时发生反应的化学方程式:
②为使
 和HCl充分混合并反应,上述装置的连接顺序为a→c→d→
和HCl充分混合并反应,上述装置的连接顺序为a→c→d→③D装置的不足之处为
(2)取0.5g 镁粉加入
 溶液中进行
溶液中进行  性质探究实验,观察到反应剧烈,产生有刺激性气味的气体和灰白色难溶固体。该小组进行以下探究:
性质探究实验,观察到反应剧烈,产生有刺激性气味的气体和灰白色难溶固体。该小组进行以下探究:①气体成分探究:
用排水(滴加几滴石蕊)法收集一小试管产生的气体,滴有石蕊的水溶液颜色变为
②沉淀成分探究:
过滤,将得到的灰白色固体洗涤数次,至洗涤液中滴加
 溶液后无明显浑浊。将洗涤后的固体溶于稀 HNO3,再滴加 AgNO3溶液,出现白色沉淀。灰白色固体可能是
溶液后无明显浑浊。将洗涤后的固体溶于稀 HNO3,再滴加 AgNO3溶液,出现白色沉淀。灰白色固体可能是③反应机理探究:
猜想一:NH4Cl溶液中c(H⁺)大,与Mg反应快。
猜想二:NH
 与Mg反应剧烈,产生氢气。
与Mg反应剧烈,产生氢气。资料显示:a.
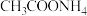 溶液呈中性;b.Cl⁻对该反应几乎无影响。
溶液呈中性;b.Cl⁻对该反应几乎无影响。为验证猜想一,小组设计如图一实验,分别向两试管中加入0.5g Mg粉,结果两试管反应剧烈程度相当,说明猜想 不合理,试剂X应为

为验证猜想二,小组设计如图二实验,分别向两试管中加入0.5g Mg粉,结果甲试管无现象,乙试管反应剧烈,说明猜想二合理,试剂Y应为
您最近一年使用:0次
3 . 磺酰氯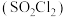 是重要的有机合成试剂,实验室可利用
是重要的有机合成试剂,实验室可利用 与
与 在活性炭作用下反应制取少量
在活性炭作用下反应制取少量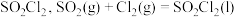 ,该反应放热,装置如图所示(部分夹持装置省略)。已知
,该反应放热,装置如图所示(部分夹持装置省略)。已知 的熔点为
的熔点为 ,沸点为
,沸点为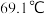 ,遇水能发生剧烈的水解反应,并产生白雾。
,遇水能发生剧烈的水解反应,并产生白雾。
回答下列问题。 ,则下列试剂组合中合适的是___________。
,则下列试剂组合中合适的是___________。
(2)导管a的作用是___________ ;仪器b中的试剂是___________ 。
(3)实验结束时,关闭分液漏斗活塞和止水夹k,此时装置戊的作用是___________ 。
(4) 遇水发生反应生成两种酸,该反应的化学方程式为
遇水发生反应生成两种酸,该反应的化学方程式为___________ 。
(5)若反应中消耗的氯气体积为 (标准状况下),最后经过分离提纯得到
(标准状况下),最后经过分离提纯得到 纯净的磺酰氯,则磺酰氯的产率为
纯净的磺酰氯,则磺酰氯的产率为___________ (产率:实际产量/理论产量 )。
)。
(6)已知酸性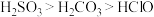 ,借助该酸性排序,使用以下装置设计实验证明
,借助该酸性排序,使用以下装置设计实验证明 的酸性强于
的酸性强于 ,其连接顺序应为
,其连接顺序应为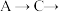
___________ 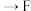 ;能证明
;能证明 的酸性强于
的酸性强于 的实验现象为
的实验现象为___________ 。
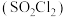 是重要的有机合成试剂,实验室可利用
是重要的有机合成试剂,实验室可利用 与
与 在活性炭作用下反应制取少量
在活性炭作用下反应制取少量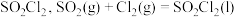 ,该反应放热,装置如图所示(部分夹持装置省略)。已知
,该反应放热,装置如图所示(部分夹持装置省略)。已知 的熔点为
的熔点为 ,沸点为
,沸点为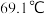 ,遇水能发生剧烈的水解反应,并产生白雾。
,遇水能发生剧烈的水解反应,并产生白雾。回答下列问题。

 ,则下列试剂组合中合适的是___________。
,则下列试剂组合中合适的是___________。A. 的硫酸和 的硫酸和 | B. 的硝酸和 的硝酸和 固体 固体 |
C.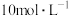 的硫酸和 的硫酸和 固体 固体 | D. 的硫酸和 的硫酸和 固体 固体 |
(2)导管a的作用是
(3)实验结束时,关闭分液漏斗活塞和止水夹k,此时装置戊的作用是
(4)
 遇水发生反应生成两种酸,该反应的化学方程式为
遇水发生反应生成两种酸,该反应的化学方程式为(5)若反应中消耗的氯气体积为
 (标准状况下),最后经过分离提纯得到
(标准状况下),最后经过分离提纯得到 纯净的磺酰氯,则磺酰氯的产率为
纯净的磺酰氯,则磺酰氯的产率为 )。
)。(6)已知酸性
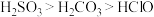 ,借助该酸性排序,使用以下装置设计实验证明
,借助该酸性排序,使用以下装置设计实验证明 的酸性强于
的酸性强于 ,其连接顺序应为
,其连接顺序应为
 ;能证明
;能证明 的酸性强于
的酸性强于 的实验现象为
的实验现象为
您最近一年使用:0次
2024-02-23更新
|
145次组卷
|
2卷引用:广东省深圳实验学校高中部2023-2024学年高一上学期第三阶段考试化学试题
名校
4 . 苯酚是重要的化工原料,有关苯酚的实验如下:
Ⅰ.苯酚的制备:工业上用异丙苯氧化法合成苯酚,其生产流程如图:
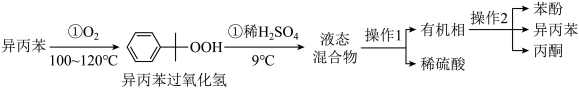
(1)异丙苯氧化过程①温度不能过高的原因是___________ 。
(2)检验有机相中是否含有水的试剂是___________ 。
(3)操作1为分液,下列关于分液漏斗的使用叙述正确的是___________。

(4)操作2的名称是___________ 。
Ⅱ.苯酚的实验探究
探究铁盐种类和pH对苯酚与 显色反应的影响。
显色反应的影响。
查阅资料:ⅰ.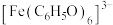 为紫色;
为紫色;
ⅱ. 对苯酚与
对苯酚与 的显色反应无影响;
的显色反应无影响;
ⅲ.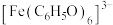 对特定波长光的吸收程度(用吸光度A表示)与
对特定波长光的吸收程度(用吸光度A表示)与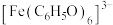 的浓度在一定范围内成正比。
的浓度在一定范围内成正比。
ⅳ.苯酚与 的显色原理:
的显色原理: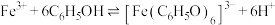
提出猜想:猜想1: 对苯酚与
对苯酚与 的显色反应有影响
的显色反应有影响
猜想2: 对苯酚与
对苯酚与 的显色反应有影响。
的显色反应有影响。
猜想3: 对苯酚与
对苯酚与 的显色反应有影响。
的显色反应有影响。
进行实验:常温下,用盐酸调节配制得到pH分别为a和b的 溶液
溶液 ,用硫酸调节配制得到pH分别为a和b的
,用硫酸调节配制得到pH分别为a和b的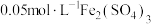 溶液。取
溶液。取 苯酚溶液于试管中,按实验1~4分别再加入
苯酚溶液于试管中,按实验1~4分别再加入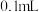 含
含 的试剂,显色
的试剂,显色 后用紫外-可见分光光度计测定该溶液的吸光度(本实验pH改变对
后用紫外-可见分光光度计测定该溶液的吸光度(本实验pH改变对 水解程度的影响可忽略)。
水解程度的影响可忽略)。
结果讨论:实验结果为 。
。
(5)①根据实验结果,小组同学认为此结果不足以证明猜想3成立的理由是___________ 。
②为进一步验证猜想,小组同学设计了实验5和6,补充下表中试剂M为___________ 。(限选试剂: 溶液、
溶液、 溶液、
溶液、 固体、
固体、 固体)
固体)
③小组同学得出实验结果为: ,
,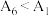 ,由此得出此结论是
,由此得出此结论是___________ 。
④根据实验1~6的结果,小组同学得出猜想3成立,且 对
对 与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是
与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是___________ 。
Ⅰ.苯酚的制备:工业上用异丙苯氧化法合成苯酚,其生产流程如图:

(1)异丙苯氧化过程①温度不能过高的原因是
(2)检验有机相中是否含有水的试剂是
(3)操作1为分液,下列关于分液漏斗的使用叙述正确的是___________。

| A.分液漏斗在使用前需检查上口的塞子和旋塞芯处是否漏水 |
| B.放出液体时,应打开玻璃塞或使塞上的凹槽对准漏斗口上的小孔,并使下端管口紧贴烧杯内壁 |
| C.振荡操作应如图所示,并打开旋塞不断放气 |
| D.放出下层液体后,再从漏斗下端口放出上层液体 |
Ⅱ.苯酚的实验探究
探究铁盐种类和pH对苯酚与
 显色反应的影响。
显色反应的影响。查阅资料:ⅰ.
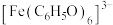 为紫色;
为紫色;ⅱ.
 对苯酚与
对苯酚与 的显色反应无影响;
的显色反应无影响;ⅲ.
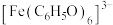 对特定波长光的吸收程度(用吸光度A表示)与
对特定波长光的吸收程度(用吸光度A表示)与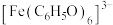 的浓度在一定范围内成正比。
的浓度在一定范围内成正比。ⅳ.苯酚与
 的显色原理:
的显色原理: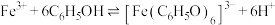
提出猜想:猜想1:
 对苯酚与
对苯酚与 的显色反应有影响
的显色反应有影响猜想2:
 对苯酚与
对苯酚与 的显色反应有影响。
的显色反应有影响。猜想3:
 对苯酚与
对苯酚与 的显色反应有影响。
的显色反应有影响。进行实验:常温下,用盐酸调节配制得到pH分别为a和b的
 溶液
溶液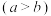 ,用硫酸调节配制得到pH分别为a和b的
,用硫酸调节配制得到pH分别为a和b的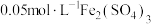 溶液。取
溶液。取 苯酚溶液于试管中,按实验1~4分别再加入
苯酚溶液于试管中,按实验1~4分别再加入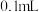 含
含 的试剂,显色
的试剂,显色 后用紫外-可见分光光度计测定该溶液的吸光度(本实验pH改变对
后用紫外-可见分光光度计测定该溶液的吸光度(本实验pH改变对 水解程度的影响可忽略)。
水解程度的影响可忽略)。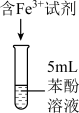 | 序号 | 含 的试剂 的试剂 | 吸光度 | |
 溶液 溶液 | 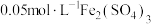 溶液 溶液 | |||
| 1 |  | / |  | |
| 2 |  | / |  | |
| 3 | / |  |  | |
| 4 | / |  | 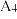 | |
 。
。(5)①根据实验结果,小组同学认为此结果不足以证明猜想3成立的理由是
②为进一步验证猜想,小组同学设计了实验5和6,补充下表中试剂M为
 溶液、
溶液、 溶液、
溶液、 固体、
固体、 固体)
固体) | 序号 |  溶液 溶液 | 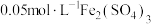 溶液 溶液 | 再加试剂 | 吸光度 |
| 5 | / |  |  固体 固体 | 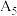 | |
| 6 |  | / | 试剂M_______ | 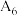 |
 ,
, ,由此得出此结论是
,由此得出此结论是④根据实验1~6的结果,小组同学得出猜想3成立,且
 对
对 与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是
与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是
您最近一年使用:0次
2023-09-22更新
|
110次组卷
|
2卷引用:福建省福安市第一中学2023-2024学年高三上学期第一次月考化学试题
名校
解题方法
5 . 某兴趣小组同学们对SO2的性质进行探究。
实验一:探究SO2的漂白原理,装置如图所示,部分装置省略。实验发现,装置B中溶液变红色,不褪色;装置C中溶液为红色,装置D中溶液褪色。向烧瓶中加入200mL18.4mol/L浓硫酸,充分反应直至装置A中反应停止。
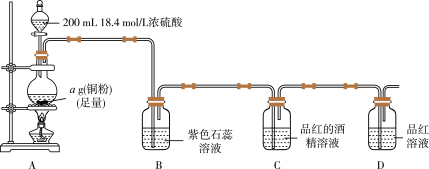
回答下列问题:
(1)装置A中发生反应的化学方程式为_______ 。
(2)根据装置C、D中出现的现象,对漂白品红的粒子提出如下猜想:
猜想1:H2SO3;
猜想2:HSO ;
;
猜想3:_______ 。
针对猜想2设计简单实验探究漂白原理:_______ 。
(3)实验完毕后,甲同学设计如下实验测定剩余硫酸浓度(不考虑体积变化,假设锌与稀硫酸反应只产生氢气):

①实验部分操作:(a)调平量气管和烧杯的液面;(b)冷却至室温;(c)读数正确的先后操作顺序是_______ (填字母)。
②已知开始时量气管读数为V1mL,最终读数为V2mL(均折合成标准状况,且V2>V1)。则铜与浓硫酸发生反应的最低硫酸浓度为_______ mol/L。
实验二:结合实验一的装置,乙同学添加一些装置(如图),利用SO2和Cl2在活性炭催化作用下制取亚硫酰氯SOCl2。亚硫酰氯是重要的化工试剂,沸点较低,易水解。
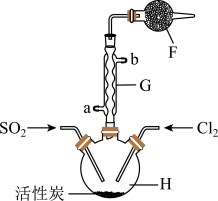
(4)①G仪器的进水口是_______ (填“a”或“b”),其作用是_______ 。
②F仪器的作用是_______ 。
(5)已知SOCl2具有还原性,其氧化产物为SO 。丙同学为了验证SOCl2和FeCl3·6H2O能发生氧化还原反应,做以下实验:取少量SOCl2和FeCl3·6H2O反应后的混合物于试管中,加水充分溶解后……接下来的实验操作和现象都正确的是_______(填字母序号)。
。丙同学为了验证SOCl2和FeCl3·6H2O能发生氧化还原反应,做以下实验:取少量SOCl2和FeCl3·6H2O反应后的混合物于试管中,加水充分溶解后……接下来的实验操作和现象都正确的是_______(填字母序号)。
实验一:探究SO2的漂白原理,装置如图所示,部分装置省略。实验发现,装置B中溶液变红色,不褪色;装置C中溶液为红色,装置D中溶液褪色。向烧瓶中加入200mL18.4mol/L浓硫酸,充分反应直至装置A中反应停止。

回答下列问题:
(1)装置A中发生反应的化学方程式为
(2)根据装置C、D中出现的现象,对漂白品红的粒子提出如下猜想:
猜想1:H2SO3;
猜想2:HSO
 ;
;猜想3:
针对猜想2设计简单实验探究漂白原理:
(3)实验完毕后,甲同学设计如下实验测定剩余硫酸浓度(不考虑体积变化,假设锌与稀硫酸反应只产生氢气):

①实验部分操作:(a)调平量气管和烧杯的液面;(b)冷却至室温;(c)读数正确的先后操作顺序是
②已知开始时量气管读数为V1mL,最终读数为V2mL(均折合成标准状况,且V2>V1)。则铜与浓硫酸发生反应的最低硫酸浓度为
实验二:结合实验一的装置,乙同学添加一些装置(如图),利用SO2和Cl2在活性炭催化作用下制取亚硫酰氯SOCl2。亚硫酰氯是重要的化工试剂,沸点较低,易水解。

(4)①G仪器的进水口是
②F仪器的作用是
(5)已知SOCl2具有还原性,其氧化产物为SO
 。丙同学为了验证SOCl2和FeCl3·6H2O能发生氧化还原反应,做以下实验:取少量SOCl2和FeCl3·6H2O反应后的混合物于试管中,加水充分溶解后……接下来的实验操作和现象都正确的是_______(填字母序号)。
。丙同学为了验证SOCl2和FeCl3·6H2O能发生氧化还原反应,做以下实验:取少量SOCl2和FeCl3·6H2O反应后的混合物于试管中,加水充分溶解后……接下来的实验操作和现象都正确的是_______(填字母序号)。| A.滴加几滴KSCN溶液,溶液变为红色 |
| B.滴加几滴BaCl2溶液,有白色沉淀生成 |
| C.加入少量稀硝酸,再滴加几滴BaCl2溶液,有白色沉淀生成 |
| D.滴加几滴酸性KMnO4溶液,紫红色消失 |
您最近一年使用:0次
6 . 某化学活动小组进行如下实验探究活动。
Ⅰ.甲组同学用如图所示装置制备氨气
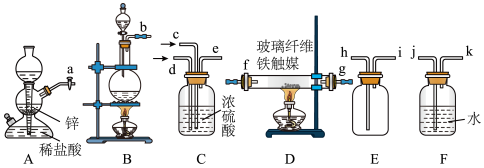
已知:加热NH4Cl和NaNO2饱和溶液可以制取N2,缓慢通入原料气有利于D中合成氨气。
(1)图示装置从左到右正确的连接顺序(填接口字母)
 →e→f→g→
→e→f→g→____ →____ →____ →____ 。
(2)写出B中制取N2的反应的离子方程式__________
(3)装置C的作用:干燥气体、_______________ 、_____________ 。
(4)小组经过讨论认为尾气逸出存在安全隐患,可以采用下列哪种方法处理____ (填选项字母)。
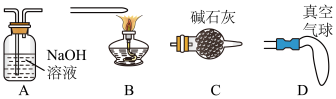
Ⅱ.乙组同学查阅资料:制取氮气用的亚硝酸钠外观与食盐相似,毒性较强。可以用如下装置(略去部分夹持仪器)制备。
已知:①2NO+Na2O2=2NaNO2;
②酸性条件下,NO和NO2都能与MnO 反应生成NO
反应生成NO 和Mn2+。
和Mn2+。
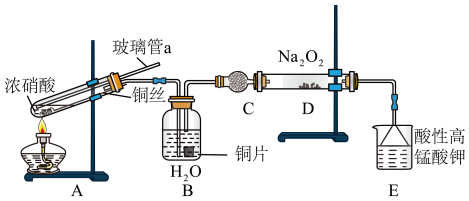
(5)仪器C的名称为______ ,A中与碎铜片比较使用铜丝的优点_______________ 。
(6)实验结束后还可以通入空气把残存气体排入后面装置吸收,防止污染大气。NO在E中发生反应的离子方程式为_____________ 。
Ⅰ.甲组同学用如图所示装置制备氨气

已知:加热NH4Cl和NaNO2饱和溶液可以制取N2,缓慢通入原料气有利于D中合成氨气。
(1)图示装置从左到右正确的连接顺序(填接口字母)
 →e→f→g→
→e→f→g→(2)写出B中制取N2的反应的离子方程式
(3)装置C的作用:干燥气体、
(4)小组经过讨论认为尾气逸出存在安全隐患,可以采用下列哪种方法处理

Ⅱ.乙组同学查阅资料:制取氮气用的亚硝酸钠外观与食盐相似,毒性较强。可以用如下装置(略去部分夹持仪器)制备。

已知:①2NO+Na2O2=2NaNO2;
②酸性条件下,NO和NO2都能与MnO
 反应生成NO
反应生成NO 和Mn2+。
和Mn2+。(5)仪器C的名称为
(6)实验结束后还可以通入空气把残存气体排入后面装置吸收,防止污染大气。NO在E中发生反应的离子方程式为
您最近一年使用:0次
2020-11-30更新
|
277次组卷
|
2卷引用:河北省石家庄市辛集市2022-2023学年高一下学期7月期末考试化学试题



