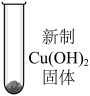
a.Cu(OH)2与OH-反应生成[Cu(OH)4]2-(蓝紫色)。
b.Cu2O在碱性条件下稳定,在酸性溶液中不稳定,如:Cu2O
 Cu+Cu2+。
Cu+Cu2+。Ⅰ.探究NaOH在乙醛与新制Cu(OH)2浊液反应中的作用
实验记录如下:
| 序号 | 5% CuSO4 溶液体积 | 10% NaOH 溶液的体积 | 振荡后现象 | 加入0.5 mL 40%的乙醛溶液,加热后现象 |
| ⅰ | 2 mL | 5滴 | 浅蓝绿色沉淀 | 仍然为浅蓝绿色沉淀 |
| ⅱ | 2 mL | 0.5 mL | 浅蓝色沉淀 | 浅蓝色沉淀→黑色沉淀 |
| ⅲ | 5滴 | 2 mL | 蓝色浊液 | 蓝色浊液→黄绿色浊液→橙黄色浊液→砖红色浊液 |
(2)实验ⅰ、ⅱ、ⅲ中,实验
(3)为进一步探究新制Cu(OH)2与乙醛反应的本质,科研小组又进行如下实验:
| 序号 | 实验 | 加入试剂 | 加入0.5 mL 40%的乙醛溶液,加热后现象 |
| ⅳ |
| 3 mL H2O | 蓝色沉淀→黑色沉淀 |
| ⅴ | 3 mL 10% NaOH | 蓝色浊液→黄绿色浊液→橙黄色浊液→砖红色浊液 |
② 实验ⅴ能够产生砖红色沉淀的原因是
Ⅱ.对“黄绿色浊液→橙黄色浊液”异常现象的探究及产物的分离检验
(4)针对实验ⅲ、ⅴ中“黄绿色浊液→橙黄色浊液”的异常现象,通过实验证明了“橙黄色”与乙醛在碱性条件下发生反应生成的有色物质有关。实验方案为:
(5)为分离实验ⅴ中砖红色物质,进行如下操作:取实验ⅴ反应后浊液,加入50%乙醇溶液,过滤,得到砖红色固体W,滤液放置24小时后,底部有几粒黄豆大小的黄色油状物质P。
① 文献表明:黄色油状物质P主要是乙醛在碱性条件下的聚合产物。在碱作用下,乙醛发生羟醛缩合反应生成CH3CH=CHCHO,CH3CH=CHCHO与乙醛继续发生羟醛缩合反应,最终生成多烯醛聚合物。写出由乙醛生成多烯醛聚合物的反应方程式
② 为进一步确定砖红色固体W的成分,该小组同学设计以下实验方案:取少量砖红色固体W于试管中,加入过量稀H2SO4,振荡,溶液变为蓝色并有紫红色固体。由实验现象能否得出该砖红色固体W是Cu2O,理由是
(1)在试管中加入少量FeSO4样品,加水溶解,滴加KSCN溶液,溶液逐渐变
(2)已知FeSO4的分解产物中含有SO2和SO3。将纯净FeSO4和有关试剂放入如图所示的装置,打开K1和K2,缓缓通入N2,加热,实验后反应管中残留固体为红棕色粉末。

②装置C中盛放的溶液为
A.品红 B.NaOH C.BaCl2 D.浓H2SO4
③盛有NaOH溶液的装置的作用是
④实验时装置D中除有气泡冒出外,还可观察到的实验现象为
3 . (1)实验室有一瓶久置的亚硫酸钠溶液,同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
【提出问题】该溶液中溶质成分是什么?该溶液中亚硫酸钠的物质的量浓度是多少?
【查阅资料】 有较强还原性,在空气中易被氧气氧化
有较强还原性,在空气中易被氧气氧化
【作出猜想】猜想 :没有变质,成分是
:没有变质,成分是
猜想 :完全变质,成分是
:完全变质,成分是
猜想 :部分变质,成分是
:部分变质,成分是 和
和
【实验探究Ⅰ】
(1)甲组设计实验探究溶液是否变质
甲组 | 实验操作 | 现象 | 结论 |
步骤 | 取少量样品于试管中加入过量稀盐酸 | 产生气泡 | 溶液中含有 |
步骤 | 另取样品于试管中,滴加足量氯化钡溶液,再滴加足量稀盐酸 | 溶液中含有 |
实验结论:样品部分变质。样品在空气中变质的化学方程式:
【实验探究Ⅱ】
(2)乙组设计如下实验测定
 溶液物质的量浓度。
溶液物质的量浓度。①连好装置并检查装置气密性,在锥形瓶中放入 该样品,通入
该样品,通入 。
。
②称量C装置的质量为 。
。
③关闭活塞 ,用注射器推入浓硫酸至不再产生气泡,注射器可以换为
,用注射器推入浓硫酸至不再产生气泡,注射器可以换为
④打开活塞 ,再缓缓鼓入一定量的
,再缓缓鼓入一定量的 ,继续通入
,继续通入 的作用是
的作用是
⑤再次称量C装置的质量为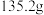 。
。

⑥计算出原溶液中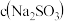 =
= 装置,实验结果将
装置,实验结果将 填“偏大”“不变”或“偏小”
填“偏大”“不变”或“偏小” 。
。
Ⅰ.探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如图所示的装置进行实验,装置C中可观察到的现象是

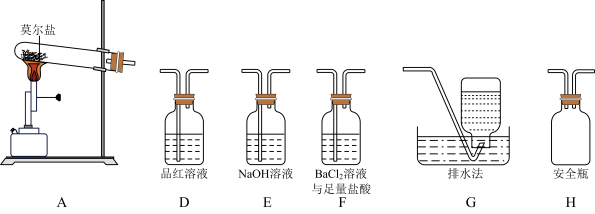
(3)证明含有SO3的实验现象是
Ⅱ.为测定硫酸亚铁铵晶体纯度,称取m g莫尔盐样品,配成500 mL溶液。甲、乙两位同学设计了如下两个实验方案。
(甲)方案一:取20.00 mL硫酸亚铁铵溶液用0.1000mol/L的酸性KMnO4溶液进行三次滴定。
(乙)方案二:
(4)方案一中发生反应的离子方程式为:
(5)方案二中判断所加BaCl2溶液已足量的操作及现象为
(6)若甲乙两同学实验操作都正确,但方案一的测定结果总是小于方案二,推测可能原因:
(7)乙方案测定出硫酸亚铁铵纯度为
查阅资料信息:①2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3。
②酸性KMnO4溶液可将低价氮的氧化物或酸根离子氧化为NO
 。
。(1)NaNO2的制备(夹持装置和加热装置均已略,已检查装置气密性)。
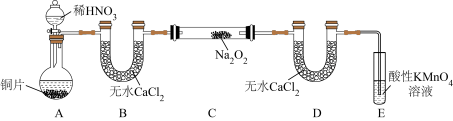
①若没有装置B,则装置C中Na2O2与水发生反应:
②制得的NaNO2固体中混有的杂质主要为NaNO3,改进措施是在装置A、B间添加
③装置E中发生的主要反应的离子方程式为
(2)验证亚硝酸钠与70%硫酸反应的气体产物为NO和NO2的混合气体。
已知:FeSO4溶液可吸收NO;NO2的沸点为21℃,熔点为-11℃。

①为了检验装置A中生成的气体产物,装置的连接顺序是A→
②反应前应打开弹簧夹1,先通入一段时间氮气,目的是
(3)测定某亚硝酸钠样品的纯度。
设该样品的杂质均不与酸性KMnO4溶液反应,可用酸性KMnO4溶液测定NaNO2的含量。称取2.0g亚硝酸钠样品溶于水配成250mL溶液,取出25.00mL溶液于锥形瓶中,再用0.1000mol•L-1的酸性KMnO4标准溶液进行滴定,消耗酸性KMnO4标准溶液的体积如表:
| 实验组 | 第一组 | 第二组 | 第三组 | 第四组 |
| 消耗酸性KMnO4标准溶液的体积/mL | 9.97 | 10.02 | 12.01 | 10.01 |
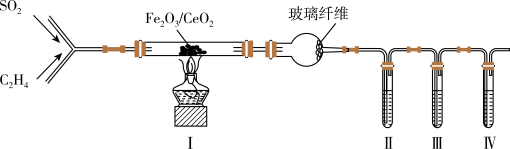
(1)装置I中反应的化学方程式为
(2)球形干燥管中玻璃纤维的作用是
(3)为能检验生成的CO2,装置II、III、IV中盛放的试剂依次是
①酸性KMnO4溶液 ②澄清石灰水 ③Br2的CCl4溶液
(4)为制作反应的催化剂,实验小组制备了一定质量的Fe2O3(含FeO杂质)样品,为测定其中Fe2O3的质量分数,现进行如下实验:
步骤1:称取0.20 g样品,向样品中加入足量的盐酸使其完全溶解。
步骤2:向溶液中加入足量的KI溶液,充分反应。
步骤3:向溶液中加入0.10 mol·L-1 Na2S2O3溶液,恰好完全反应时消耗Na2S2O3溶液20.00 mL。该过程所发生反应为:2Na2S2O3+I2=2NaI+Na2S4O6。
①步骤2中所发生反应的
②计算样品中所含Fe2O3的质量分数