名校
1 . 以黄铁矿(主要成分FeS2))为原料生产硫酸,并将产出的炉渣和尾气进行资源综合利用,减轻对环境的污染,其中一种流程如下图所示。
(1)煅烧前,黄铁矿需要研磨,目的是___________ 。
(2)煅烧黄铁矿的化学方程式是___________ 。
(3)过程①中处理尾气SO2的离子反应方程式为___________ 。
(4)已知1molSO2(g) 完全转化为1molSO3(g) 放热99kJ,写出SO2催化氧化的热化学方程式___________ 。
(5)因为Na2S2O5在保存过程中易被氧化,导致商品Na2S2O5中存在Na2SO4.欲检验Na2S2O5已变质的实验方法为___________ 。
(6)一般用K2Cr2O7滴定分析法测定还原铁粉的纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用标准K2Cr2O7溶液滴定其中的Fe2+。反应方程式为(方程式未配平):
Cr2O72-+Fe2++H+→Cr3++Fe3++H2O。某次实验称取0.2800g样品,滴定时消耗浓度为0.0300mol/L的K2Cr2O7溶液25.00mL,则样品中铁的质量分数为___________ 。(请写出计算过程)

(1)煅烧前,黄铁矿需要研磨,目的是
(2)煅烧黄铁矿的化学方程式是
(3)过程①中处理尾气SO2的离子反应方程式为
(4)已知1molSO2(g) 完全转化为1molSO3(g) 放热99kJ,写出SO2催化氧化的热化学方程式
(5)因为Na2S2O5在保存过程中易被氧化,导致商品Na2S2O5中存在Na2SO4.欲检验Na2S2O5已变质的实验方法为
(6)一般用K2Cr2O7滴定分析法测定还原铁粉的纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用标准K2Cr2O7溶液滴定其中的Fe2+。反应方程式为(方程式未配平):
Cr2O72-+Fe2++H+→Cr3++Fe3++H2O。某次实验称取0.2800g样品,滴定时消耗浓度为0.0300mol/L的K2Cr2O7溶液25.00mL,则样品中铁的质量分数为
您最近一年使用:0次
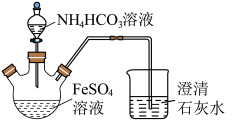
2 . 碳酸亚铁(FeCO3)难溶于水,常用于制取铁盐或补血剂。一种FeCO3的制备装置如图所示。实验中观察到三颈烧瓶中有大量白色沉淀产生,烧杯中溶液变浑浊,恰好完全反应时,三颈烧瓶内溶液中只含一种溶质。过滤后可得FeCO3沉淀。______________ 。
(2)反应后所得沉淀需进行过滤、洗涤。检验沉淀已经洗涤干净的方法是___________ 。
(3)FeCO3在潮湿的空气中会转化为Fe(OH)3并进步转化为Fe2O3。写出FeCO3在潮湿的空气中转化为Fe(OH)3的化学方程式:__________________ 。
(4)某FeCO3固体被部分氧化,为测定其中Fe3+的质量分数,现进行如下实验:称取5.000g固体样品,加足量盐酸溶解,将溶液稀释至100mL,量取20.00mL该溶液,加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0.1000mol/LNa2S2O3溶液滴定,当滴定至终点时消耗Na2S2O3溶液20.00mL。已知实验过程中发生反应如下:2Fe3++2I-=2Fe2++I2,I2+2S2O =S4O
=S4O +2I-。计算FeCO3固体样品中Fe3+的质量分数,写出计算过程
+2I-。计算FeCO3固体样品中Fe3+的质量分数,写出计算过程_________ 。
(2)反应后所得沉淀需进行过滤、洗涤。检验沉淀已经洗涤干净的方法是
(3)FeCO3在潮湿的空气中会转化为Fe(OH)3并进步转化为Fe2O3。写出FeCO3在潮湿的空气中转化为Fe(OH)3的化学方程式:
(4)某FeCO3固体被部分氧化,为测定其中Fe3+的质量分数,现进行如下实验:称取5.000g固体样品,加足量盐酸溶解,将溶液稀释至100mL,量取20.00mL该溶液,加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0.1000mol/LNa2S2O3溶液滴定,当滴定至终点时消耗Na2S2O3溶液20.00mL。已知实验过程中发生反应如下:2Fe3++2I-=2Fe2++I2,I2+2S2O
 =S4O
=S4O +2I-。计算FeCO3固体样品中Fe3+的质量分数,写出计算过程
+2I-。计算FeCO3固体样品中Fe3+的质量分数,写出计算过程
您最近一年使用:0次
解题方法
3 . 实验室以废铜屑(杂质为CuO、Al2O3、Fe2O3、FeO和SiO2)为原料制取碱式碳酸铜[aCu(OH)2·bCuCO3]的流程如下:
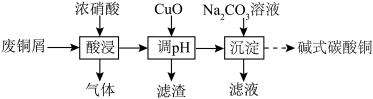
已知部分氢氧化物开始沉淀与沉淀完全的pH见下表:
(1)按如图所示的装置加料后进行“酸浸”操作。

①提高Cu元素浸出速率的方法还有___________ 。
②与使用如图所示漏斗相比,使用漏斗Y的优点是___________ 。
(2)“调pH”的合理范围是___________ 。
(3)“沉淀”时需要对混合物加热至70℃但又不宜过高,理由是___________ 。
(4)可采用滴定法、热重分析法分别对碱式碳酸铜的组成进行分析。
①滴定法涉及的部分反应:2Cu2++4I-=2CuI↓+I2、I2+2Na2S2O3=2NaI+Na2S4O6。请补充完整测定碱式碳酸铜中Cu元素含量的实验方案:准确称取一定质量的碱式碳酸铜样品,在搅拌下分批加入稀硫酸直至固体完全溶解,配成100mL溶液。___________ ;根据数据计算Cu元素含量(须使用的试剂:KI溶液、0.1000mol/LNa2S2O3溶液、淀粉溶液)。
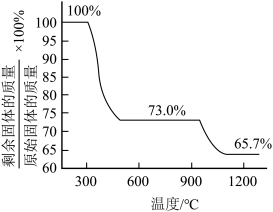
②测得碱式碳酸铜的热重分析结果如图所示,已知当剩余固体质量与原始固体质量的比值为65.7%时固体呈砖红色,则计算可知
___________ (保留3位有效数字)。

已知部分氢氧化物开始沉淀与沉淀完全的pH见下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 6.5 | 4.2 | 3.4 |
| 沉淀完全pH | 3.2 | 9.7 | 6.7 | 4.0 |
(1)按如图所示的装置加料后进行“酸浸”操作。

①提高Cu元素浸出速率的方法还有
②与使用如图所示漏斗相比,使用漏斗Y的优点是

(2)“调pH”的合理范围是
(3)“沉淀”时需要对混合物加热至70℃但又不宜过高,理由是
(4)可采用滴定法、热重分析法分别对碱式碳酸铜的组成进行分析。
①滴定法涉及的部分反应:2Cu2++4I-=2CuI↓+I2、I2+2Na2S2O3=2NaI+Na2S4O6。请补充完整测定碱式碳酸铜中Cu元素含量的实验方案:准确称取一定质量的碱式碳酸铜样品,在搅拌下分批加入稀硫酸直至固体完全溶解,配成100mL溶液。
②测得碱式碳酸铜的热重分析结果如图所示,已知当剩余固体质量与原始固体质量的比值为65.7%时固体呈砖红色,则计算可知

您最近一年使用:0次
解题方法
4 . 以氯酸钠(NaClO3)等为原料制备亚氯酸钠(NaClO2)的工艺流程如下:_______ (填化学式)。
②每有1mol NaClO3参加反应,理论上可生成ClO2的物质的量为_______ mol。
(2)反应2在如图1装置中发生(该反应放出大量的热,且温度高于60℃时NaClO2分解生成NaClO3和NaCl)_______ 。
②实际反应中发现消耗的NaOH比理论值偏少,原因可能是_______ 。
③通常会将该装置放置于冰水浴中,其目的是_______ 。
a.提高ClO2吸收率 b.防止NaClO2分解 c.提高反应速度
(3)ClO2是一种广谱型消毒剂,对一切经水体传播的病原微生物均有很好的杀灭效果。用ClO2处理过的水中ClO2、 的含量可用连续碘量法进行测定。ClO2被I-还原为
的含量可用连续碘量法进行测定。ClO2被I-还原为 或Cl-的转化率与溶液的
或Cl-的转化率与溶液的 关系如图2所示。
关系如图2所示。
滴定步骤:①准确量取100mL水样加到碘量瓶中,调节水样的 为
为 ,加入足量的KI晶体,充分反应后,用0.1mol / L Na2S2O3溶液滴定至淡黄色,加入淀粉溶液,滴定至终点,消耗Na2S2O3溶液45mL。②调节溶液的pH< 2.0,
,加入足量的KI晶体,充分反应后,用0.1mol / L Na2S2O3溶液滴定至淡黄色,加入淀粉溶液,滴定至终点,消耗Na2S2O3溶液45mL。②调节溶液的pH< 2.0, 可以被I-完全转化为Cl-,继续用0.1mol / L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液200mL。
可以被I-完全转化为Cl-,继续用0.1mol / L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液200mL。
根据上述数据,测得该水样中的 浓度是多少
浓度是多少_____ ?
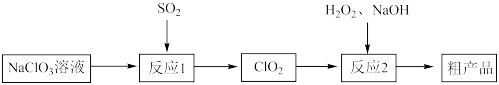
②每有1mol NaClO3参加反应,理论上可生成ClO2的物质的量为
(2)反应2在如图1装置中发生(该反应放出大量的热,且温度高于60℃时NaClO2分解生成NaClO3和NaCl)
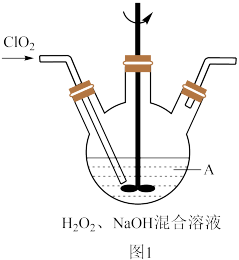
②实际反应中发现消耗的NaOH比理论值偏少,原因可能是
③通常会将该装置放置于冰水浴中,其目的是
a.提高ClO2吸收率 b.防止NaClO2分解 c.提高反应速度
(3)ClO2是一种广谱型消毒剂,对一切经水体传播的病原微生物均有很好的杀灭效果。用ClO2处理过的水中ClO2、
 的含量可用连续碘量法进行测定。ClO2被I-还原为
的含量可用连续碘量法进行测定。ClO2被I-还原为 或Cl-的转化率与溶液的
或Cl-的转化率与溶液的 关系如图2所示。
关系如图2所示。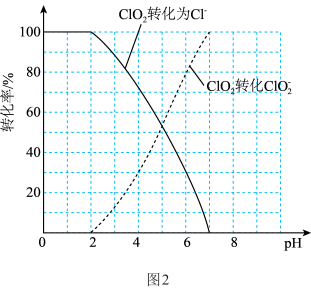
滴定步骤:①准确量取100mL水样加到碘量瓶中,调节水样的
 为
为 ,加入足量的KI晶体,充分反应后,用0.1mol / L Na2S2O3溶液滴定至淡黄色,加入淀粉溶液,滴定至终点,消耗Na2S2O3溶液45mL。②调节溶液的pH< 2.0,
,加入足量的KI晶体,充分反应后,用0.1mol / L Na2S2O3溶液滴定至淡黄色,加入淀粉溶液,滴定至终点,消耗Na2S2O3溶液45mL。②调节溶液的pH< 2.0, 可以被I-完全转化为Cl-,继续用0.1mol / L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液200mL。
可以被I-完全转化为Cl-,继续用0.1mol / L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液200mL。根据上述数据,测得该水样中的
 浓度是多少
浓度是多少
您最近一年使用:0次
名校
解题方法
5 . 一种以生石灰(CaO)为原料制备KClO3的流程如下:
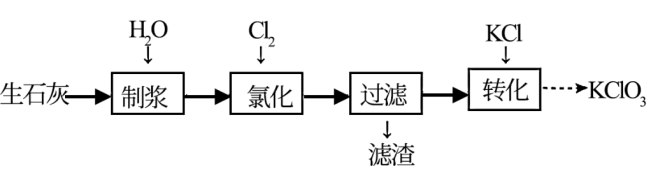
注:氯化过程中Cl2与Ca(OH)2作用生成Ca(ClO)2,Ca(ClO)2进一步转化为Ca(ClO3)2。
(1)制浆过程中发生的化学反应方程式为___________ 。
(2)氯化过程中须缓慢通入Cl2。
①缓慢通入Cl2的目的是___________ 。
②生成Ca(ClO)2的化学方程式为___________ 。
③氯化过程中会有少量无色无味气体生成,该气体可能是___________ (填化学式)。
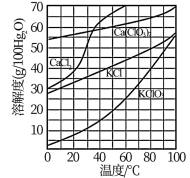
(3)根据如图的溶解度曲线,回答下列问题。
向滤液中加入过量KCl固体可将溶液中Ca(ClO3)2转化为KClO3固体而析出的原因是___________ 。若溶液中KClO3的含量为100g∙L−1,从该溶液中尽可能多地析出KClO3固体的方法是___________ 。

注:氯化过程中Cl2与Ca(OH)2作用生成Ca(ClO)2,Ca(ClO)2进一步转化为Ca(ClO3)2。
(1)制浆过程中发生的化学反应方程式为
(2)氯化过程中须缓慢通入Cl2。
①缓慢通入Cl2的目的是
②生成Ca(ClO)2的化学方程式为
③氯化过程中会有少量无色无味气体生成,该气体可能是
(3)根据如图的溶解度曲线,回答下列问题。
向滤液中加入过量KCl固体可将溶液中Ca(ClO3)2转化为KClO3固体而析出的原因是

您最近一年使用:0次
2021-01-27更新
|
278次组卷
|
2卷引用:江苏省盐城市田家炳中学2021-2022学年高一上学期期中考试化学试题



