名校
1 . 某同学查阅资料得知,无水三氯化铝能催化乙醇制备乙烯,为探究适宜的反应温度,设计如下反应装置:
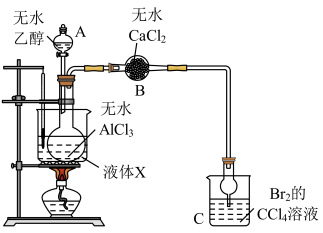
检验装置气密性后,在圆底烧瓶中加入5g无水三氯化铝,加热至100℃,通过A加入10mL无水乙醇,观察并记录C中溶液褪色的时间。重复上述实验,分别观察并记录在110℃、120℃、130℃、140℃时C中溶液褪色的时间,实验结果如图所示。

完成下列填空:
(1)仪器B的名称是_______ ;该实验所采用的加热方式优点是_______ ,液体X可能是_______ (选填编号)。
a.水 b.酒精 c.油 d.乙酸
(2)根据实验结果,判断适宜的反应温度为_______ 。
(3)在140℃进行实验,长时间反应未观察到C中溶液褪色,可能的原因是_______ 。
(4)在120℃进行实验,若将B改为装有浓硫酸的洗气瓶,长时间反应未观察到C中溶液褪色,可能的原因是_______ 。
(5)教材中用乙醇和浓硫酸在170℃时制备乙烯。和教材实验相比,用三氯化铝做催化剂制备乙烯的优点有_______ 、_______ (列举两点)。
工业无水氯化铝含量测定的主要原理是:Ag++Cl-=AgCl↓。将1.400g工业无水氯化铝样品溶解后配成500mL溶液,量取25.00mL置于锥形瓶中,用浓度为0.1000mol·L-1的AgNO3标准溶液进行滴定,达到终点时消耗标准液15.30mL。
(6)该样品中AlCl3的质量分数为_______ (保留3位有效数字)。
(7)某次测定结果误差为-2.1%,可能会造成此结果的原因是_______ (选填编号)。
a.称量样品时少量吸水潮解 b.配制AlCl3溶液时未洗涤烧杯
c.滴定管水洗后未用AgNO3标准溶液润洗 d.样品中含有少量Al(NO3)3杂质

检验装置气密性后,在圆底烧瓶中加入5g无水三氯化铝,加热至100℃,通过A加入10mL无水乙醇,观察并记录C中溶液褪色的时间。重复上述实验,分别观察并记录在110℃、120℃、130℃、140℃时C中溶液褪色的时间,实验结果如图所示。

完成下列填空:
(1)仪器B的名称是
a.水 b.酒精 c.油 d.乙酸
(2)根据实验结果,判断适宜的反应温度为
(3)在140℃进行实验,长时间反应未观察到C中溶液褪色,可能的原因是
(4)在120℃进行实验,若将B改为装有浓硫酸的洗气瓶,长时间反应未观察到C中溶液褪色,可能的原因是
(5)教材中用乙醇和浓硫酸在170℃时制备乙烯。和教材实验相比,用三氯化铝做催化剂制备乙烯的优点有
工业无水氯化铝含量测定的主要原理是:Ag++Cl-=AgCl↓。将1.400g工业无水氯化铝样品溶解后配成500mL溶液,量取25.00mL置于锥形瓶中,用浓度为0.1000mol·L-1的AgNO3标准溶液进行滴定,达到终点时消耗标准液15.30mL。
(6)该样品中AlCl3的质量分数为
(7)某次测定结果误差为-2.1%,可能会造成此结果的原因是
a.称量样品时少量吸水潮解 b.配制AlCl3溶液时未洗涤烧杯
c.滴定管水洗后未用AgNO3标准溶液润洗 d.样品中含有少量Al(NO3)3杂质
您最近一年使用:0次
2023-04-14更新
|
419次组卷
|
3卷引用:专题22 实验探究题
2 . 钒被称为“工业味精”,在发展现代工业、国防等方面发挥着重要的作用。V2O5有强氧化性,在实验室以V2O5为原料制备氧钒(IV)碱式碳酸铵晶体,此晶体难溶于水,其化学式为(NH4)5[(VO)6(CO3)4(OH)9]·10H2O,是制备热敏材料VO2的原料。过程如下:
V2O5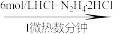 VOCl2溶液
VOCl2溶液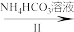 (NH4)5[(VO)6(CO3)4(OH)9]·10H2O
(NH4)5[(VO)6(CO3)4(OH)9]·10H2O
已知:①氧化性:V2O5 > Cl2;②VO2+能被O2氧化。
(1)步骤I 中除生成VOCl2外,还生成绿色环保,无毒无害的产物,则反应的化学方程式为______ 。若只用浓盐酸与V2O5反应也能制备VOCl2溶液,但从环保角度分析,使用N2H4·2HCl的目的是_______ 。
(2)步骤II可在如图装置中进行:

①为了排尽装置中的空气,防止VO2+被氧化,上述装置依次连接的合理顺序为c→________ (按气流方向,用小写字母表示)。
②连接好装置,检查气密性良好后,加入试剂,开始实验,具体操作为____________________ 。
(3)实验结束时,将析出的产品过滤,用饱和NH4HCO3溶液洗涤。请从溶解平衡的角度解释,使用饱和NH4HCO3溶液洗涤晶体的原因:___________ 。证明沉淀已经洗涤干净的方法是_______ 。
(4)测定粗产品中钒的含量。实验步骤如下:
称量ag产品于锥形瓶中,用稀硫酸溶解后得到VO2+的溶液,加入0.02mol·L-1 KMnO4溶液至稍过量,加入某还原剂除去过量KMnO4溶液,最后用cmol·L-1 (NH4)2Fe(SO4)2标准溶液滴定至终点(VO +Fe2++2H+=VO2++Fe3++H2O),消耗标准溶液的体积为bmL。粗产品中钒的质量分数表达式为
+Fe2++2H+=VO2++Fe3++H2O),消耗标准溶液的体积为bmL。粗产品中钒的质量分数表达式为__________________ (以VO2+计,式量为67)。若(NH4)2Fe(SO4)2标准溶液部分变质,则测定结果_______ (填“偏高”、“偏低”或“无影响”)。
V2O5
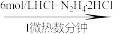 VOCl2溶液
VOCl2溶液 (NH4)5[(VO)6(CO3)4(OH)9]·10H2O
(NH4)5[(VO)6(CO3)4(OH)9]·10H2O 已知:①氧化性:V2O5 > Cl2;②VO2+能被O2氧化。
(1)步骤I 中除生成VOCl2外,还生成绿色环保,无毒无害的产物,则反应的化学方程式为
(2)步骤II可在如图装置中进行:

①为了排尽装置中的空气,防止VO2+被氧化,上述装置依次连接的合理顺序为c→
②连接好装置,检查气密性良好后,加入试剂,开始实验,具体操作为
(3)实验结束时,将析出的产品过滤,用饱和NH4HCO3溶液洗涤。请从溶解平衡的角度解释,使用饱和NH4HCO3溶液洗涤晶体的原因:
(4)测定粗产品中钒的含量。实验步骤如下:
称量ag产品于锥形瓶中,用稀硫酸溶解后得到VO2+的溶液,加入0.02mol·L-1 KMnO4溶液至稍过量,加入某还原剂除去过量KMnO4溶液,最后用cmol·L-1 (NH4)2Fe(SO4)2标准溶液滴定至终点(VO
 +Fe2++2H+=VO2++Fe3++H2O),消耗标准溶液的体积为bmL。粗产品中钒的质量分数表达式为
+Fe2++2H+=VO2++Fe3++H2O),消耗标准溶液的体积为bmL。粗产品中钒的质量分数表达式为
您最近一年使用:0次
3 . 由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化 3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
加酸歧化 3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
已知相关物质的溶解度(20℃)
完成下列填空:
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和______________ 。(填序号)
a.瓷坩埚 b.蒸发皿 c.铁坩埚 d.泥三角
(2)在“加酸岐化”时不宜用硫酸的原因是__________ ;不宜用盐酸的原因是____________ 。反应之后得到高锰酸钾的步骤是:过滤、蒸发结晶、趁热过滤。该步骤能够得到高锰酸钾的原理是____________ 。
(3)采用电解法也可实现K2MnO4的转化,2K2MnO4+2H2O 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为_________________ 。
(4)草酸钠滴定法测定高锰酸钾的质量分数步骤如下:
已知涉及到的反应:
Na2C2O4+H2SO4=H2C2O4(草酸)+Na2SO4,
5H2C2O4+ 2MnO4—+6H+=2Mn2++10CO2↑+ 8H2O
Na2C2O4的式量:134 KMnO4的式量:158)
Ⅰ.称取0.80 g 的高锰酸钾产品,配成50mL溶液。
Ⅱ.称取0.2014 gNa2C2O4,置于锥形瓶中,加入蒸馏水使其溶解,再加入少量硫酸酸化。
Ⅲ.将瓶中溶液加热到75~80℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。消耗高锰酸钾溶液8.48mL。
a.判断达到滴定终点的标志是____________________________ 。
b.样品中高锰酸钾的质量分数为______________ (保留3位小数)。
c.加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度__________ 。(填“偏高”、“偏低”或“无影响”)
d.将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应溶液中Mn2+的浓度随反应时间t的变化如图,其原因可能为_______________ 。

熔融氧化 3MnO2+KClO3+6KOH
 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O加酸歧化 3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
已知相关物质的溶解度(20℃)
| 物质 | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| 溶解度g/100g | 111 | 33.7 | 11.1 | 6.34 |
完成下列填空:
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和
a.瓷坩埚 b.蒸发皿 c.铁坩埚 d.泥三角
(2)在“加酸岐化”时不宜用硫酸的原因是
(3)采用电解法也可实现K2MnO4的转化,2K2MnO4+2H2O
 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为(4)草酸钠滴定法测定高锰酸钾的质量分数步骤如下:
已知涉及到的反应:
Na2C2O4+H2SO4=H2C2O4(草酸)+Na2SO4,
5H2C2O4+ 2MnO4—+6H+=2Mn2++10CO2↑+ 8H2O
Na2C2O4的式量:134 KMnO4的式量:158)
Ⅰ.称取0.80 g 的高锰酸钾产品,配成50mL溶液。
Ⅱ.称取0.2014 gNa2C2O4,置于锥形瓶中,加入蒸馏水使其溶解,再加入少量硫酸酸化。
Ⅲ.将瓶中溶液加热到75~80℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。消耗高锰酸钾溶液8.48mL。
a.判断达到滴定终点的标志是
b.样品中高锰酸钾的质量分数为
c.加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度
d.将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应溶液中Mn2+的浓度随反应时间t的变化如图,其原因可能为

您最近一年使用:0次
10-11高一上·上海·期中
4 . 较低温度下,氯气通入石灰乳中可制得漂白粉,该反应为放热反应。某校甲、乙两化学小组均用200 mL 12 mol/L盐酸与17.4 g MnO2在加热条件下反应制备氯气,并将制备的氯气与过量的石灰乳反应制取漂白粉,用稀NaOH溶液吸收残余的氯气。分析实验结果发现:①甲、乙两组制得的漂白粉中Ca(ClO)2的质量明显小于理论值。②甲组在较高温度下将氯气与过量的石灰乳反应,所制得的产品中Ca(ClO3)2的含量较高。试回答下列问题:
(1)上述实验中理论上最多可制得Ca(ClO)2___________ 克?
(2)实验中所得到的Ca(ClO)2的质量明显小于理论值,试简要分析其可能原因___________ 。
(1)上述实验中理论上最多可制得Ca(ClO)2
(2)实验中所得到的Ca(ClO)2的质量明显小于理论值,试简要分析其可能原因
您最近一年使用:0次



