1 . 三草酸合铁酸钾{K3[Fe(C2O4)3]·3H2O}为绿色晶体,溶于水,难溶于乙醇,可用作有机反应的催化剂。某实验小组用废铁屑(含少量铁锈和FeS等杂质)为原料制备三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O,并测定其铁元素含量。回答下列问题:
(1)制备三草酸合铁酸钾晶体并测定铁元素时,用到的实验仪器除烧杯、玻璃棒、广口瓶、天平、酒精灯、蒸发皿、温度计、胶头滴管、量筒、锥形瓶、滴定管外,还必须使用的仪器有_______(填写选项)。
(2)将废铁屑加入10%NaOH溶液并适当加热,过滤、洗涤后将废铁屑加入到适量稀硫酸中,置于50~60℃热水浴中加热充分反应,将生成的气体洗气后收集,以防治污染。待溶液冷却后加入6mol·L-1氨水,搅拌使其反应完全,过滤、洗涤、干燥,制得浅绿色(NH4)2Fe(SO4)2·6H2O。废铁屑加入到适量稀硫酸中生成的气体通入某盐溶液中洗气,该盐溶液为_______ 。
(3)①称取5g(NH4)2Fe(SO4)2·6H2O固体,溶解并加硫酸酸化,搅拌下加入25mL1mol·L-1H2C2O4)溶液,静置,析出黄色的FeC2O4·2H2O沉淀,过滤并洗涤沉淀2~3次。
②将上述FeC2O4·2H2O沉淀加入10mL饱和草酸钾溶液中,再加入20mL饱和H2C2O4溶液,保持溶液温度40℃,用滴管缓慢滴加3%H2O2,不断搅拌,沉淀慢慢变为深棕色;加热至沸30min,再加入8~9mL草酸溶液,控制pH在3~4,变为绿色透明的三草酸合铁酸钾溶液。
③加热浓缩,缓慢加入95%的乙醇,冷却结晶、过滤,洗涤晶体2~3次,干燥、称量。
其中,生成FeC2O4·2H2O的离子反应方程式为_______ ,保持溶液温度为40℃,采取的加热方式为_______ ;加热至沸30min的目的是_______ ,洗涤晶体所用试剂可以是_______ (填写选项)。
A.水 B.冷水 C.95%的乙醇溶液 D.酒精
(4)已知:2MnO +5C2O
+5C2O +16H+→2Mn2++10CO2↑+8H2O。称量5g三草酸合铁酸钾晶体,用煮沸过的蒸馏水配制成250mL溶液,取25.00mL溶液于锥形瓶中,加稀H2SO4酸化,用0.1mol·L-1KMnO4溶液滴定,重复三次,消耗标准液体积分别为13.98mL、15.62mL、14.02mL。则三草酸合铁酸钾中铁元素的质量分数为
+16H+→2Mn2++10CO2↑+8H2O。称量5g三草酸合铁酸钾晶体,用煮沸过的蒸馏水配制成250mL溶液,取25.00mL溶液于锥形瓶中,加稀H2SO4酸化,用0.1mol·L-1KMnO4溶液滴定,重复三次,消耗标准液体积分别为13.98mL、15.62mL、14.02mL。则三草酸合铁酸钾中铁元素的质量分数为_______ (保留3位小数),若未用稀H2SO4酸化(MnO →MnO
→MnO ),会导致铁含量测定
),会导致铁含量测定_______ (填“偏高”“偏低”或“无影响”)。
(1)制备三草酸合铁酸钾晶体并测定铁元素时,用到的实验仪器除烧杯、玻璃棒、广口瓶、天平、酒精灯、蒸发皿、温度计、胶头滴管、量筒、锥形瓶、滴定管外,还必须使用的仪器有_______(填写选项)。
A. | B. | C. | D. |
(3)①称取5g(NH4)2Fe(SO4)2·6H2O固体,溶解并加硫酸酸化,搅拌下加入25mL1mol·L-1H2C2O4)溶液,静置,析出黄色的FeC2O4·2H2O沉淀,过滤并洗涤沉淀2~3次。
②将上述FeC2O4·2H2O沉淀加入10mL饱和草酸钾溶液中,再加入20mL饱和H2C2O4溶液,保持溶液温度40℃,用滴管缓慢滴加3%H2O2,不断搅拌,沉淀慢慢变为深棕色;加热至沸30min,再加入8~9mL草酸溶液,控制pH在3~4,变为绿色透明的三草酸合铁酸钾溶液。
③加热浓缩,缓慢加入95%的乙醇,冷却结晶、过滤,洗涤晶体2~3次,干燥、称量。
其中,生成FeC2O4·2H2O的离子反应方程式为
A.水 B.冷水 C.95%的乙醇溶液 D.酒精
(4)已知:2MnO
 +5C2O
+5C2O +16H+→2Mn2++10CO2↑+8H2O。称量5g三草酸合铁酸钾晶体,用煮沸过的蒸馏水配制成250mL溶液,取25.00mL溶液于锥形瓶中,加稀H2SO4酸化,用0.1mol·L-1KMnO4溶液滴定,重复三次,消耗标准液体积分别为13.98mL、15.62mL、14.02mL。则三草酸合铁酸钾中铁元素的质量分数为
+16H+→2Mn2++10CO2↑+8H2O。称量5g三草酸合铁酸钾晶体,用煮沸过的蒸馏水配制成250mL溶液,取25.00mL溶液于锥形瓶中,加稀H2SO4酸化,用0.1mol·L-1KMnO4溶液滴定,重复三次,消耗标准液体积分别为13.98mL、15.62mL、14.02mL。则三草酸合铁酸钾中铁元素的质量分数为 →MnO
→MnO ),会导致铁含量测定
),会导致铁含量测定
您最近一年使用:0次
名校
解题方法
2 .  是制备某负载型活性铁催化剂 的主要原料,具有工业生产价值。某化学小组用如下方法制备
是制备某负载型活性铁催化剂 的主要原料,具有工业生产价值。某化学小组用如下方法制备 ,并测定产品中铁的含量。
,并测定产品中铁的含量。
I.制备晶体
i.称取 5 g 莫尔盐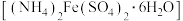 ,用 15 mL 水和几滴
,用 15 mL 水和几滴 溶液充分溶解,再加入25 mL饱和
溶液充分溶解,再加入25 mL饱和 溶液,加热至沸,生成黄色沉淀;
溶液,加热至沸,生成黄色沉淀;
ⅱ.将沉淀洗涤至中性,加入10 mL饱和 溶液,水浴加热至40℃,边搅拌边缓慢滴加
溶液,水浴加热至40℃,边搅拌边缓慢滴加 溶液,沉淀逐渐变为红褐色;
溶液,沉淀逐渐变为红褐色;
ⅲ.将混合物煮沸30 s,加入8 mL饱和 溶液,红褐色沉淀溶解,趁热过滤,滤液冷却后,析出翠绿色晶体,过滤、干燥。
溶液,红褐色沉淀溶解,趁热过滤,滤液冷却后,析出翠绿色晶体,过滤、干燥。
II.测定产品中铁的含量
ⅳ.称量 制得的样品,加水溶解,并加入稀
制得的样品,加水溶解,并加入稀 酸化,再滴入
酸化,再滴入 溶液使其恰好反应;
溶液使其恰好反应;
v.向ⅳ的溶液中加入过量Zn粉,反应完全后,弃去不溶物,向溶液中加入稀 酸化,用
酸化,用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。
。
已知: 为二元弱酸,具有较强的还原性
为二元弱酸,具有较强的还原性
(1)莫尔盐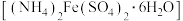 中铁元素的化合价是
中铁元素的化合价是_______ 。
(2)步骤ⅰ中黄色沉淀的化学式为 ,生成该沉淀的离子方程式是
,生成该沉淀的离子方程式是_______ 。
(3)步骤ⅱ中除了生成红褐色沉淀,另一部分铁元素转化为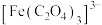 、将下述反应的离子方程式补充完整
、将下述反应的离子方程式补充完整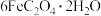 +____+____=
+____+____= ____
____ ,
,_____________ 。
(4)步骤ⅱ中水浴加热的温度不宜过高,原因是_______ 。
(5)步骤iv在铁的含量测定中所起的作用是_______ 。
(6)已知:ⅴ中Zn粉将铁元素全部还原为 ;反应中
;反应中 转化为
转化为 。则该样品中铁元素的质量分数是
。则该样品中铁元素的质量分数是_______ (用含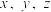 的代数式表示)。
的代数式表示)。
 是制备某负载型活性铁催化剂 的主要原料,具有工业生产价值。某化学小组用如下方法制备
是制备某负载型活性铁催化剂 的主要原料,具有工业生产价值。某化学小组用如下方法制备 ,并测定产品中铁的含量。
,并测定产品中铁的含量。I.制备晶体
i.称取 5 g 莫尔盐
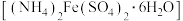 ,用 15 mL 水和几滴
,用 15 mL 水和几滴 溶液充分溶解,再加入25 mL饱和
溶液充分溶解,再加入25 mL饱和 溶液,加热至沸,生成黄色沉淀;
溶液,加热至沸,生成黄色沉淀;ⅱ.将沉淀洗涤至中性,加入10 mL饱和
 溶液,水浴加热至40℃,边搅拌边缓慢滴加
溶液,水浴加热至40℃,边搅拌边缓慢滴加 溶液,沉淀逐渐变为红褐色;
溶液,沉淀逐渐变为红褐色;ⅲ.将混合物煮沸30 s,加入8 mL饱和
 溶液,红褐色沉淀溶解,趁热过滤,滤液冷却后,析出翠绿色晶体,过滤、干燥。
溶液,红褐色沉淀溶解,趁热过滤,滤液冷却后,析出翠绿色晶体,过滤、干燥。II.测定产品中铁的含量
ⅳ.称量
 制得的样品,加水溶解,并加入稀
制得的样品,加水溶解,并加入稀 酸化,再滴入
酸化,再滴入 溶液使其恰好反应;
溶液使其恰好反应;v.向ⅳ的溶液中加入过量Zn粉,反应完全后,弃去不溶物,向溶液中加入稀
 酸化,用
酸化,用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。
。已知:
 为二元弱酸,具有较强的还原性
为二元弱酸,具有较强的还原性(1)莫尔盐
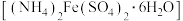 中铁元素的化合价是
中铁元素的化合价是(2)步骤ⅰ中黄色沉淀的化学式为
 ,生成该沉淀的离子方程式是
,生成该沉淀的离子方程式是(3)步骤ⅱ中除了生成红褐色沉淀,另一部分铁元素转化为
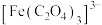 、将下述反应的离子方程式补充完整
、将下述反应的离子方程式补充完整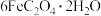 +____+____=
+____+____= ____
____ ,
,(4)步骤ⅱ中水浴加热的温度不宜过高,原因是
(5)步骤iv在铁的含量测定中所起的作用是
(6)已知:ⅴ中Zn粉将铁元素全部还原为
 ;反应中
;反应中 转化为
转化为 。则该样品中铁元素的质量分数是
。则该样品中铁元素的质量分数是 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2020-12-19更新
|
143次组卷
|
4卷引用:上海市闵行区七宝中学2020届高三化学等级考练习(四)
名校
3 . 硫酰氯(SO2Cl2)可用于有机合成和药物制造等。实验室利用SO2和Cl2在活性炭作用下制取SO2Cl2[SO2(g)+Cl2(g) SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
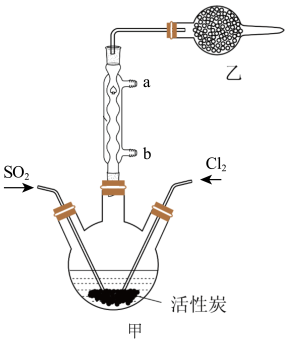
I.SO2Cl2的制备
(1)水应从___ (选填“a”或“b”)口进入。
(2)制取SO2的最佳组合是___ (填标号)。
①Fe+18.4mol/LH2SO4
②Na2SO3+70%H2SO4
③Na2SO3+3mo/LHNO3
(3)乙装置中盛放的试剂是___ 。
(4)制备过程中需要将装置甲置于冰水浴中,原因是___ 。
(5)反应结束后,分离甲中混合物的最佳实验操作是___ 。
II.测定产品中SO2Cl2的含量,实验步骤如下:
①取1.5g产品加入足量Ba(OH)2溶液,充分振荡、过滤、洗涤,将所得溶液均放入锥形瓶中;
②向锥形瓶中加入硝酸酸化,再加入0.2000mol·L-1的AgNO3溶液l00.00mL;
③向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
④加入NH4Fe(SO4)2指示剂,用0.1000mol·L-1NH4SCN溶液滴定过量Ag+,终点所用体积为10.00mL。
已知:Ksp(AgCl)=3.2×10-10 Ksp(AgSCN)=2×10-12
(6)滴定终点的现象为___ 。
(7)产品中SO2Cl2的质量分数为___ %,若步骤③不加入硝基苯则所测SO2Cl2含量将___ (填“偏高”、“偏低”或“无影响”)。
 SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
SO2Cl2(l) ΔH=-97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,有强腐蚀性,不宜接触碱、醇、纤维素等许多无机物和有机物,遇水能发生剧烈反应并产生白雾。回答下列问题:
I.SO2Cl2的制备
(1)水应从
(2)制取SO2的最佳组合是
①Fe+18.4mol/LH2SO4
②Na2SO3+70%H2SO4
③Na2SO3+3mo/LHNO3
(3)乙装置中盛放的试剂是
(4)制备过程中需要将装置甲置于冰水浴中,原因是
(5)反应结束后,分离甲中混合物的最佳实验操作是
II.测定产品中SO2Cl2的含量,实验步骤如下:
①取1.5g产品加入足量Ba(OH)2溶液,充分振荡、过滤、洗涤,将所得溶液均放入锥形瓶中;
②向锥形瓶中加入硝酸酸化,再加入0.2000mol·L-1的AgNO3溶液l00.00mL;
③向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
④加入NH4Fe(SO4)2指示剂,用0.1000mol·L-1NH4SCN溶液滴定过量Ag+,终点所用体积为10.00mL。
已知:Ksp(AgCl)=3.2×10-10 Ksp(AgSCN)=2×10-12
(6)滴定终点的现象为
(7)产品中SO2Cl2的质量分数为
您最近一年使用:0次
2019-12-10更新
|
482次组卷
|
3卷引用:上海大学附属中学2021-2022学年学高三下学期第一次测试化学试题
4 . 绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品中的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

已知:室温下饱和H2S溶液的pH约为3.9;SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
请回答下列问题:
(一)绿矾的制备
38.检验制得的绿矾中是否含有Fe3+的实验操作是_____________________________ 。
39.操作II中,通入硫化氢至饱和的目的是_________________________________ ;在溶液中用硫酸酸化至pH=2的目的是_________________________________________ 。
40.操作IV的顺序依次为:_________________ 、冷却结晶、__________________ 。
(二)绿矾中FeSO4·7H2O含量的测定
若用容量法测定绿矾中FeSO4·7H2O的含量。滴定反应是:5Fe2+ + MnO4—+8H+"5Fe3+ +Mn2++4H2O 。
实验方案如下:
① 称取15.041 g绿矾产品,溶解,在250mL容量瓶中定容。
② 量取25.00mL待测溶液于锥形瓶中。
③ 用0.0500mol/L KMnO4溶液(硫酸酸化)滴定至终点,记录初读数和末读数。
④ 。
⑤ 数据处理。
41.上述实验方案中的步骤④是_____________________________________________ 。洁净的滴定管在滴定前必须进行的操作有:
① 检验活塞是否漏水;
②______________________________________________________________________ ;
③ 向滴定管中加入KMnO4标准溶液到0刻度以上,赶走尖嘴部位的气泡,调节初读数。
(三)数据处理
某小组同学的实验数据记录如下:
42.上述样品中FeSO4·7H2O的质量分数为____________ (用小数表示,保留三位小数)。

已知:室温下饱和H2S溶液的pH约为3.9;SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
请回答下列问题:
(一)绿矾的制备
38.检验制得的绿矾中是否含有Fe3+的实验操作是
39.操作II中,通入硫化氢至饱和的目的是
40.操作IV的顺序依次为:
(二)绿矾中FeSO4·7H2O含量的测定
若用容量法测定绿矾中FeSO4·7H2O的含量。滴定反应是:5Fe2+ + MnO4—+8H+"5Fe3+ +Mn2++4H2O 。
实验方案如下:
① 称取15.041 g绿矾产品,溶解,在250mL容量瓶中定容。
② 量取25.00mL待测溶液于锥形瓶中。
③ 用0.0500mol/L KMnO4溶液(硫酸酸化)滴定至终点,记录初读数和末读数。
④ 。
⑤ 数据处理。
41.上述实验方案中的步骤④是
① 检验活塞是否漏水;
②
③ 向滴定管中加入KMnO4标准溶液到0刻度以上,赶走尖嘴部位的气泡,调节初读数。
(三)数据处理
某小组同学的实验数据记录如下:
| 实验次数 | 初读数(mL) | 末读数(mL) |
| 1 | 0.20 | 21.40 |
| 2 | 0.00 | 21.00 |
| 3 | 1.60 | 26.60 |
42.上述样品中FeSO4·7H2O的质量分数为
您最近一年使用:0次
名校
解题方法
5 . 二氯化砜( )在制药行业中用途广泛。
)在制药行业中用途广泛。 的沸点为77℃,遇水剧烈反应生成
的沸点为77℃,遇水剧烈反应生成 。实验室制活性炭
。实验室制活性炭 的原理为:
的原理为: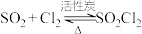 ,部分装置如图所示。回答以下问题:
,部分装置如图所示。回答以下问题:

(1)仪器a的名称为___________ 。
(2)通过控制滴液漏斗旋塞可以释放集气瓶内气体,滴液漏斗中盛放的液态物质b为___________ ,上述装置各接口连接的顺序依次为①、___________ 。
(3)有同学认为如果将制备 的装置放入冰水中,会更有利于二氯化砜的生成,其原因是:
的装置放入冰水中,会更有利于二氯化砜的生成,其原因是:______________________ 。
(4)该实验过程中对反应体系加热的目的是___________ 。
(5)试剂碱石灰的两个作用分别是①___________ ;②___________ 。
(6)实验结束后,需从三颈烧瓶中分离出高纯度 ,该分离操作的名称为___________(填字母)。
,该分离操作的名称为___________(填字母)。
(7)取2.50g制得的粗产品,完全溶于水,向所得的溶液中加入足量的 溶液,得生成沉淀的质量为3.495g,则所得产物中二氯化砜(
溶液,得生成沉淀的质量为3.495g,则所得产物中二氯化砜( )的质量分数为
)的质量分数为___________ 。
 )在制药行业中用途广泛。
)在制药行业中用途广泛。 的沸点为77℃,遇水剧烈反应生成
的沸点为77℃,遇水剧烈反应生成 。实验室制活性炭
。实验室制活性炭 的原理为:
的原理为: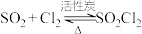 ,部分装置如图所示。回答以下问题:
,部分装置如图所示。回答以下问题:
(1)仪器a的名称为
(2)通过控制滴液漏斗旋塞可以释放集气瓶内气体,滴液漏斗中盛放的液态物质b为
(3)有同学认为如果将制备
 的装置放入冰水中,会更有利于二氯化砜的生成,其原因是:
的装置放入冰水中,会更有利于二氯化砜的生成,其原因是:(4)该实验过程中对反应体系加热的目的是
(5)试剂碱石灰的两个作用分别是①
(6)实验结束后,需从三颈烧瓶中分离出高纯度
 ,该分离操作的名称为___________(填字母)。
,该分离操作的名称为___________(填字母)。| A.蒸馏 | B.蒸发 | C.萃取 | D.重结晶 |
 溶液,得生成沉淀的质量为3.495g,则所得产物中二氯化砜(
溶液,得生成沉淀的质量为3.495g,则所得产物中二氯化砜( )的质量分数为
)的质量分数为
您最近一年使用:0次
2023-10-11更新
|
130次组卷
|
4卷引用:上海市格致中学2023-2024学年高二上学期第一次测试化学(等级考)试题
6 . 叠氮化钠(NaN3)是一种重要的化工产品,可用于合成抗生素头孢菌素药物和用作汽车安全气囊的气源。实验室可通过以下流程制备叠氮化钠并测定其纯度。
Ⅰ.制备氨基钠(反应原理为:2Na+2NH3 2NaNH2+H2)实验装置如图。
2NaNH2+H2)实验装置如图。

已知:氨基钠极易与水剧烈反应生成氨气,且其易被空气氧化。
(1)仪器a的名称为___________ ,实验开始时,应先打开分液漏斗使浓氨水流下,目的是_________ 。
(2)B装置中的药品可选用___________。
(3)若无B装置,C中生成的氨基钠会发生的反应为___________ (用化学方程式表示)。
(4)某同学认为上述实验设计有缺陷,请指出问题,并对装置提出改正措施___________ 。
Ⅱ.制备NaN3
(5)将Ⅰ中制备的NaNH2与N2O在210-220℃的条件下反应生成NaN3、NaOH和氨气,反应容器不选用玻璃材质(SiO2),请用化学方程式说明不选用玻璃材质的原因___________ 。
Ⅲ.测定NaN3的纯度水
精确称量0.1500g NaN3样品,设计如图乙所示装置,连接好装置后使锥形瓶倾斜,使小试管中的NaN3样品与M溶液接触,测量产生的气体体积从而测定其纯度(不考虑溶剂的挥发),已知:2NaN3~3N2(其他产物略),反应中放出大量的热。
(6)反应后对水量气管读数时,应注意
①___________
②调节量气管和水准瓶中的液面相平
③视线平视凹液面
(7)常温下测得产生气体的体积为54.00mL(N2的密度为1.400g/L),计算NaN3样品的纯度为(质量分数)___________ 。
(8)假定其他操作均正确,分析下列因素对实验结果的影响。
①读取初始体积时,量气管中的液面低于水准瓶中的液面___________ (填“偏大”、“偏小”或“无影响”,下同);
②实验前未将装置内的空气排出___________ ;
③读取最终体积时仰视___________ 。
Ⅰ.制备氨基钠(反应原理为:2Na+2NH3
 2NaNH2+H2)实验装置如图。
2NaNH2+H2)实验装置如图。
已知:氨基钠极易与水剧烈反应生成氨气,且其易被空气氧化。
(1)仪器a的名称为
(2)B装置中的药品可选用___________。
| A.P2O5 | B.碱石灰 | C.无水硫酸铜 | D.无水氯化钙 |
(3)若无B装置,C中生成的氨基钠会发生的反应为
(4)某同学认为上述实验设计有缺陷,请指出问题,并对装置提出改正措施
Ⅱ.制备NaN3
(5)将Ⅰ中制备的NaNH2与N2O在210-220℃的条件下反应生成NaN3、NaOH和氨气,反应容器不选用玻璃材质(SiO2),请用化学方程式说明不选用玻璃材质的原因

Ⅲ.测定NaN3的纯度水
精确称量0.1500g NaN3样品,设计如图乙所示装置,连接好装置后使锥形瓶倾斜,使小试管中的NaN3样品与M溶液接触,测量产生的气体体积从而测定其纯度(不考虑溶剂的挥发),已知:2NaN3~3N2(其他产物略),反应中放出大量的热。
(6)反应后对水量气管读数时,应注意
①
②调节量气管和水准瓶中的液面相平
③视线平视凹液面
(7)常温下测得产生气体的体积为54.00mL(N2的密度为1.400g/L),计算NaN3样品的纯度为(质量分数)
(8)假定其他操作均正确,分析下列因素对实验结果的影响。
①读取初始体积时,量气管中的液面低于水准瓶中的液面
②实验前未将装置内的空气排出
③读取最终体积时仰视
您最近一年使用:0次
名校
7 . 亚氯酸钠(NaClO2)是一种重要的消毒剂和漂白剂。某化学兴趣小组欲利用图示装置制取亚氯酸钠,并进行纯度的测定。

已知:①2NaClO3+Na2SO3+H2SO4→2ClO2↑+2Na2SO4+H2O
②饱和NaClO2溶液析出晶体与温度的关系如表所示。
③纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
实验一、制备NaClO2晶体
(1)装置A、B中都有的仪器是____ 。
(2)装置A中通入空气的作用是____ 。
(3)从装置B反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55C蒸发结晶;②____ ;③____ ;④低于60℃干燥,得到成品。(选择合适的操作编号填空)
a.冷却到室温后,过滤 b.趁热过滤 c.常温洗涤 d.38~60℃的温水洗涤
(4)装置B反应后的溶液中含有SO ,原因是
,原因是____ 。
实验二、测定产品纯度
准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液。移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol•L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗Na2S2O3标准溶液的平均值为VmL。
(已知:ClO +4I-+4H+→2H2O+2I2+Cl-、I2+2S2O
+4I-+4H+→2H2O+2I2+Cl-、I2+2S2O →2I-+S4O
→2I-+S4O )
)
(5)达到滴定终点时的现象为____ 。
(6)该样品中NaClO2的质量分数为____ (用含m、c、V的代数式表示)。
(7)若滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失,则测得结果____ (填“偏高”“偏低”或“无影响”)。

已知:①2NaClO3+Na2SO3+H2SO4→2ClO2↑+2Na2SO4+H2O
②饱和NaClO2溶液析出晶体与温度的关系如表所示。
| 温度/℃ | <38 | 38~60 | >60 |
| 晶体成分 | NaClO2•3H2O | NaClO2 | NaClO2分解生成NaClO3和NaCl |
实验一、制备NaClO2晶体
(1)装置A、B中都有的仪器是
(2)装置A中通入空气的作用是
(3)从装置B反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55C蒸发结晶;②
a.冷却到室温后,过滤 b.趁热过滤 c.常温洗涤 d.38~60℃的温水洗涤
(4)装置B反应后的溶液中含有SO
 ,原因是
,原因是实验二、测定产品纯度
准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液。移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol•L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗Na2S2O3标准溶液的平均值为VmL。
(已知:ClO
 +4I-+4H+→2H2O+2I2+Cl-、I2+2S2O
+4I-+4H+→2H2O+2I2+Cl-、I2+2S2O →2I-+S4O
→2I-+S4O )
)(5)达到滴定终点时的现象为
(6)该样品中NaClO2的质量分数为
(7)若滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失,则测得结果
您最近一年使用:0次
名校
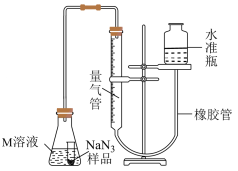
8 . 亚硝酰氯(NOCl)是一种黄色气体,熔点为-64.5℃,沸点为-5.5℃,常用于合成洗涤剂、触媒及用作中间体,可由NO(NO与浓硫酸不反应)与Cl2 在通常条件下反应得到。某实验小组设计实验制备NOCl并测定产品中NOCl的含量。
步骤1.制备NOCl——按如图所示装置进行实验(夹持装置略)。
(1)仪器连接的顺序为A→___________ →___________ →B,E→___________ →B(填装置字母代号,可重复使用); 装置C中所盛试剂的名称是___________ 。
(2)写出E中发生反应的离子方程式为___________ 。
步骤2.NOCl含量的测定(假设杂质不参与反应)
①取5.000g三颈烧瓶中所得产物溶于适量氢氧化钠溶液中,然后加入一定量稀硫酸和KI溶液,并通入足量N2,将NO全部赶出,最后将溶液稀释至500.00 mL;
②取25.00 mL 上述所得溶液,用淀粉作指示剂,用0.15mol·L-1 Na2S2O3标准溶液滴定至终点,最终消耗标准溶液的体积为20.00mL。
已知:①NOCl+H2O=NO +2H++Cl-
+2H++Cl-
②______NO +______H++_______I-=_______NO↑+_______+_______I2
+______H++_______I-=_______NO↑+_______+_______I2
③I2+2S2O =S4O
=S4O +2I-
+2I-
(3)配平反应②并标出电子转移的方向和数目___________ 。
______NO +______H++_______I-=_______NO↑+_______+_______I2
+______H++_______I-=_______NO↑+_______+_______I2
结合相关数据,计算实验测得产品中NOCl 的含量为___________ (保留三位有效数字)。
(4)下列操作将导致 NOCl 测量含量偏低的是___________。
步骤1.制备NOCl——按如图所示装置进行实验(夹持装置略)。

(1)仪器连接的顺序为A→
(2)写出E中发生反应的离子方程式为
步骤2.NOCl含量的测定(假设杂质不参与反应)
①取5.000g三颈烧瓶中所得产物溶于适量氢氧化钠溶液中,然后加入一定量稀硫酸和KI溶液,并通入足量N2,将NO全部赶出,最后将溶液稀释至500.00 mL;
②取25.00 mL 上述所得溶液,用淀粉作指示剂,用0.15mol·L-1 Na2S2O3标准溶液滴定至终点,最终消耗标准溶液的体积为20.00mL。
已知:①NOCl+H2O=NO
 +2H++Cl-
+2H++Cl-②______NO
 +______H++_______I-=_______NO↑+_______+_______I2
+______H++_______I-=_______NO↑+_______+_______I2③I2+2S2O
 =S4O
=S4O +2I-
+2I-(3)配平反应②并标出电子转移的方向和数目
______NO
 +______H++_______I-=_______NO↑+_______+_______I2
+______H++_______I-=_______NO↑+_______+_______I2结合相关数据,计算实验测得产品中NOCl 的含量为
(4)下列操作将导致 NOCl 测量含量偏低的是___________。
| A.滴定过程中剧烈振荡导致 I2 挥发 |
| B.滴定前滴定管有气泡,滴定后气泡消失 |
| C.锥形瓶内溶液蓝色消失后立即读数 |
| D.滴定管用蒸馏水润洗后,直接加入Na2S2O3标准溶液进行滴定 |
您最近一年使用:0次
名校
9 . 过氧化尿素[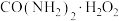 ]是一种新型氧化剂,可用于牙膏美白添加剂。
]是一种新型氧化剂,可用于牙膏美白添加剂。
合成原理: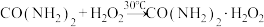
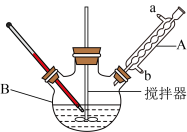
实验装置:(省略加热装置)
实验过程:在三口烧瓶中加入一定比例的工业尿素、双氧水和少量柠檬酸,搅拌,固体溶解后,升温至30℃,反应40 min,然后降温至0℃,结晶3 h后,抽滤,洗涤,将滤饼置于烘箱中,50℃下烘干2 h,得到最终的过氧化尿素产品。
已知:①尿素和过氧化尿素都是白色固体,易溶于水。过氧化尿素水溶液中离解为尿素和H2O2,45℃以上能分解。
②工业尿素中少量的铁离子、铜离子,会促进过氧化尿素分解。
(1)仪器B的名称是___________ 。该实验采取水浴加热方式的优点为___________ 。球形冷凝管从___________ (填“a”或“b”)口进水。
(2)结合题中信息,分析加入少量柠檬酸的作用是___________ 。
(3)从抽滤后的母液中分离出H2O2和尿素,可采用的操作是___________。
(4)过氧化尿素的纯度与干燥温度的关系如图所示:

干燥温度高于50℃后过氧化尿素的纯度下降的原因是___________ 。
(5)为测定产品中活性氧的含量,称取干燥样品4.000 g,溶解,在250 mL容量瓶中定容,准确量取25 mL于锥形瓶中,加入2 mL 硫酸,然后用
硫酸,然后用 的KMnO4标准溶液滴定,滴定终点时,消耗KMnO4溶液16.00 mL(已知KMnO4溶液与尿素不反应)。
的KMnO4标准溶液滴定,滴定终点时,消耗KMnO4溶液16.00 mL(已知KMnO4溶液与尿素不反应)。
①写出用KMnO4标准溶液滴定时反应的离子方程式:___________ 。
②溶解、定容过程中,不需用到的玻璃仪器为___________ 。
A.烧杯 B.玻璃棒 C.250 mL容量瓶 D.圆底烧瓶
③活性氧含量的计算公式为 ,根据滴定结果,计算该样品中活性氧的含量为
,根据滴定结果,计算该样品中活性氧的含量为___________ (写出计算过程,结果用百分数表示。)
④若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量___________ 。
A.偏高 B.偏低 C.不变
 ]是一种新型氧化剂,可用于牙膏美白添加剂。
]是一种新型氧化剂,可用于牙膏美白添加剂。合成原理:
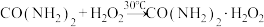
实验装置:(省略加热装置)

实验过程:在三口烧瓶中加入一定比例的工业尿素、双氧水和少量柠檬酸,搅拌,固体溶解后,升温至30℃,反应40 min,然后降温至0℃,结晶3 h后,抽滤,洗涤,将滤饼置于烘箱中,50℃下烘干2 h,得到最终的过氧化尿素产品。
已知:①尿素和过氧化尿素都是白色固体,易溶于水。过氧化尿素水溶液中离解为尿素和H2O2,45℃以上能分解。
②工业尿素中少量的铁离子、铜离子,会促进过氧化尿素分解。
(1)仪器B的名称是
(2)结合题中信息,分析加入少量柠檬酸的作用是
(3)从抽滤后的母液中分离出H2O2和尿素,可采用的操作是___________。
| A.盐析、过滤 | B.减压蒸馏、结晶 |
| C.分液、过滤 | D.减压蒸馏、萃取 |
(4)过氧化尿素的纯度与干燥温度的关系如图所示:

干燥温度高于50℃后过氧化尿素的纯度下降的原因是
(5)为测定产品中活性氧的含量,称取干燥样品4.000 g,溶解,在250 mL容量瓶中定容,准确量取25 mL于锥形瓶中,加入2 mL
 硫酸,然后用
硫酸,然后用 的KMnO4标准溶液滴定,滴定终点时,消耗KMnO4溶液16.00 mL(已知KMnO4溶液与尿素不反应)。
的KMnO4标准溶液滴定,滴定终点时,消耗KMnO4溶液16.00 mL(已知KMnO4溶液与尿素不反应)。①写出用KMnO4标准溶液滴定时反应的离子方程式:
②溶解、定容过程中,不需用到的玻璃仪器为
A.烧杯 B.玻璃棒 C.250 mL容量瓶 D.圆底烧瓶
③活性氧含量的计算公式为
 ,根据滴定结果,计算该样品中活性氧的含量为
,根据滴定结果,计算该样品中活性氧的含量为④若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量
A.偏高 B.偏低 C.不变
您最近一年使用:0次
名校
解题方法
10 . 硫酸是重要的化工原料,它的年产量可以用来衡量一个国家的化工生产水平,以黄铁矿为原料进行接触法制硫酸的流程如下:

(1)黄铁矿在_____________ (填设备名称)中与氧气反应的方程式_________________ ,每生成2molSO2转移_______ mol电子。
(2)在转化阶段,下列条件能使平衡向生成SO3的方向移动的是________。
(3)在吸收阶段,下列说法不正确的是________。
(4)我国二氧化硫排放标准限值为100mg/m3。硫酸工业废气(假设含硫化合物均为SO2)可采用雾化的氨水与废气中的SO2直接接触吸收SO2,若烟气SO2含量为a mg/m3(a>100),试计算每立方米烟气至少需要浓度为b mol/L氨水________ L(用含a、b的代数式表示)。
(5)硫酸工业生产中SO3吸收率与进入吸收塔的硫酸浓度和温度关系如图,由图可知吸收SO3所用硫酸的适宜浓度为98.3%,适宜温度为___________ ,而工业生产中一般采用60℃的可能原因是___________ 。


(1)黄铁矿在
(2)在转化阶段,下列条件能使平衡向生成SO3的方向移动的是________。
| A.不采用常温而加热至400℃-500℃ |
| B.使用V2O5作为催化剂 |
| C.向容器中通入过量空气 |
| D.进入接触室前的混合气体需要先净化 |
| A.用98.3%H2SO4吸收可以避免酸雾生成 |
| B.尾气不能直接排放到大气中 |
| C.吸收过程采取逆流的形式,提高吸收效率 |
| D.产品为发烟硫酸,会不断挥发出白烟 |
(5)硫酸工业生产中SO3吸收率与进入吸收塔的硫酸浓度和温度关系如图,由图可知吸收SO3所用硫酸的适宜浓度为98.3%,适宜温度为

您最近一年使用:0次



