名校
1 . 硼氢化钠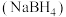 是一种潜在储氢剂,在有机合成中也被称为“万能还原剂”。实验室制备、提纯、分析
是一种潜在储氢剂,在有机合成中也被称为“万能还原剂”。实验室制备、提纯、分析 纯度的步骤如下,请结合信息回答问题。
纯度的步骤如下,请结合信息回答问题。
Ⅰ. 的制备
的制备
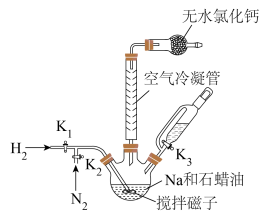
先打开 ,向装置中鼔入
,向装置中鼔入 ,然后升温到
,然后升温到 左右,打开搅拌器快速搅拌,将融化的
左右,打开搅拌器快速搅拌,将融化的 快速分散到石蜡油中,然后升温到
快速分散到石蜡油中,然后升温到 ,关闭
,关闭 ,打开
,打开 通入
通入 ,充分反应后制得
,充分反应后制得 。然后升温到
。然后升温到 ,持续搅拌下通入
,持续搅拌下通入 ,打开
,打开 向三颈瓶中滴入硼酸三甲酯[分子式为
向三颈瓶中滴入硼酸三甲酯[分子式为 ,沸点为
,沸点为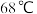 ],充分反应后,降温后离心分离得到
],充分反应后,降温后离心分离得到 和
和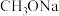 的固体混合物。
的固体混合物。
(1)写出 与
与 的化学反应方程式
的化学反应方程式_________ 。
(2)下列说法正确的是_________。
Ⅱ. 的提纯
的提纯
(3) 可采用索氏提取法提纯,其装置如图所示。实验时将
可采用索氏提取法提纯,其装置如图所示。实验时将 和
和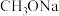 的固体混合物放入滤纸套筒1中,烧瓶中异丙胺(熔点:
的固体混合物放入滤纸套筒1中,烧瓶中异丙胺(熔点: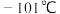 ,沸点:
,沸点: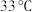 )受热蒸发,蒸汽沿导管
)受热蒸发,蒸汽沿导管_________ (填“2”或“3”)上升至球形冷凝管,冷凝后滴入滤纸套筒1中,再经导管_________ (填“2”或“3”)返回烧瓶,从而实现连续萃取。当萃取完全后, 在
在_________ (填“圆底烧瓶”或“索氏提取器”)中。

(4)分离异丙胺和 并回收溶剂的方法是
并回收溶剂的方法是_________ 。
Ⅲ. 的纯度分析
的纯度分析
步骤1:取 产品(杂质不参与反应),将产品溶于
产品(杂质不参与反应),将产品溶于 溶液后配成
溶液后配成 溶液,取
溶液,取 置于碘量瓶中,加入
置于碘量瓶中,加入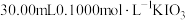 溶液充分反应。(反应为
溶液充分反应。(反应为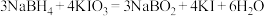 )
)
步骤2:向步骤1所得溶液中加入过量的 溶液,用溶液
溶液,用溶液 调节
调节 ,使过量
,使过量 转化为
转化为 ,冷却后暗处放置数分钟。
,冷却后暗处放置数分钟。
步骤3:向步骤2所得溶液中加缓冲溶液 调
调 约为5.0,加入几滴淀粉指示剂,用
约为5.0,加入几滴淀粉指示剂,用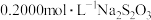 标准溶液滴定至终点,消耗标准溶液的体积为
标准溶液滴定至终点,消耗标准溶液的体积为 。(反应为
。(反应为 )
)
(5) 溶液为
溶液为_________ , 溶液为
溶液为_________ ,缓冲溶液 为_
为__________ 。(填序号)【已知: ,
,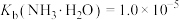 ,两种混合液中溶质物质的量之比均为
,两种混合液中溶质物质的量之比均为 。】
。】
A.稀硫酸 B. 溶液
溶液
C. 和
和 混合液 D.
混合液 D. 和
和 混合液
混合液
(6)产品中 的纯度为
的纯度为_________  。滴入
。滴入 标准溶液时若长时间振荡可能导致测定结果
标准溶液时若长时间振荡可能导致测定结果_________ (填“偏高”或“偏低”)。
 是一种潜在储氢剂,在有机合成中也被称为“万能还原剂”。实验室制备、提纯、分析
是一种潜在储氢剂,在有机合成中也被称为“万能还原剂”。实验室制备、提纯、分析 纯度的步骤如下,请结合信息回答问题。
纯度的步骤如下,请结合信息回答问题。
|
|
| |
性质 | 固体,可溶于异丙胺或水,常温下与水缓慢反应,与酸剧烈反应,强碱环境下能稳定存在 | 固体,强还原性,与水剧烈反应产生 | 固体,难溶于异丙胺,常温下与水剧烈反应 |
 的制备
的制备先打开
 ,向装置中鼔入
,向装置中鼔入 ,然后升温到
,然后升温到 左右,打开搅拌器快速搅拌,将融化的
左右,打开搅拌器快速搅拌,将融化的 快速分散到石蜡油中,然后升温到
快速分散到石蜡油中,然后升温到 ,关闭
,关闭 ,打开
,打开 通入
通入 ,充分反应后制得
,充分反应后制得 。然后升温到
。然后升温到 ,持续搅拌下通入
,持续搅拌下通入 ,打开
,打开 向三颈瓶中滴入硼酸三甲酯[分子式为
向三颈瓶中滴入硼酸三甲酯[分子式为 ,沸点为
,沸点为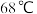 ],充分反应后,降温后离心分离得到
],充分反应后,降温后离心分离得到 和
和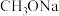 的固体混合物。
的固体混合物。
(1)写出
 与
与 的化学反应方程式
的化学反应方程式(2)下列说法正确的是_________。
A.鼓入 可以防止 可以防止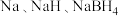 等被氧化 等被氧化 |
B.搅拌并将 分散到石蜡油中可以加快 分散到石蜡油中可以加快 与钠的反应速率 与钠的反应速率 |
C.取 时的产物加入水中,观察是否有 时的产物加入水中,观察是否有 产生,从而判断 产生,从而判断 中是否含有 中是否含有 |
D.快速滴入 有利于提高其转化率 有利于提高其转化率 |
Ⅱ.
 的提纯
的提纯(3)
 可采用索氏提取法提纯,其装置如图所示。实验时将
可采用索氏提取法提纯,其装置如图所示。实验时将 和
和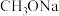 的固体混合物放入滤纸套筒1中,烧瓶中异丙胺(熔点:
的固体混合物放入滤纸套筒1中,烧瓶中异丙胺(熔点: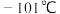 ,沸点:
,沸点: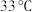 )受热蒸发,蒸汽沿导管
)受热蒸发,蒸汽沿导管 在
在
(4)分离异丙胺和
 并回收溶剂的方法是
并回收溶剂的方法是Ⅲ.
 的纯度分析
的纯度分析步骤1:取
 产品(杂质不参与反应),将产品溶于
产品(杂质不参与反应),将产品溶于 溶液后配成
溶液后配成 溶液,取
溶液,取 置于碘量瓶中,加入
置于碘量瓶中,加入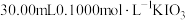 溶液充分反应。(反应为
溶液充分反应。(反应为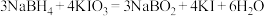 )
)步骤2:向步骤1所得溶液中加入过量的
 溶液,用溶液
溶液,用溶液 调节
调节 ,使过量
,使过量 转化为
转化为 ,冷却后暗处放置数分钟。
,冷却后暗处放置数分钟。步骤3:向步骤2所得溶液中加缓冲溶液
 调
调 约为5.0,加入几滴淀粉指示剂,用
约为5.0,加入几滴淀粉指示剂,用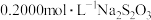 标准溶液滴定至终点,消耗标准溶液的体积为
标准溶液滴定至终点,消耗标准溶液的体积为 。(反应为
。(反应为 )
)(5)
 溶液为
溶液为 溶液为
溶液为 为_
为_ ,
,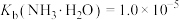 ,两种混合液中溶质物质的量之比均为
,两种混合液中溶质物质的量之比均为 。】
。】A.稀硫酸 B.
 溶液
溶液C.
 和
和 混合液 D.
混合液 D. 和
和 混合液
混合液(6)产品中
 的纯度为
的纯度为 。滴入
。滴入 标准溶液时若长时间振荡可能导致测定结果
标准溶液时若长时间振荡可能导致测定结果
您最近一年使用:0次
名校
2 . 叠氮化钠( )在有机合成和汽车行业都有重要应用。某竞赛小组对叠氮化钠的制备和产品纯度测定进行相关探究。
)在有机合成和汽车行业都有重要应用。某竞赛小组对叠氮化钠的制备和产品纯度测定进行相关探究。
查阅资料:
I.氨基钠( )熔点为208℃,易潮解和氧化;
)熔点为208℃,易潮解和氧化; 有强氧化性,不与酸、碱反应;叠氮酸(
有强氧化性,不与酸、碱反应;叠氮酸( )不稳定,易爆炸分解。
)不稳定,易爆炸分解。
II. ,
,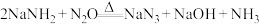 。
。
回答下列问题:
(1)制备 (如图)
(如图)

①按气流方向,上述装置合理的连接顺序为a→___________ →h(填仪器接口字母)。
②实验时,E中生成 沉淀,反应的化学方程式为
沉淀,反应的化学方程式为___________ 。
③C处充分反应后,停止加热,需继续通入 ,其目的是
,其目的是___________ 。
(2)用滴定法测定叠氮化钠样品中 的纯度:
的纯度:
a.将2.500g试样配成500.00mL溶液。
b.取50.00mL溶液置于锥形瓶中,加入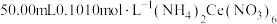 溶液。此过程发生的反应为
溶液。此过程发生的反应为 。
。
c.充分反应后,将溶液稍稀释、酸化、滴入3滴邻菲啰啉指示液,用 标准溶液滴定过量的
标准溶液滴定过量的 ,消耗溶液体积为29.00mL。
,消耗溶液体积为29.00mL。
①滴定时,将标准溶液盛装在___________ 滴定管。发生反应的离子方程式为___________ 。
②试样中 的纯度为
的纯度为___________ %。
③用精密仪器测定发现,其纯度比上述滴定法测定结果更高,原因可能是___________ 。
i. 被空气中的氧气氧化
被空气中的氧气氧化
ii.滴定前未用标准溶液润洗滴定管
iii.配制500mL溶液定容时,俯视刻度线
 )在有机合成和汽车行业都有重要应用。某竞赛小组对叠氮化钠的制备和产品纯度测定进行相关探究。
)在有机合成和汽车行业都有重要应用。某竞赛小组对叠氮化钠的制备和产品纯度测定进行相关探究。查阅资料:
I.氨基钠(
 )熔点为208℃,易潮解和氧化;
)熔点为208℃,易潮解和氧化; 有强氧化性,不与酸、碱反应;叠氮酸(
有强氧化性,不与酸、碱反应;叠氮酸( )不稳定,易爆炸分解。
)不稳定,易爆炸分解。II.
 ,
,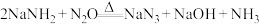 。
。回答下列问题:
(1)制备
 (如图)
(如图)
①按气流方向,上述装置合理的连接顺序为a→
②实验时,E中生成
 沉淀,反应的化学方程式为
沉淀,反应的化学方程式为③C处充分反应后,停止加热,需继续通入
 ,其目的是
,其目的是(2)用滴定法测定叠氮化钠样品中
 的纯度:
的纯度:a.将2.500g试样配成500.00mL溶液。
b.取50.00mL溶液置于锥形瓶中,加入
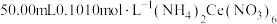 溶液。此过程发生的反应为
溶液。此过程发生的反应为 。
。c.充分反应后,将溶液稍稀释、酸化、滴入3滴邻菲啰啉指示液,用
 标准溶液滴定过量的
标准溶液滴定过量的 ,消耗溶液体积为29.00mL。
,消耗溶液体积为29.00mL。①滴定时,将标准溶液盛装在
②试样中
 的纯度为
的纯度为③用精密仪器测定发现,其纯度比上述滴定法测定结果更高,原因可能是
i.
 被空气中的氧气氧化
被空气中的氧气氧化ii.滴定前未用标准溶液润洗滴定管
iii.配制500mL溶液定容时,俯视刻度线
您最近一年使用:0次
名校
解题方法
3 . 氯化亚铜是非常重要的化工原料,广泛用于化学反应的催化剂。
已知:①氯化亚铜难溶于水,不溶于乙醇;
②氯化亚铜露置于空气中易被氧化。
请回答下列问题。
I.可用纯净的氯化铜制备氯化亚铜,流程如图所示:
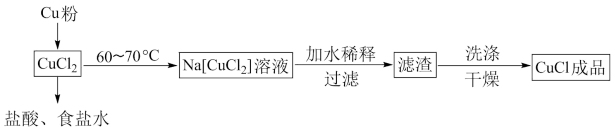
(1)“加水稀释”步骤中,配合物 转化为
转化为 ,写出该过程的离子方程式
,写出该过程的离子方程式_____ 。
(2)滤渣用乙醇洗涤后,在真空中干燥。选择在真空中干燥的原因是______ 。若在空气中用水洗涤,可转变为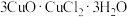 ,写出该过程的化学方程式
,写出该过程的化学方程式___________ 。
(3)已知溶液中可以发生反应: ,但实验室不宜用该方法直接制备氯化亚铜,可能原因是
,但实验室不宜用该方法直接制备氯化亚铜,可能原因是___________ 。
II.利用氧化还原滴定可测定产品中 的含量,实验分两步进行:
的含量,实验分两步进行:
步骤I:将上述流程得到的 产品取
产品取 于碘量瓶中,加入足量
于碘量瓶中,加入足量 溶液,摇匀至样品完全溶解。
溶液,摇匀至样品完全溶解。
步骤II:将溶解液稀释至 。用
。用 移液管移取
移液管移取 溶液于锥形瓶中,用
溶液于锥形瓶中,用 标准
标准 溶液滴定至终点。平行实验三次,平均消耗
溶液滴定至终点。平行实验三次,平均消耗 标准
标准 溶液。
溶液。
已知: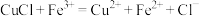 、
、
(4)计算产品中 的质量分数为
的质量分数为___________ 。滴定过程中,下列操作会使滴定结果偏小的是___________ (填字母序号)。
a.未用标准溶液润洗滴定管
b.锥形瓶在滴定过程中剧烈摇动,有少量液体溅出
c.滴定前滴定管尖嘴部分有气泡,滴定后无气泡
Ⅲ.研究发现, 在青铜器的腐蚀过程中起催化作用。下图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
在青铜器的腐蚀过程中起催化作用。下图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图。

(5)腐蚀过程中,正极的电极反应式为___________ 。
(6)环境中的 扩散到孔口,并与正、负极反应产物作用生成多孔粉状锈
扩散到孔口,并与正、负极反应产物作用生成多孔粉状锈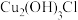 。理论上,消耗标准状况下的
。理论上,消耗标准状况下的
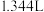 时,生成
时,生成___________ g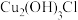 。
。
已知:①氯化亚铜难溶于水,不溶于乙醇;
②氯化亚铜露置于空气中易被氧化。
请回答下列问题。
I.可用纯净的氯化铜制备氯化亚铜,流程如图所示:

(1)“加水稀释”步骤中,配合物
 转化为
转化为 ,写出该过程的离子方程式
,写出该过程的离子方程式(2)滤渣用乙醇洗涤后,在真空中干燥。选择在真空中干燥的原因是
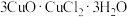 ,写出该过程的化学方程式
,写出该过程的化学方程式(3)已知溶液中可以发生反应:
 ,但实验室不宜用该方法直接制备氯化亚铜,可能原因是
,但实验室不宜用该方法直接制备氯化亚铜,可能原因是II.利用氧化还原滴定可测定产品中
 的含量,实验分两步进行:
的含量,实验分两步进行:步骤I:将上述流程得到的
 产品取
产品取 于碘量瓶中,加入足量
于碘量瓶中,加入足量 溶液,摇匀至样品完全溶解。
溶液,摇匀至样品完全溶解。步骤II:将溶解液稀释至
 。用
。用 移液管移取
移液管移取 溶液于锥形瓶中,用
溶液于锥形瓶中,用 标准
标准 溶液滴定至终点。平行实验三次,平均消耗
溶液滴定至终点。平行实验三次,平均消耗 标准
标准 溶液。
溶液。已知:
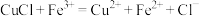 、
、
(4)计算产品中
 的质量分数为
的质量分数为a.未用标准溶液润洗滴定管
b.锥形瓶在滴定过程中剧烈摇动,有少量液体溅出
c.滴定前滴定管尖嘴部分有气泡,滴定后无气泡
Ⅲ.研究发现,
 在青铜器的腐蚀过程中起催化作用。下图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
在青铜器的腐蚀过程中起催化作用。下图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
(5)腐蚀过程中,正极的电极反应式为
(6)环境中的
 扩散到孔口,并与正、负极反应产物作用生成多孔粉状锈
扩散到孔口,并与正、负极反应产物作用生成多孔粉状锈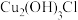 。理论上,消耗标准状况下的
。理论上,消耗标准状况下的
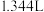 时,生成
时,生成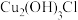 。
。
您最近一年使用:0次




