名校
1 . 焦亚硫酸钠(Na2S2O5)具有强还原性、漂白性,广泛用于食品、医药、印染等。工业上常以含硫废气为原料制得过饱和NaHSO3溶液,再将其结晶脱水制得Na2S2O5。实验室可用如图装置(略去部分夹持仪器)模拟该制备过程。 已知:常温下,
 5.6×10-11,Ka1 (H2SO3)=1.3×10-2、Ka2 (H2SO3)=6.2×10-8。回答下列问题:
5.6×10-11,Ka1 (H2SO3)=1.3×10-2、Ka2 (H2SO3)=6.2×10-8。回答下列问题:

(1)按图示组装仪器。
①A装置用于制备SO2,试剂X、Y的组合最好是_______________ (填字母)。
a.稀盐酸和 Na2SO3,固体 b.98%硫酸和铜
c.70%硫酸和K2SO3固体 d.稀硝酸和 NaHSO3固体
②D装置的作用是___________________
(2)检查装置的气密性后装入药品,先向C 中烧瓶滴加饱和Na2CO3溶液,再向 A 中烧瓶滴加 X,反应一段时间,待 C 中溶液的pH 为4.1 时,停止通SO2,写出SO2和饱和 Na2CO3溶液反应的化学方程式:__________________________________ 。
(3)将恒压分液漏斗更换为固体加料漏斗,先向三颈烧瓶中加入Na2CO3粉末至pH为7~8,再继续通入SO2至 pH=4.1,该步骤的目的是_________________________ 。将C 中溶液结晶脱水析出太量白色固体,经过滤、乙醇洗涤、真空干燥,得到产品 Na2S2O5。
(4)称取1.000g产品于碘量瓶中,加入50.00 mL 0.2000 mol·L-1过量标准碘溶液(杂质不参与反应),在暗处放置5分钟充分反应:______________________________ (填离子方程式)。再用 标准溶液滴定剩余碘,发生反应:
标准溶液滴定剩余碘,发生反应: , 加入淀粉指示剂,滴定至溶液蓝色刚好褪去。上述过程重复三次,消耗Na2S2O3溶液的体积分别是19.60 mL、20.22 mL、20.18 mL,产品中Na2S2O5的纯度为
, 加入淀粉指示剂,滴定至溶液蓝色刚好褪去。上述过程重复三次,消耗Na2S2O3溶液的体积分别是19.60 mL、20.22 mL、20.18 mL,产品中Na2S2O5的纯度为__________________________________ (结果保留四位有效数字)。
(5)产品中可能混有的杂质为_____________________________ ,为提高纯度,在不改变原有装置的基础上对(2)中的操作进行改进,改进后的操作是_________________________________ 。

 5.6×10-11,Ka1 (H2SO3)=1.3×10-2、Ka2 (H2SO3)=6.2×10-8。回答下列问题:
5.6×10-11,Ka1 (H2SO3)=1.3×10-2、Ka2 (H2SO3)=6.2×10-8。回答下列问题:
(1)按图示组装仪器。
①A装置用于制备SO2,试剂X、Y的组合最好是
a.稀盐酸和 Na2SO3,固体 b.98%硫酸和铜
c.70%硫酸和K2SO3固体 d.稀硝酸和 NaHSO3固体
②D装置的作用是
(2)检查装置的气密性后装入药品,先向C 中烧瓶滴加饱和Na2CO3溶液,再向 A 中烧瓶滴加 X,反应一段时间,待 C 中溶液的pH 为4.1 时,停止通SO2,写出SO2和饱和 Na2CO3溶液反应的化学方程式:
(3)将恒压分液漏斗更换为固体加料漏斗,先向三颈烧瓶中加入Na2CO3粉末至pH为7~8,再继续通入SO2至 pH=4.1,该步骤的目的是
(4)称取1.000g产品于碘量瓶中,加入50.00 mL 0.2000 mol·L-1过量标准碘溶液(杂质不参与反应),在暗处放置5分钟充分反应:
 标准溶液滴定剩余碘,发生反应:
标准溶液滴定剩余碘,发生反应: , 加入淀粉指示剂,滴定至溶液蓝色刚好褪去。上述过程重复三次,消耗Na2S2O3溶液的体积分别是19.60 mL、20.22 mL、20.18 mL,产品中Na2S2O5的纯度为
, 加入淀粉指示剂,滴定至溶液蓝色刚好褪去。上述过程重复三次,消耗Na2S2O3溶液的体积分别是19.60 mL、20.22 mL、20.18 mL,产品中Na2S2O5的纯度为(5)产品中可能混有的杂质为
您最近一年使用:0次
名校
解题方法
2 . 钴及其化合物在化工生产中有重要的用途。三氯化六氨合钴(Ⅲ)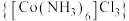 是黄色或橙黄色晶体,实验室以
是黄色或橙黄色晶体,实验室以 为原料经催化制备
为原料经催化制备 ,步骤如下:
,步骤如下:
Ⅰ. 的制备
的制备
 (易潮解)可以通过钴和氯气反应制得,实验室用下图实验装置制备纯净
(易潮解)可以通过钴和氯气反应制得,实验室用下图实验装置制备纯净 。
。
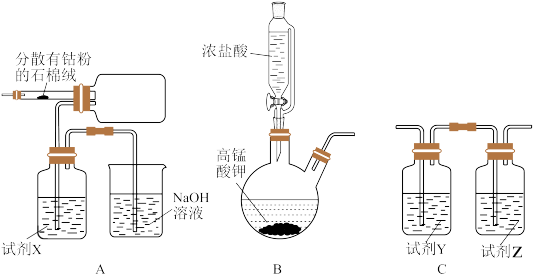
(1)装置的连接顺序为_______ (填字母),B装置用于制备氧气,其反应的化学方程式为_______ ,A装置中试剂X的名称为_______ 。
(2)组装好仪器进行实验时,要先加入浓盐酸,使B装置中开始生成氯气,待A装置内充满黄绿色气体,再加热A装置中的钴粉,目的是_______ 。
Ⅱ.三氯化六氨合钴(Ⅲ)的制备。其原理为: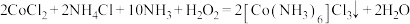 。
。

已知:三氯化六氨合钴不溶于乙醇,常温水中溶解度较小。
(3)水浴温度不超过 的原因是
的原因是_______ 。
(4)下列说法不正确的是_______(填标号)。
Ⅲ.晶体结构测定与钴含量分析。
(5)测定晶体结构最常见的仪器是_______ ,从而获取晶胞形状和大小、分子或原子在微观空间的有序排列。已知 具有正八面体的空间结构,
具有正八面体的空间结构, 中的2个
中的2个 被2个
被2个 取代,能得到
取代,能得到_______ 种产物。
(6)利用 将
将 氧化成
氧化成 ,
, 被还原后的产物为
被还原后的产物为 。然后用
。然后用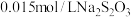 标准溶液滴定生成的
标准溶液滴定生成的 (已知:
(已知: )。若称取样品的质量为
)。若称取样品的质量为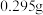 ,滴定
,滴定 时,达到终点消耗
时,达到终点消耗 标准溶液的平均体积为
标准溶液的平均体积为 。该样品中钴元素的质量分数为
。该样品中钴元素的质量分数为_______ %。
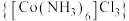 是黄色或橙黄色晶体,实验室以
是黄色或橙黄色晶体,实验室以 为原料经催化制备
为原料经催化制备 ,步骤如下:
,步骤如下:Ⅰ.
 的制备
的制备 (易潮解)可以通过钴和氯气反应制得,实验室用下图实验装置制备纯净
(易潮解)可以通过钴和氯气反应制得,实验室用下图实验装置制备纯净 。
。
(1)装置的连接顺序为
(2)组装好仪器进行实验时,要先加入浓盐酸,使B装置中开始生成氯气,待A装置内充满黄绿色气体,再加热A装置中的钴粉,目的是
Ⅱ.三氯化六氨合钴(Ⅲ)的制备。其原理为:
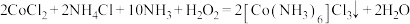 。
。
已知:三氯化六氨合钴不溶于乙醇,常温水中溶解度较小。
(3)水浴温度不超过
 的原因是
的原因是(4)下列说法不正确的是_______(填标号)。
A. 除作为反应物外,还有调节溶液的 除作为反应物外,还有调节溶液的 的作用 的作用 |
| B.活性炭是脱色剂,固体2是活性炭 |
C.加入浓盐酸,析出产品的反应方程式为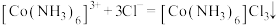 |
| D.可用乙醇水溶液洗涤产品 |
Ⅲ.晶体结构测定与钴含量分析。
(5)测定晶体结构最常见的仪器是
 具有正八面体的空间结构,
具有正八面体的空间结构, 中的2个
中的2个 被2个
被2个 取代,能得到
取代,能得到(6)利用
 将
将 氧化成
氧化成 ,
, 被还原后的产物为
被还原后的产物为 。然后用
。然后用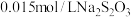 标准溶液滴定生成的
标准溶液滴定生成的 (已知:
(已知: )。若称取样品的质量为
)。若称取样品的质量为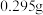 ,滴定
,滴定 时,达到终点消耗
时,达到终点消耗 标准溶液的平均体积为
标准溶液的平均体积为 。该样品中钴元素的质量分数为
。该样品中钴元素的质量分数为
您最近一年使用:0次
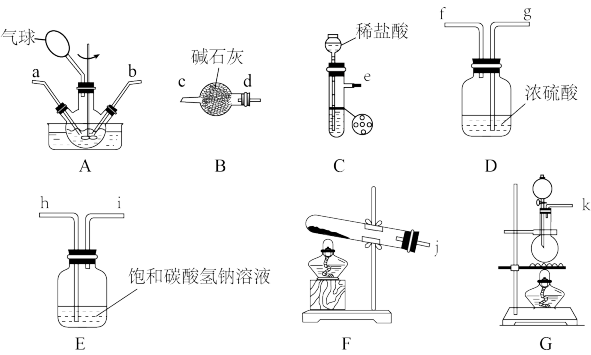
3 . 氨基甲酸铵(NH2COONH4)是一种受热易分解、易水解的白色固体,难溶于CCl4。实验室将干燥的二氧化碳和干燥的氨气通入CCl4中进行制备,化学方程式为:2NH3(g)+CO2(g)=NH2COONH4(s) △H<0。某同学从如图装置(不能重复使用)中选用一部分连接后进行实验。
回答下列问题:
(1)氨气的发生装置可以选择图中的___ (填序号,用大写字母表示),反应的化学方程式为___ 。
(2)装置C用来制备二氧化碳气体,块状石灰石放置在试管中的带孔塑料板上。制备时,不能用稀硫酸代替稀盐酸,其原因是___ 。
(3)选择上图中的部分装置制备NH2COONH4,其连接顺序为:氨气的发生装置→__ →ab←___ ←e(按气流方向,用小写字母表示)。
(4)反应时三颈瓶需用冷水浴冷却,其目的是___ 。
(5)从装置A的混合物中分离出产品的方法是___ (填操作名称)。
(6)氨基甲酸铵因吸潮会变质为碳酸氢铵,现取部分变质后的样品11.730g,用足量石灰水充分处理后,碳元素会完全转化为碳酸钙,再过滤、洗涤、干燥、称量,质量为15.000g。则样品中氨基甲酸铵的物质的量分数 为___ %。[已知:M(NH2COONH4)=78g/mol、M(NH4HCO3)=79g/mol、M(CaCO3)=100g/mol]

回答下列问题:
(1)氨气的发生装置可以选择图中的
(2)装置C用来制备二氧化碳气体,块状石灰石放置在试管中的带孔塑料板上。制备时,不能用稀硫酸代替稀盐酸,其原因是
(3)选择上图中的部分装置制备NH2COONH4,其连接顺序为:氨气的发生装置→
(4)反应时三颈瓶需用冷水浴冷却,其目的是
(5)从装置A的混合物中分离出产品的方法是
(6)氨基甲酸铵因吸潮会变质为碳酸氢铵,现取部分变质后的样品11.730g,用足量石灰水充分处理后,碳元素会完全转化为碳酸钙,再过滤、洗涤、干燥、称量,质量为15.000g。则样品中氨基甲酸铵的
您最近一年使用:0次
名校
解题方法
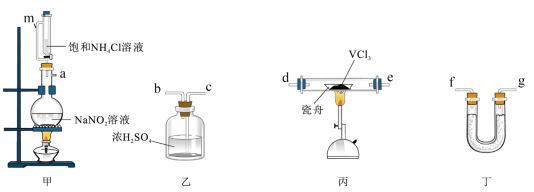
4 . 二氯化钒( )是重要的有机合成试剂,具有较强的吸湿性。某学习小组通过
)是重要的有机合成试剂,具有较强的吸湿性。某学习小组通过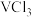 分解制备
分解制备 ,下列说法错误的是
,下列说法错误的是
 )是重要的有机合成试剂,具有较强的吸湿性。某学习小组通过
)是重要的有机合成试剂,具有较强的吸湿性。某学习小组通过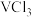 分解制备
分解制备 ,下列说法错误的是
,下列说法错误的是
| A.玻璃管m的作用为:平衡气压,使液体顺利流下 |
B.甲装置中每产生1mol  ,转移电子数目为3 ,转移电子数目为3 |
C.装置合理的连接顺序为: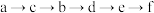 |
D.丁中的试剂可以为无水 |
您最近一年使用:0次
2021-09-06更新
|
522次组卷
|
4卷引用:重庆市第八中学校2022届高三上学期入学摸底测试化学试题
重庆市第八中学校2022届高三上学期入学摸底测试化学试题江苏省海安市南莫中学2022届高三上学期第一次月考备考金卷B卷化学试题(已下线)押新高考卷05题 化学实验基础-备战2022年高考化学临考题号押题(新高考通版)(已下线)专题25 化学实验综合性选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)



