解题方法
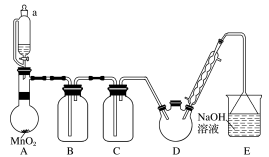
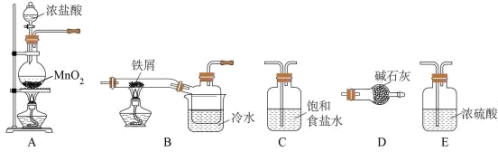
1 . 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O;CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质如表所示:
(1)仪器A中发生反应的化学方程式为:______ 。
(2)装置B中的试剂是______ ,若撤去装置B,可能导致装置D中副产物______ (填化学式)的量增加;装置D可采用______ 加热的方法控制反应温度在70℃左右。
(3)装置D中球形冷凝管的作用为______ 。写出E中所有可能发生的无机反应的离子方程式:______ 。
(4)测定产品纯度:称取产品0.40g配成待测溶液,加入0.1000mol·L-1碘标准溶液22.00mL,再加入适量Na2CO3溶液,待反应完全后,加盐酸调节溶液的pH,立即用0.02000mol·L-1Na2S2O3溶液滴定至终点。进行三次平行实验,测得消耗Na2S2O3溶液20.00mL。则产品的纯度为______ 。(计算结果保留三位有效数字)
滴定的反应原理:CCl3CHO+OH-=CHCl3+HCOO-;HCOO-+I2=H++2I-+CO2↑;I2+2S2O =2I-+S4O
=2I-+S4O 。
。
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O;CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质如表所示:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
(2)装置B中的试剂是
(3)装置D中球形冷凝管的作用为
(4)测定产品纯度:称取产品0.40g配成待测溶液,加入0.1000mol·L-1碘标准溶液22.00mL,再加入适量Na2CO3溶液,待反应完全后,加盐酸调节溶液的pH,立即用0.02000mol·L-1Na2S2O3溶液滴定至终点。进行三次平行实验,测得消耗Na2S2O3溶液20.00mL。则产品的纯度为
滴定的反应原理:CCl3CHO+OH-=CHCl3+HCOO-;HCOO-+I2=H++2I-+CO2↑;I2+2S2O
 =2I-+S4O
=2I-+S4O 。
。
您最近半年使用:0次
名校
解题方法
2 . 水合硼酸锌(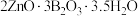 ,不溶于冷水)在阻燃方面具有诸多优点。以铁硼矿(主要成分为
,不溶于冷水)在阻燃方面具有诸多优点。以铁硼矿(主要成分为 ,以及少量
,以及少量 和
和 等)和菱锌矿(主要成分为
等)和菱锌矿(主要成分为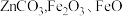 和
和 等)为原料制备水合硼酸锌的工艺流程如下:
等)为原料制备水合硼酸锌的工艺流程如下: 如下表所示:
如下表所示:
回答下列问题:
(1)“酸浸”时, 与硫酸反应的离子方程式为
与硫酸反应的离子方程式为__________ 。为加快“酸浸”时的浸取速率,下列措施中无法达到目的是__________ (填字母)。
a.将样品粉碎 b.延长浸取时间 c.充分搅拌 d.适当增加硫酸浓度 e.适当升高温度
(2)滤渣1的主要成分为__________ (填化学式)。
(3)“氧化”的目的是__________ (语言叙述), 也可以用
也可以用 代替,若“氧化”过程中转移电子数相等,则消耗
代替,若“氧化”过程中转移电子数相等,则消耗 和
和 的物质的量之比为
的物质的量之比为__________ 。
(4)“一次调 ”时,调节溶液的
”时,调节溶液的 ,目的是
,目的是__________ 。“二次调 ”时的
”时的 范围为
范围为__________ 。
(5)“制备”水合硼酸锌的化学方程式为__________ 。
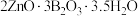 ,不溶于冷水)在阻燃方面具有诸多优点。以铁硼矿(主要成分为
,不溶于冷水)在阻燃方面具有诸多优点。以铁硼矿(主要成分为 ,以及少量
,以及少量 和
和 等)和菱锌矿(主要成分为
等)和菱锌矿(主要成分为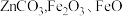 和
和 等)为原料制备水合硼酸锌的工艺流程如下:
等)为原料制备水合硼酸锌的工艺流程如下:
 如下表所示:
如下表所示:金属离子 |
|
|
|
|
|
开始沉淀 | 1.9 | 7.0 | 3.0 | 6.2 | 8.9 |
完全沉淀 | 3.2 | 9.0 | 4.7 | 8.0 | 10.9 |
(1)“酸浸”时,
 与硫酸反应的离子方程式为
与硫酸反应的离子方程式为a.将样品粉碎 b.延长浸取时间 c.充分搅拌 d.适当增加硫酸浓度 e.适当升高温度
(2)滤渣1的主要成分为
(3)“氧化”的目的是
 也可以用
也可以用 代替,若“氧化”过程中转移电子数相等,则消耗
代替,若“氧化”过程中转移电子数相等,则消耗 和
和 的物质的量之比为
的物质的量之比为(4)“一次调
 ”时,调节溶液的
”时,调节溶液的 ,目的是
,目的是 ”时的
”时的 范围为
范围为(5)“制备”水合硼酸锌的化学方程式为
您最近半年使用:0次
7日内更新
|
129次组卷
|
2卷引用:四川省绵阳中学2023-2024学年高三下学期2月开学考理科综合-高中化学
解题方法
3 . 纳米氧化镁广泛应用于电子元器件、催化剂载体等领域,一种利用 制备纳米氧化镁的工艺流程如图所示,下列说法错误的是
制备纳米氧化镁的工艺流程如图所示,下列说法错误的是 不参与化学反应.
不参与化学反应.
 制备纳米氧化镁的工艺流程如图所示,下列说法错误的是
制备纳米氧化镁的工艺流程如图所示,下列说法错误的是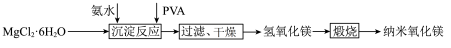
 不参与化学反应.
不参与化学反应.| A.纳米氧化镁分散在空气中能产生丁达尔效应 |
B.“煅烧”时,发生反应的化学方程式为 |
| C.“沉淀反应”时,有共价键的断裂 |
D.可以用坩埚蒸干氯化镁溶液的溶剂获得 |
您最近半年使用:0次
名校
解题方法
4 . FeCl3易与水反应、易升华,是化学反应中常用的催化剂。实验室用如图所示装置制备少量FeCl3。下列说法正确的是
已知:产率= ×100%
×100%

已知:产率=
 ×100%
×100%| A.按气流方向,上述装置合理的连接顺序为A→E→C→B→D |
| B.实验时,应该先点燃A处酒精灯,再点燃B处酒精灯 |
| C.冷水的作用是将FeCl3蒸气转变为固体,D装置可以用E装置代替 |
| D.若铁屑质量为11.2g,反应制得26.0g FeCl3,则该实验中FeCl3的产率为80% |
您最近半年使用:0次
5 . 工业上用Cu(NH3)4SO4和氨水的混合液浸取废铜矿渣中的单质铜,得到[Cu(NH3)2]2SO4。某小组同学欲通过实验探究其原理。
【查阅资料】
i.Cu(NH3)42+呈深蓝色,[Cu(NH3)4]2+ Cu2++4NH3;受热易分解,放出氨气。
Cu2++4NH3;受热易分解,放出氨气。
ii.Cu+在水溶液中不稳定,在溶液中只能以[Cu(NH3)2]+等络合离子的形式稳定存在;[Cu(NH3)2]+无色,易被氧气氧化为[Cu(NH3)4]2+。
【实验1】制备Cu(NH3)4SO4
向盛有2mL0.1mol•L-1CuSO4溶液的试管中滴加2mL1mol•L-1氨水,观察到溶液中立即出现浅蓝色沉淀;随后沉淀逐渐溶解,得到深蓝色溶液,经分离得到Cu(NH3)4SO4晶体。
(1)资料表明,向CuSO4溶液中滴加氨水,可能会生成浅蓝色Cu2(OH)2SO4沉淀。
①该小组同学取实验1中浅蓝色沉淀,洗涤后,_______ (补全实验操作和现象),证明沉淀中含有SO 。
。
②补全实验1中生成Cu2(OH)2SO4沉淀的离子方程式:2Cu2++_______ +SO =Cu2(OH)2SO4↓+
=Cu2(OH)2SO4↓+_______ 。
(2)甲同学设计实验证明深蓝色溶液中含Cu(NH3)4SO4;加热深蓝色溶液并检验逸出气体为氨气。你认为此方案_______ (填“可行”或“不可行”),理由是______ 。
【实验2】探究用Cu(NH3)4SO4和氨水的混合液浸取单质铜得到[Cu(NH3)2]2SO4的原理。
已知:其他条件相同时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,检测到的电压越大。
(3)溶液A为_______ 。
(4)对比实验2-1和2-2,可以得到的结论是_______ 。
(5)实验2~4中,甲烧杯中溶液由无色变为蓝色的原因是______ 。
(6)结合上述实验分析,用Cu(NH3)4SO4和氨水的混合液浸取单质铜的过程中,Cu(NH3)4SO4和氨水的作用分别是:______ 。
【查阅资料】
i.Cu(NH3)42+呈深蓝色,[Cu(NH3)4]2+
 Cu2++4NH3;受热易分解,放出氨气。
Cu2++4NH3;受热易分解,放出氨气。ii.Cu+在水溶液中不稳定,在溶液中只能以[Cu(NH3)2]+等络合离子的形式稳定存在;[Cu(NH3)2]+无色,易被氧气氧化为[Cu(NH3)4]2+。
【实验1】制备Cu(NH3)4SO4
向盛有2mL0.1mol•L-1CuSO4溶液的试管中滴加2mL1mol•L-1氨水,观察到溶液中立即出现浅蓝色沉淀;随后沉淀逐渐溶解,得到深蓝色溶液,经分离得到Cu(NH3)4SO4晶体。
(1)资料表明,向CuSO4溶液中滴加氨水,可能会生成浅蓝色Cu2(OH)2SO4沉淀。
①该小组同学取实验1中浅蓝色沉淀,洗涤后,
 。
。②补全实验1中生成Cu2(OH)2SO4沉淀的离子方程式:2Cu2++
 =Cu2(OH)2SO4↓+
=Cu2(OH)2SO4↓+(2)甲同学设计实验证明深蓝色溶液中含Cu(NH3)4SO4;加热深蓝色溶液并检验逸出气体为氨气。你认为此方案
【实验2】探究用Cu(NH3)4SO4和氨水的混合液浸取单质铜得到[Cu(NH3)2]2SO4的原理。
| 编号 | 实验装置及部分操作 | 烧杯中溶液 | 实验现象 |
| 2-1 | 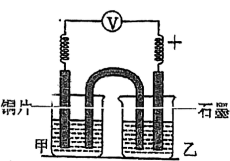 实验开始,先读取电压表示数,后迅速将其换成电流表,继续实验,10min内记录甲烧杯中的现象 | 甲:0.05mol•L-1Na2SO4 乙:0.05mol•L-1Cu(NH3)4SO4 | 电压表指针迅速偏转至0.1V;甲中溶液无明显变化 |
| 2-2 | 甲:0.05mol•L-1Na2SO4 乙:0.05mol•L-1CuSO4 | 电压表指针迅速偏转至0.3V;甲中溶液无明显变化 | |
| 2-3 | 甲:0.1mol•L-1Na2SO4与1mol•L-1氨水等体积混合 乙:溶液A | 电压表指针迅速偏转至0.35V;甲中溶液无明显变化 | |
| 2-4 | 甲:0.1mol•L-1Na2SO4与1mol•L-1氨水等体积混合 乙:0.05mol•L-1CuSO4 | 电压表指针迅速偏转至0.65V;几分钟后,甲烧杯中溶液逐渐由无色变蓝色 |
(3)溶液A为
(4)对比实验2-1和2-2,可以得到的结论是
(5)实验2~4中,甲烧杯中溶液由无色变为蓝色的原因是
(6)结合上述实验分析,用Cu(NH3)4SO4和氨水的混合液浸取单质铜的过程中,Cu(NH3)4SO4和氨水的作用分别是:
您最近半年使用:0次
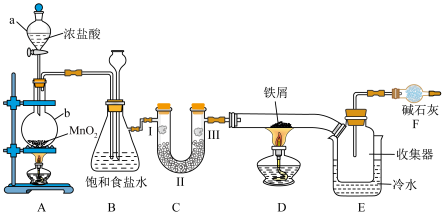
6 . 实验室用如图所示装置(夹持仪器略)验证 的漂白性并制备无水
的漂白性并制备无水 。查阅相关资料得知:无水
。查阅相关资料得知:无水 在空气中易与水反应,加热易升华。
在空气中易与水反应,加热易升华。
回答下列问题:
(1)仪器 的名称为
的名称为______ ,仪器b中发生反应的离子方程式为______ 。
(2)实验开始时,应先点燃______ (填“A”或“D”)处酒精灯。
(3)装置B中饱和食盐水的作用是______ ,同时还用作安全瓶(监测实验时装置C中是否发生堵塞),若装置C发生堵塞,则装置B中将观察到的现象是______ 。
(4)装置C的作用是验证氯气是否具有漂白性,为此,实验时装置C中I、Ⅱ、Ⅲ处依次放入的物质是______ 。(填“甲”“乙”“丙”或“丁”)。
(5)装置D中发生反应的化学方程式为______ 。
(6)写出装置 的作用:
的作用:______ 。
 的漂白性并制备无水
的漂白性并制备无水 。查阅相关资料得知:无水
。查阅相关资料得知:无水 在空气中易与水反应,加热易升华。
在空气中易与水反应,加热易升华。
回答下列问题:
(1)仪器
 的名称为
的名称为(2)实验开始时,应先点燃
(3)装置B中饱和食盐水的作用是
(4)装置C的作用是验证氯气是否具有漂白性,为此,实验时装置C中I、Ⅱ、Ⅲ处依次放入的物质是
| 装置 | I | Ⅱ | Ⅲ |
| 甲 | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| 乙 | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
| 丙 | 干燥的有色布条 | 无水氯化钙 | 湿润的有色布条 |
| 丁 | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
(5)装置D中发生反应的化学方程式为
(6)写出装置
 的作用:
的作用:
您最近半年使用:0次
名校
解题方法
7 . 实验室可用如图装置制备无水 。已知
。已知 易升华,易吸收水分而潮解。请回答下列问题:
易升华,易吸收水分而潮解。请回答下列问题:
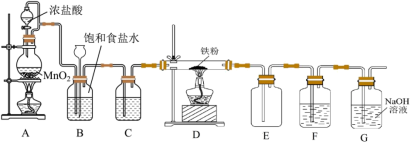
(1)连接好仪器后首先应进行的操作是_____ 。
(2)装置A盛放浓盐酸的仪器名称是_____ ,其上口与烧瓶用导管相连的作用是_____ 。
(3)A装置中发生反应的离子方程式为_____ 。
(4)装置B的作用是_____ ,G中发生反应的离子方程式为_____ 。
(5)F中所装试剂为_____ ,目的是_____ 。
 。已知
。已知 易升华,易吸收水分而潮解。请回答下列问题:
易升华,易吸收水分而潮解。请回答下列问题:
(1)连接好仪器后首先应进行的操作是
(2)装置A盛放浓盐酸的仪器名称是
(3)A装置中发生反应的离子方程式为
(4)装置B的作用是
(5)F中所装试剂为
您最近半年使用:0次
名校
8 . Li2CO3是制备锂离子电极材料LiFePO4的重要原料。以盐湖卤水(主要含有NaCl、MgCl2、LiCl和Na2B4O7等)为原料提取Li2CO3并制备LiFePO4的工艺流程如图所示:

已知:“日晒蒸发喷雾干燥”后固体含NaCl、LiCl、MgCl2•6H2O等。
(1)硼酸在水中的溶解度随温度的变化关系如图所示:
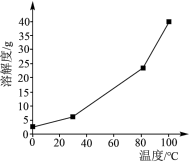
已知:H3BO3+H2O⇌[B(OH)4]-+H+。6.2gH3BO3最多与______ mL2.5mol/LNaOH溶液完全反应。“酸化脱硼”中采用______ (填“加热”或“冷却”),其目的是______ 。
(2)“水浸”后的溶液中溶质的主要成分是______ 。
(3)“蒸发分解”生成Li2CO3的化学方程式为______ 。
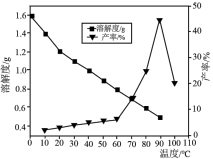
(4)已知不同温度下蒸发分解得到Li2CO3的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是______ ,制得的Li2CO3沉淀需要进行洗涤,具体操作为______ 。
(5)制备LiFePO4时同时生成CO2,其中FePO4与C6H12O6物质的量之比为24:1,该化学反应方程式为______ 。

已知:“日晒蒸发喷雾干燥”后固体含NaCl、LiCl、MgCl2•6H2O等。
(1)硼酸在水中的溶解度随温度的变化关系如图所示:

已知:H3BO3+H2O⇌[B(OH)4]-+H+。6.2gH3BO3最多与
(2)“水浸”后的溶液中溶质的主要成分是
(3)“蒸发分解”生成Li2CO3的化学方程式为
(4)已知不同温度下蒸发分解得到Li2CO3的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是

(5)制备LiFePO4时同时生成CO2,其中FePO4与C6H12O6物质的量之比为24:1,该化学反应方程式为
您最近半年使用:0次
名校
解题方法
9 . 葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过如下实验流程制得:
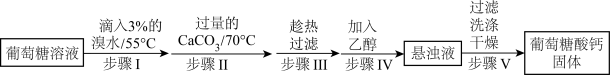
已知:a.反应原理: 。
。
b.相关物质的溶解性如下表:
c.相关物质的酸性:氢溴酸>葡萄糖酸>碳酸。
回答下列问题:
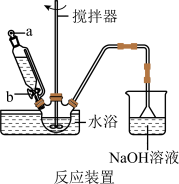
(1)步骤I中溴水氧化葡萄糖时采用了如图所示反应装置,你认为缺少的仪器是___________ ,恒压滴液漏斗使用时需要打开的活塞或玻璃塞是___________ (填“a”“b”或“a和b”)。烧杯中 溶液水浴的作用是
溶液水浴的作用是___________ 。
(2)制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其他试剂,下列物质中最适合的是___________(填序号)。
(3)步骤Ⅱ中加入过量的 ,生成葡萄糖酸钙的化学方程式为
,生成葡萄糖酸钙的化学方程式为___________ 。加入过量的 除了能提高葡萄糖酸的转化率,还有的作用是
除了能提高葡萄糖酸的转化率,还有的作用是___________ 。
(4)洗涤操作中最合适的洗涤剂是___________ (填序号),理由是___________ 。
A.冷水 B.热水 C.乙醇
(5)利用重结晶法可除去葡萄糖酸钙粗品中的杂质,提高产品的质量,选出葡萄糖酸钙重结晶过程中合理的操作并排序:___________ (填序号,操作步骤不可重复使用)。
①蒸发浓缩至溶液表面出现晶膜
②待晶体充分析出后,减压过滤
③将滤液冷却至室温,加入 95%的乙醇溶液并搅拌,促进晶体析出
95%的乙醇溶液并搅拌,促进晶体析出
④趁热减压过滤,除去不溶物
⑤在50℃下用恒温干燥箱烘干,称重
⑥取烧杯加入 蒸馏水,加热至微沸,加入葡萄糖酸钙粗品,得到葡萄糖酸钙饱和溶液
蒸馏水,加热至微沸,加入葡萄糖酸钙粗品,得到葡萄糖酸钙饱和溶液

已知:a.反应原理:
 。
。b.相关物质的溶解性如下表:
| 物质的名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 |
| 在水中的溶解性 | 可溶于冷水,易溶于热水 | 可溶 | 极易溶 |
| 在乙醇中的溶解性 | 微溶 | 微溶 | 可溶 |
回答下列问题:
(1)步骤I中溴水氧化葡萄糖时采用了如图所示反应装置,你认为缺少的仪器是
 溶液水浴的作用是
溶液水浴的作用是
(2)制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其他试剂,下列物质中最适合的是___________(填序号)。
A.新制 悬浊液 悬浊液 | B.酸性 溶液 溶液 |
C. /葡萄糖氧化酶 /葡萄糖氧化酶 | D. 溶液 溶液 |
(3)步骤Ⅱ中加入过量的
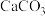 ,生成葡萄糖酸钙的化学方程式为
,生成葡萄糖酸钙的化学方程式为 除了能提高葡萄糖酸的转化率,还有的作用是
除了能提高葡萄糖酸的转化率,还有的作用是(4)洗涤操作中最合适的洗涤剂是
A.冷水 B.热水 C.乙醇
(5)利用重结晶法可除去葡萄糖酸钙粗品中的杂质,提高产品的质量,选出葡萄糖酸钙重结晶过程中合理的操作并排序:
①蒸发浓缩至溶液表面出现晶膜
②待晶体充分析出后,减压过滤
③将滤液冷却至室温,加入
 95%的乙醇溶液并搅拌,促进晶体析出
95%的乙醇溶液并搅拌,促进晶体析出④趁热减压过滤,除去不溶物
⑤在50℃下用恒温干燥箱烘干,称重
⑥取烧杯加入
 蒸馏水,加热至微沸,加入葡萄糖酸钙粗品,得到葡萄糖酸钙饱和溶液
蒸馏水,加热至微沸,加入葡萄糖酸钙粗品,得到葡萄糖酸钙饱和溶液
您最近半年使用:0次
名校
解题方法
10 . 高铁酸钾( )是一种高效多功能的新型非氯消毒剂,易溶于水、微溶于浓碱溶液,不溶于乙醇,在
)是一种高效多功能的新型非氯消毒剂,易溶于水、微溶于浓碱溶液,不溶于乙醇,在 的强碱性溶液中较稳定,在酸性至弱碱性条件下,能与水反应生成
的强碱性溶液中较稳定,在酸性至弱碱性条件下,能与水反应生成 和
和 。
。
Ⅰ.湿法制备高铁酸钾。主要的生产流程如图所示:
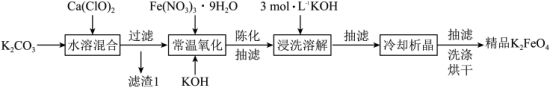
回答以下问题:
(1)滤渣1的主要成分为
(2)写出常温氧化过程的离子方程式
(3)氧化时需控温
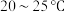 ,温度不能高于
,温度不能高于 原因是
原因是Ⅱ.某兴趣小组在实验室模拟湿法制备 ,装置如图所示:
,装置如图所示:
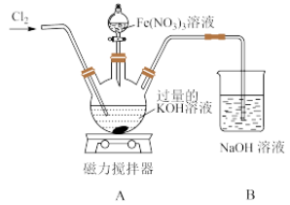
(4)通入的氯气不能过量的原因是
(5)制备的高铁酸钾粗产品中含有
 、
、 、
、 等杂质,请将以下提纯步骤补充完整,(实验药品:高铁酸钾粗产品、蒸馏水、乙醇、饱和
等杂质,请将以下提纯步骤补充完整,(实验药品:高铁酸钾粗产品、蒸馏水、乙醇、饱和 溶液、饱和
溶液、饱和 溶液、冷的稀
溶液、冷的稀 溶液、冰水)。
溶液、冰水)。①取一定量的高铁酸钾粗产品溶于
②过滤,将滤液置于冰水浴中,向滤液中加入饱和 溶液;
溶液;
③搅拌、静置、过滤,用 次,在真空干燥箱中干燥。
次,在真空干燥箱中干燥。
④实验结束时通入氮气的目的是
您最近半年使用:0次








