1 . 过二硫酸钠( )也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用
)也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用 溶液和一定浓度的NaOH溶液混合可制得
溶液和一定浓度的NaOH溶液混合可制得 晶体。实验室制备
晶体。实验室制备 晶体的装置如下图所示:
晶体的装置如下图所示: 。
。
(1)写出装置中生成 的反应的化学方程式:
的反应的化学方程式:___________ 。
(2)盛装NaOH溶液的仪器名称为___________ ,持续通入氮气的目的是___________ 。
(3)装置中硫酸的作用是___________ 。
(4)某兴趣小组设计实验探究不同环境下 氧化性的强弱。将
氧化性的强弱。将 (1.69g)与过量
(1.69g)与过量 (10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。
(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。
①在___________ (填“中性”“酸性”或“碱性”)条件下, 的氧化能力最强。
的氧化能力最强。
②若用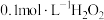 溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为
溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为___________ ;达到滴定终点时,消耗 溶液的体积为
溶液的体积为 。则碱性氧化后的溶液中
。则碱性氧化后的溶液中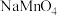 的质量为
的质量为___________ g(用含 的代数式表示,
的代数式表示,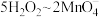 )
)
 )也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用
)也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用 溶液和一定浓度的NaOH溶液混合可制得
溶液和一定浓度的NaOH溶液混合可制得 晶体。实验室制备
晶体。实验室制备 晶体的装置如下图所示:
晶体的装置如下图所示: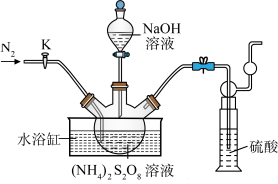
 。
。(1)写出装置中生成
 的反应的化学方程式:
的反应的化学方程式:(2)盛装NaOH溶液的仪器名称为
(3)装置中硫酸的作用是
(4)某兴趣小组设计实验探究不同环境下
 氧化性的强弱。将
氧化性的强弱。将 (1.69g)与过量
(1.69g)与过量 (10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。
(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。| 环境 | 调节溶液氧化环境时的现象 | 加热煮沸3min期间产生的现象 |
| 中性 | 加入VmL蒸馏水,无明显现象 | 30s时开始有大量气泡冒出,3min后溶液变为深棕色,溶液中有悬浮小颗粒 |
| 碱性 | 加入VmL某浓度的NaOH溶液,瞬间变为棕色( ) ) | 10s后溶液逐渐变为深紫色( ),没有明显冒气泡现象 ),没有明显冒气泡现象 |
| 酸性 | 加入VmL稀硫酸无明显现象 | 煮沸3min后,有气泡冒出 |
 的氧化能力最强。
的氧化能力最强。②若用
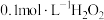 溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为
溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为 溶液的体积为
溶液的体积为 。则碱性氧化后的溶液中
。则碱性氧化后的溶液中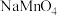 的质量为
的质量为 的代数式表示,
的代数式表示,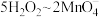 )
)
您最近半年使用:0次
解题方法
2 . 在中国古代,硫酸被炼丹术士称为“绿矾油”。这是因为生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧后,釜中逸出刺激性气味的气体,同时有油状液体流出,残留固体呈红棕色。

(1)请写出煅烧绿矾过程中发生反应的化学方程式:
①___________ ;
②___________ 。
(2)化学探究小组的同学用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去),其中b为干燥的试管。下列关于该反应说法正确的是___________。

(1)请写出煅烧绿矾过程中发生反应的化学方程式:
①
②
(2)化学探究小组的同学用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去),其中b为干燥的试管。下列关于该反应说法正确的是___________。
A.若将反应后的气体通入 溶液中,产生的沉淀为 溶液中,产生的沉淀为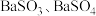 |
B.b中产物用紫色石蕊试液即可检验出其中 和 和 |
C.为检验反应的气态生成物是 ,试管c中应加入的试剂为NaOH溶液 ,试管c中应加入的试剂为NaOH溶液 |
| D.b中所得到的硫酸的质量分数为29.5% |
您最近半年使用:0次
名校
解题方法
3 . 连二亚硫酸钠(Na2S2O4)俗称保险粉,广泛应用于纺织业和造纸业。利用碱性NaBH4溶液或Zn还原含硫化合物是制备Na2S2O4常用方法。
已知:①Na2S2O4在水溶液可以发生歧化反应(只有S元素化合价的升降),受热易分解。
②NaBH4是一种强还原剂,酸性或受热条件下易与水反应产生氢气,在碱性溶液中比较稳定。
③生成物的ΔG越大,表示在该条件下转化成该物质的可能性较大。溶液中部分含硫组分的ΔG如图所示。

Ⅰ.NaBH4碱性溶液还原法
(1)12%NaBH4碱性溶液配制:在烧杯中加入48g水,再向其中加入___________ (请完成溶液配制,所需试剂为40gNaOH固体及12gNaBH4固体)。
(2)溶有饱和SO2的NaHSO3溶液制备:利用如图所示装置来制备该溶液,判断制备完成的方法是___________ 。

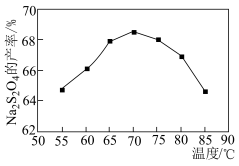
(3)将12%NaBH4碱性溶液与制备的NaHSO3溶液在无氧、水浴加热的条件下发生反应,相同时间内,Na2S2O4的产率随温度的变化如图所示,70℃后Na2S2O4的产率下降的原因是___________ 。Na2S2O4在水溶液中发生歧化反应的离子方程式为___________ 。
Ⅱ.锌粉还原法
已知:①Zn+2H2SO3 ZnS2O4(易溶于水)+2H2O;
ZnS2O4(易溶于水)+2H2O;
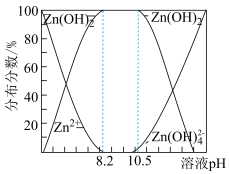
②二价锌在水溶液中的存在形式与pH的关系如图所示。
(4)请补充完整由锌粉制备Na2S2O4粗品的实验方案:向盛有水的烧杯中加入一定量的Zn粉,搅拌,___________ ,向滤液中加入氯化钠粉末至有大量晶体析出,过滤得到Na2S2O4粗品(实验中须使用的试剂:SO2、1mol·L-1NaOH溶液)。
已知:①Na2S2O4在水溶液可以发生歧化反应(只有S元素化合价的升降),受热易分解。
②NaBH4是一种强还原剂,酸性或受热条件下易与水反应产生氢气,在碱性溶液中比较稳定。
③生成物的ΔG越大,表示在该条件下转化成该物质的可能性较大。溶液中部分含硫组分的ΔG如图所示。

Ⅰ.NaBH4碱性溶液还原法
(1)12%NaBH4碱性溶液配制:在烧杯中加入48g水,再向其中加入
(2)溶有饱和SO2的NaHSO3溶液制备:利用如图所示装置来制备该溶液,判断制备完成的方法是

(3)将12%NaBH4碱性溶液与制备的NaHSO3溶液在无氧、水浴加热的条件下发生反应,相同时间内,Na2S2O4的产率随温度的变化如图所示,70℃后Na2S2O4的产率下降的原因是

Ⅱ.锌粉还原法
已知:①Zn+2H2SO3
 ZnS2O4(易溶于水)+2H2O;
ZnS2O4(易溶于水)+2H2O;②二价锌在水溶液中的存在形式与pH的关系如图所示。

(4)请补充完整由锌粉制备Na2S2O4粗品的实验方案:向盛有水的烧杯中加入一定量的Zn粉,搅拌,
您最近半年使用:0次
2024-02-22更新
|
284次组卷
|
2卷引用:江苏省南通市如东中学,如东一高等四校2023-2024学年高三上学期12月学情调研化学试题
名校
解题方法
4 . 实验室制备CuCl:将按一定物质的量之比混合的CuSO4溶液和NaCl溶液加入到三颈烧瓶中(装置如图1所示,其中夹持仪器已省略),通入SO2,充分反应后过滤,得CuCl。CuCl的产率随NaCl和CuSO4的物质的量之比变化如图2所示。已知:CuCl是难溶于水的白色固体,能溶于浓盐酸产生[CuCl2]-。下列说法错误的是

| A.装置a中每生成1 mol CuCl,理论上至少需要通入标准状况下22.4 L SO2 |
| B.装置b的作用是安全瓶,防止倒吸 |
| C.装置c中的液体可以是NaOH浓溶液,吸收尾气 |
| D.当n(NaCl)/n(CuSO4)大于1.6时,CuCl产率减小的原因是部分CuCl转化为[CuCl2]- |
您最近半年使用:0次
2024-01-10更新
|
171次组卷
|
2卷引用:江苏省连云港市2023-2024学年高二上学期普通高中学业水平合格性考试模拟化学试题
5 . 亚硝酸钠( )是一种白色结晶状粉末,易溶于水,易被氧化,可用作织物染色的媒染剂、漂白剂等;工业制取亚硝酸钠晶体的基本流程如图所示。现设计相关实验测定其产品纯度。
)是一种白色结晶状粉末,易溶于水,易被氧化,可用作织物染色的媒染剂、漂白剂等;工业制取亚硝酸钠晶体的基本流程如图所示。现设计相关实验测定其产品纯度。 溶液从设备顶部以雾状喷下吸收从底部通入的尾气,其优点是:
溶液从设备顶部以雾状喷下吸收从底部通入的尾气,其优点是:_____ 。
(2)还原:若硝酸在“还原”阶段只生成 ,则氧化剂与还原剂的物质的量之比为:
,则氧化剂与还原剂的物质的量之比为:____ 。
(3)测定产品中 纯度。实验操作如下:
纯度。实验操作如下:
ⅰ.用电子天平称取7.500g样品,配成500mL样品溶液。
ⅱ.向锥形瓶中准确移入50.00mL样品溶液,滴加适量的 溶液酸化,加热至40~50℃,冷却后,用0.10
溶液酸化,加热至40~50℃,冷却后,用0.10
 溶液进行滴定(已知:
溶液进行滴定(已知: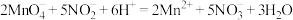 ),至恰好完全反应,消耗
),至恰好完全反应,消耗 溶液40.00mL。
溶液40.00mL。
ⅲ.重复滴定三次。
①测定时操作时间不宜过长,否则测定的结果将会___________ (填“偏大”或“偏小”)。
②该亚硝酸钠晶体产品中可能含有的杂质有:___________ 、 和
和 。
。
③试计算产品中 纯度(即
纯度(即 的质量分数)是
的质量分数)是___________ (写出计算过程)。
 )是一种白色结晶状粉末,易溶于水,易被氧化,可用作织物染色的媒染剂、漂白剂等;工业制取亚硝酸钠晶体的基本流程如图所示。现设计相关实验测定其产品纯度。
)是一种白色结晶状粉末,易溶于水,易被氧化,可用作织物染色的媒染剂、漂白剂等;工业制取亚硝酸钠晶体的基本流程如图所示。现设计相关实验测定其产品纯度。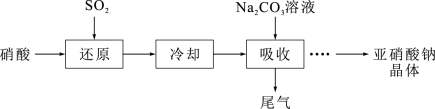
 溶液从设备顶部以雾状喷下吸收从底部通入的尾气,其优点是:
溶液从设备顶部以雾状喷下吸收从底部通入的尾气,其优点是:(2)还原:若硝酸在“还原”阶段只生成
 ,则氧化剂与还原剂的物质的量之比为:
,则氧化剂与还原剂的物质的量之比为:(3)测定产品中
 纯度。实验操作如下:
纯度。实验操作如下:ⅰ.用电子天平称取7.500g样品,配成500mL样品溶液。
ⅱ.向锥形瓶中准确移入50.00mL样品溶液,滴加适量的
 溶液酸化,加热至40~50℃,冷却后,用0.10
溶液酸化,加热至40~50℃,冷却后,用0.10
 溶液进行滴定(已知:
溶液进行滴定(已知: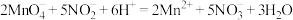 ),至恰好完全反应,消耗
),至恰好完全反应,消耗 溶液40.00mL。
溶液40.00mL。ⅲ.重复滴定三次。
①测定时操作时间不宜过长,否则测定的结果将会
②该亚硝酸钠晶体产品中可能含有的杂质有:
 和
和 。
。③试计算产品中
 纯度(即
纯度(即 的质量分数)是
的质量分数)是
您最近半年使用:0次
6 . Ⅰ.已知A和B两支试管的溶液中共含有 、
、 、
、 、
、 、
、 、
、 六种离子,向试管B的溶液中滴入酚酞,溶液呈粉红色。请回答下列问题:
六种离子,向试管B的溶液中滴入酚酞,溶液呈粉红色。请回答下列问题:
(1)试管B中含有的离子为_______ ;
(2)若向试管A的溶液中加入合适的药品,过滤后可以得到相应的金属和仅含一种溶质的溶液,则加入的药品是_______ (填化学式);
(3)若将试管A和试管B中的溶液按一定体积比混合过滤后,蒸干滤液可得到一种纯净物,该物质可以用作_______ (列举一种用途即可),混合过程中发生反应的离子方程式为:_______ 、_______ 。
Ⅱ.甲同学用如下装置模拟“侯氏制碱法”制纯碱。
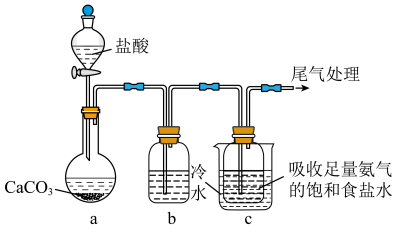
(4)c中饱和食盐水事先吸收足量 的原因是
的原因是_______ ;
(5)装置c中发生反应的离子反应方程式为_______ 。
 、
、 、
、 、
、 、
、 、
、 六种离子,向试管B的溶液中滴入酚酞,溶液呈粉红色。请回答下列问题:
六种离子,向试管B的溶液中滴入酚酞,溶液呈粉红色。请回答下列问题:(1)试管B中含有的离子为
(2)若向试管A的溶液中加入合适的药品,过滤后可以得到相应的金属和仅含一种溶质的溶液,则加入的药品是
(3)若将试管A和试管B中的溶液按一定体积比混合过滤后,蒸干滤液可得到一种纯净物,该物质可以用作
Ⅱ.甲同学用如下装置模拟“侯氏制碱法”制纯碱。

(4)c中饱和食盐水事先吸收足量
 的原因是
的原因是(5)装置c中发生反应的离子反应方程式为
您最近半年使用:0次
7 . 印刷电路的废腐蚀液含有大量 、
、 和
和 ,任意排放将导致环境污染及资源的浪费。可从该废液中回收铜,并将铁的化合物全部转化为
,任意排放将导致环境污染及资源的浪费。可从该废液中回收铜,并将铁的化合物全部转化为 溶液,作为腐蚀液原料循环使用。测得某废腐蚀液中含
溶液,作为腐蚀液原料循环使用。测得某废腐蚀液中含 1.5mol/L,
1.5mol/L, 3.0mol/L,
3.0mol/L, 1.0mol/L,HCl 3.0mol/L。取废腐蚀液200mL按如下流程在实验室进行实验:
1.0mol/L,HCl 3.0mol/L。取废腐蚀液200mL按如下流程在实验室进行实验:
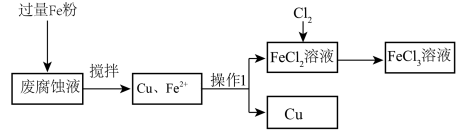
回答下列问题:
(1)取少量废腐蚀液于试管中,滴入1~2滴KSCN溶液,若溶液显_______ (填“红色”或“蓝色”、“紫色”),证明废液含有 。
。
(2)上述方法获得的铜粉中含有杂质,除杂所需试剂是_______ (填化学式)。
(3)操作Ⅰ是_______ ,该操作需用到的玻璃仪器有烧杯、普通漏斗和_______ 。
(4) 溶液中加入Fe粉,发生反应的离子方程式为
溶液中加入Fe粉,发生反应的离子方程式为_______ 。
 、
、 和
和 ,任意排放将导致环境污染及资源的浪费。可从该废液中回收铜,并将铁的化合物全部转化为
,任意排放将导致环境污染及资源的浪费。可从该废液中回收铜,并将铁的化合物全部转化为 溶液,作为腐蚀液原料循环使用。测得某废腐蚀液中含
溶液,作为腐蚀液原料循环使用。测得某废腐蚀液中含 1.5mol/L,
1.5mol/L, 3.0mol/L,
3.0mol/L, 1.0mol/L,HCl 3.0mol/L。取废腐蚀液200mL按如下流程在实验室进行实验:
1.0mol/L,HCl 3.0mol/L。取废腐蚀液200mL按如下流程在实验室进行实验:
回答下列问题:
(1)取少量废腐蚀液于试管中,滴入1~2滴KSCN溶液,若溶液显
 。
。(2)上述方法获得的铜粉中含有杂质,除杂所需试剂是
(3)操作Ⅰ是
(4)
 溶液中加入Fe粉,发生反应的离子方程式为
溶液中加入Fe粉,发生反应的离子方程式为
您最近半年使用:0次
8 . 氮、硫的化合物与人类生活和生产有着密切的联系。
Ⅰ.氨既是一种重要的化工产品,又是一种重要的化工原料。图1为合成氨以及氨氧化制硝酸的流程示意图。

(1)合成塔中发生反应的化学方程式为_____ 氧化炉中发生反应的化学方程式为_____ 。
(2)A为_____ ;向吸收塔中通入A的作用_____ 。
(3)工业生产中为了盛装大量浓硝酸,可选择_____ (填字母)作为罐体材料。
a.铜 b.铂 c.铝 d.镁
Ⅱ.浓硫酸与木炭在加热条件下可发生化学反应,为检验反应的产物,某同学设计了如图2所示的实验。请据此回答下列问题:
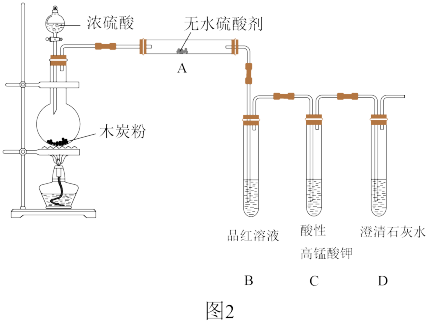
(4)浓硫酸与木炭反应的化学方程式:_____ 。
(5)装置B中的现象_____ ;证明产物中有_____ 。
(6)装置C的作用是_____ 。
Ⅰ.氨既是一种重要的化工产品,又是一种重要的化工原料。图1为合成氨以及氨氧化制硝酸的流程示意图。

(1)合成塔中发生反应的化学方程式为
(2)A为
(3)工业生产中为了盛装大量浓硝酸,可选择
a.铜 b.铂 c.铝 d.镁
Ⅱ.浓硫酸与木炭在加热条件下可发生化学反应,为检验反应的产物,某同学设计了如图2所示的实验。请据此回答下列问题:

(4)浓硫酸与木炭反应的化学方程式:
(5)装置B中的现象
(6)装置C的作用是
您最近半年使用:0次
名校
解题方法
9 . 加强废旧金属的回收和再利用,是合理开发和利用金属资源的主要途径之一、下图是从镀铜废电路板中回收金属铜的一种工艺流程(各过程需控制适宜条件)。
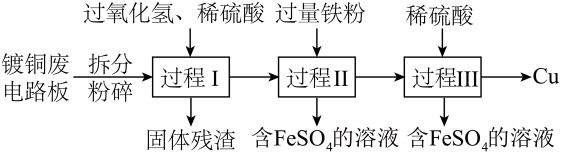
(1)拆分镀铜废电路板后将其粉碎,其目的是为了___________ (填“增大”或“减小”)过程Ⅰ反应的化学反应速率;
(2)过程Ⅰ中,Cu溶解反应的离子方程式是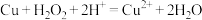 ,过氧化氢的作用是
,过氧化氢的作用是___________ (填“氧化剂”或“还原剂”);
(3)过程Ⅲ的实验操作是___________ (填“蒸发”或“过滤”);
(4)已知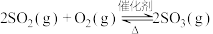 ,一定条件下,将0.2mol
,一定条件下,将0.2mol 和0.2mol
和0.2mol 通入10L恒容密闭容器中,反应1min后,测得
通入10L恒容密闭容器中,反应1min后,测得 的物质的量为0.15mol,则:
的物质的量为0.15mol,则:
①用 的浓度变化表示1min内
的浓度变化表示1min内 的平均反应速率为
的平均反应速率为___________ mol/(L·min);
②反应达到最大限度时,正反应速率___________ 逆反应速率(填“>”“<”或“=”)。

(1)拆分镀铜废电路板后将其粉碎,其目的是为了
(2)过程Ⅰ中,Cu溶解反应的离子方程式是
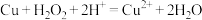 ,过氧化氢的作用是
,过氧化氢的作用是(3)过程Ⅲ的实验操作是
(4)已知
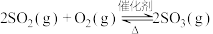 ,一定条件下,将0.2mol
,一定条件下,将0.2mol 和0.2mol
和0.2mol 通入10L恒容密闭容器中,反应1min后,测得
通入10L恒容密闭容器中,反应1min后,测得 的物质的量为0.15mol,则:
的物质的量为0.15mol,则:①用
 的浓度变化表示1min内
的浓度变化表示1min内 的平均反应速率为
的平均反应速率为②反应达到最大限度时,正反应速率
您最近半年使用:0次
名校
解题方法
10 . 氯化亚铜(CuCl)微溶于水,易被氧化,广泛应用于医药等行业。以废铜渣(铜单质的质量分数为64%,CuO的质量分数为8%,其他杂质不含铜元素)为原料,可制备CuCl并获得副产品(NH4)2SO4,流程如下:
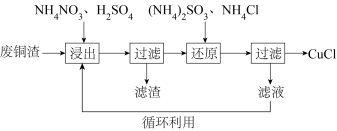
(1)“浸出”时发生的主要反应有:
反应Ⅰ. CuO + H2SO4 = CuSO4 + H2O
反应Ⅱ. 4Cu + NH4NO3 + 5H2SO4 = 4CuSO4 + (NH4)2SO4 + 3H2O
①浸出温度为20℃时,铜元素浸出率随时间的变化如图所示。铜元素浸出率 =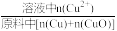 ×100%
×100%

结合图像,从反应速率的角度分析,可得出的结论是_______ 。
②实际浸出温度选择65℃,可提高单位时间内铜元素浸出率。若温度过高,会产生红棕色气体,该气体的化学式为_______ 。
(2)充分浸出后,“还原”时加入的(NH4)2SO3溶液需略过量,“还原”后的滤液经多次循环可提取一定量的(NH4)2SO4(忽略转化流程中杂质参与的反应)。
①“还原”时(NH4)2SO3溶液过量的原因是_______ (写出两点)。
②假设铜元素完全浸出,忽略过量的(NH4)2SO3,计算100 g废铜渣理论上可制得CuCl与(NH4)2SO4的物质的量______ (写出计算过程)。

(1)“浸出”时发生的主要反应有:
反应Ⅰ. CuO + H2SO4 = CuSO4 + H2O
反应Ⅱ. 4Cu + NH4NO3 + 5H2SO4 = 4CuSO4 + (NH4)2SO4 + 3H2O
①浸出温度为20℃时,铜元素浸出率随时间的变化如图所示。铜元素浸出率 =
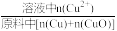 ×100%
×100%
结合图像,从反应速率的角度分析,可得出的结论是
②实际浸出温度选择65℃,可提高单位时间内铜元素浸出率。若温度过高,会产生红棕色气体,该气体的化学式为
(2)充分浸出后,“还原”时加入的(NH4)2SO3溶液需略过量,“还原”后的滤液经多次循环可提取一定量的(NH4)2SO4(忽略转化流程中杂质参与的反应)。
①“还原”时(NH4)2SO3溶液过量的原因是
②假设铜元素完全浸出,忽略过量的(NH4)2SO3,计算100 g废铜渣理论上可制得CuCl与(NH4)2SO4的物质的量
您最近半年使用:0次
2023-04-19更新
|
522次组卷
|
3卷引用:江苏省2023年普通高中学业水平合格性考试化学试题
江苏省2023年普通高中学业水平合格性考试化学试题江苏省盐城市响水中学2023-2024学年高二上学期期中考试化学(必修)试题(已下线)题型三 工艺流程中的答题规范-备战2024年高考化学答题技巧与模板构建



