名校
解题方法
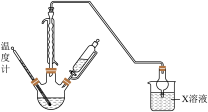
1 . 利用如图的装置(省略部分加热装置)制备 (铋酸钠),已知
(铋酸钠),已知 不溶于冷水且在酸性溶液中迅速分解,
不溶于冷水且在酸性溶液中迅速分解, 是一种难溶于水的白色沉淀。下列说法正确的是
是一种难溶于水的白色沉淀。下列说法正确的是
 (铋酸钠),已知
(铋酸钠),已知 不溶于冷水且在酸性溶液中迅速分解,
不溶于冷水且在酸性溶液中迅速分解, 是一种难溶于水的白色沉淀。下列说法正确的是
是一种难溶于水的白色沉淀。下列说法正确的是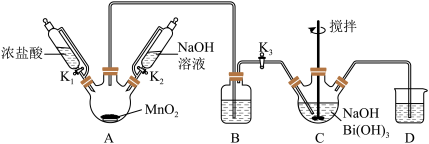
A.装置B应放入饱和 溶液,目的是吸收A中挥发的盐酸 溶液,目的是吸收A中挥发的盐酸 |
B.为使 完全转化为 完全转化为 ,反应过程中应向装置C通入过量 ,反应过程中应向装置C通入过量 |
C.拆除装置前必须进行的操作是关闭 、 、 ,打开 ,打开 |
D.上述反应中若消耗22.4L  则理论上可制得280g 则理论上可制得280g  |
您最近半年使用:0次
名校
解题方法
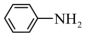
2 . 苯胺是一种重要精细化工原料,在染料、医药等行业中具有广泛的应用。可利用硝基苯制取苯胺,原理如下:
I.制取硝基苯。
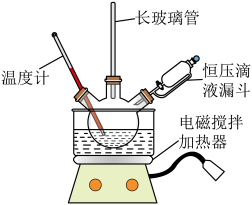
实验步骤:实验室采用如图所示装置制取硝基苯,恒压滴液漏斗中装有一定量的苯,三颈烧瓶装有一定比例的浓硫酸和浓硝酸混合物。___________ 代替(填仪器名称),图中恒压滴液漏斗侧面橡胶管的作用___________ 。
(2)下列说法中正确的是___________(填序号)。
(3)三颈烧瓶中发生反应的化学方程式___________ 。
(4)提纯产品的过程中需要用5%NaOH溶液洗涤三颈烧瓶中的粗产品,其目的是___________ 。
Ⅱ.制取苯胺
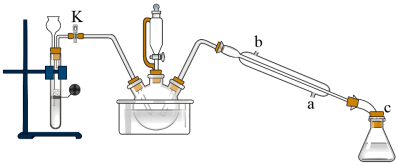
①组装好实验装置(如下图,夹持仪器已略去),并检查气密性。
②先向三颈烧瓶中加入沸石及硝基苯,再取下恒压滴液漏斗,换上温度计。
③打开活塞K,通入H2一段时间。
④利用油浴加热,使反应液温度维持在140℃进行反应。
⑤反应结束后,关闭活塞K,向三颈烧瓶中加入生石灰。
⑥调整好温度计的位置,继续加热,收集182~186℃馏分,得到较纯苯胺。
(5)若实验中步骤③和④的顺序颠倒,则实验中可能产生的不良后果除爆炸外还有___________ 。
(6)步骤⑤中,加入生石灰的作用是___________ 。
(7)若实验中硝基苯用量为10 mL,最后得到苯胺5.6g,苯胺的产率为___________ (计算结果精确到0.1%)。
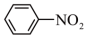 +3H2
+3H2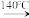
 +2H2O
+2H2O
| 物质 | 相对分子质量 | 沸点/℃ | 密度 g/mL | 溶解性 |
| 硝基苯 | 123 | 210.9 | 1.23 | 不溶于水,易溶于乙醇、乙醚 |
| 苯胺 | 93 | 184.4 | 1.02 | 微溶于水,易溶于乙醇、乙醚;还原性强、易被氧化 |
实验步骤:实验室采用如图所示装置制取硝基苯,恒压滴液漏斗中装有一定量的苯,三颈烧瓶装有一定比例的浓硫酸和浓硝酸混合物。
(2)下列说法中正确的是___________(填序号)。
| A.配制混酸时,将浓硝酸沿杯壁缓缓加入浓硫酸中,并不断搅拌、冷却 |
| B.温度控制在50~60℃原因之一是减少副反应的发生 |
| C.制得的粗硝基苯可以先用乙醇萃取,分液后再洗涤 |
| D.浓硫酸可以降低该反应活化能 |
(3)三颈烧瓶中发生反应的化学方程式
(4)提纯产品的过程中需要用5%NaOH溶液洗涤三颈烧瓶中的粗产品,其目的是
Ⅱ.制取苯胺
①组装好实验装置(如下图,夹持仪器已略去),并检查气密性。
②先向三颈烧瓶中加入沸石及硝基苯,再取下恒压滴液漏斗,换上温度计。
③打开活塞K,通入H2一段时间。
④利用油浴加热,使反应液温度维持在140℃进行反应。
⑤反应结束后,关闭活塞K,向三颈烧瓶中加入生石灰。
⑥调整好温度计的位置,继续加热,收集182~186℃馏分,得到较纯苯胺。
(5)若实验中步骤③和④的顺序颠倒,则实验中可能产生的不良后果除爆炸外还有
(6)步骤⑤中,加入生石灰的作用是
(7)若实验中硝基苯用量为10 mL,最后得到苯胺5.6g,苯胺的产率为
您最近半年使用:0次
解题方法
3 . 叠氮化钾能促进难以萌发的种子发育,在新作物育种中应用广泛,实验室制备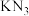 流程如下。回答下列问题:
流程如下。回答下列问题: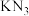 。已知:
。已知:
①制备亚硝酸异丙酯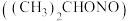 在烧杯中进行
在烧杯中进行
②制备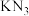 的D、E和F阶段均在如图装置中完成。
的D、E和F阶段均在如图装置中完成。
(1)仪器B的作用是_______ 。
(2)仪器A中发生反应时,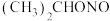 与水合肼
与水合肼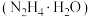 在碱性条件下,重新生成
在碱性条件下,重新生成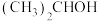 (异丙醇),该反应的化学方程式为
(异丙醇),该反应的化学方程式为_______ 。
(3)在制备亚硝酸异丙酯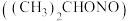 中,洗涤亚硝酸异丙酯使用
中,洗涤亚硝酸异丙酯使用 溶液,目的:
溶液,目的:_______ 。
(4)关于上述流程中各步骤的说法,正确的是_______ (填标号)。
A.步骤D还需要的仪器是容量瓶和胶头滴管
B.制备亚硝酸异丙酯时用冰盐浴的目的是防止反应过于剧烈
C.步骤F加入无水乙醇的目的是促进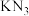 的析出
的析出
(5)在F阶段,向反应后混合物中“加入无水乙醇”并“冰盐浴冷却”的目的_______ 。
II.纯度检测——“分光光度法”: 与
与 反应灵敏,生成红色配合物,在一定波长下测量红色溶液的吸光度,利用“
反应灵敏,生成红色配合物,在一定波长下测量红色溶液的吸光度,利用“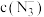 ——吸光度”曲线确定样品溶液中的
——吸光度”曲线确定样品溶液中的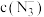 。
。
查阅文献可知:不同浓度的5.0mL标准溶液,分别加入5.0mL(足量) 溶液,摇匀后测量吸光度,可绘制标准溶液的
溶液,摇匀后测量吸光度,可绘制标准溶液的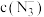 与吸光度的关系曲线如图所示。
与吸光度的关系曲线如图所示。
①准确称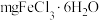 晶体,配制
晶体,配制 标准液(与文献浓度一致)。
标准液(与文献浓度一致)。
②准确称取0.72g样品,配制成100mL溶液,取5.0mL待测溶液,向其中加入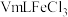 (足量)标准液,摇匀后测得吸光度为0.6。
(足量)标准液,摇匀后测得吸光度为0.6。
(6)简述配制 标准液时,溶解
标准液时,溶解 晶体的方法
晶体的方法_______ 。
(7)步骤②中取用 标准液
标准液
_______ mL,样品的质量分数为_______ 。
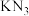 流程如下。回答下列问题:
流程如下。回答下列问题:
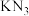 。已知:
。已知:①制备亚硝酸异丙酯
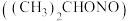 在烧杯中进行
在烧杯中进行②制备
 的D、E和F阶段均在如图装置中完成。
的D、E和F阶段均在如图装置中完成。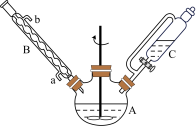
| 物质 | 颜色、状态 | 沸点(℃) | 溶解性 |
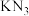 | 无色晶体 | 受热易分解 | 易溶于水,微溶于乙醇,不溶于乙醚 |
 | 无色液体 | 118 | 微溶于水,与乙醇、乙醚混溶 |
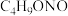 | 无色或淡黄色油状液体 | 78 | 不溶于水,与乙醇、乙醚混溶 |
 | 无色油状液体 | 118 | 与水、乙醇混溶,不溶于乙醚 |
(1)仪器B的作用是
(2)仪器A中发生反应时,
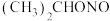 与水合肼
与水合肼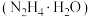 在碱性条件下,重新生成
在碱性条件下,重新生成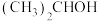 (异丙醇),该反应的化学方程式为
(异丙醇),该反应的化学方程式为(3)在制备亚硝酸异丙酯
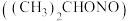 中,洗涤亚硝酸异丙酯使用
中,洗涤亚硝酸异丙酯使用 溶液,目的:
溶液,目的:(4)关于上述流程中各步骤的说法,正确的是
A.步骤D还需要的仪器是容量瓶和胶头滴管
B.制备亚硝酸异丙酯时用冰盐浴的目的是防止反应过于剧烈
C.步骤F加入无水乙醇的目的是促进
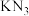 的析出
的析出(5)在F阶段,向反应后混合物中“加入无水乙醇”并“冰盐浴冷却”的目的
II.纯度检测——“分光光度法”:
 与
与 反应灵敏,生成红色配合物,在一定波长下测量红色溶液的吸光度,利用“
反应灵敏,生成红色配合物,在一定波长下测量红色溶液的吸光度,利用“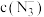 ——吸光度”曲线确定样品溶液中的
——吸光度”曲线确定样品溶液中的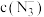 。
。查阅文献可知:不同浓度的5.0mL标准溶液,分别加入5.0mL(足量)
 溶液,摇匀后测量吸光度,可绘制标准溶液的
溶液,摇匀后测量吸光度,可绘制标准溶液的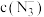 与吸光度的关系曲线如图所示。
与吸光度的关系曲线如图所示。
①准确称
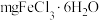 晶体,配制
晶体,配制 标准液(与文献浓度一致)。
标准液(与文献浓度一致)。②准确称取0.72g样品,配制成100mL溶液,取5.0mL待测溶液,向其中加入
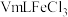 (足量)标准液,摇匀后测得吸光度为0.6。
(足量)标准液,摇匀后测得吸光度为0.6。(6)简述配制
 标准液时,溶解
标准液时,溶解 晶体的方法
晶体的方法(7)步骤②中取用
 标准液
标准液
您最近半年使用:0次
解题方法
4 . 某化学兴趣小组对钠和钠的化合物进行了一系列的实验探究,请回答下列问题。
实验Ⅰ:探究二氧化碳与过氧化钠的反应是否有氧气生成,设计了如图所示的实验装置。_______ ,作用是_______ 。
(2)指出装置 中的错误之处:
中的错误之处:_______ 。
(3)取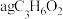 在氧气中完全燃烧,将其产物与足量
在氧气中完全燃烧,将其产物与足量 固体完全反应,反应后固体质量的增加量
固体完全反应,反应后固体质量的增加量_______ (填“大于”“等于”或“小于”) 。
。
实验Ⅱ:利用如图所示装置(省略夹持装置)模拟工业级 的制备。
的制备。 。
。
(4)装置 中盛放的药品为
中盛放的药品为_______ 。
(5)实验中使用油浴加热而不使用水浴加热的原因是_______ 。
(6)氨气与熔融钠反应生成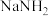 的化学方程式为
的化学方程式为_______ 。
实验Ⅰ:探究二氧化碳与过氧化钠的反应是否有氧气生成,设计了如图所示的实验装置。
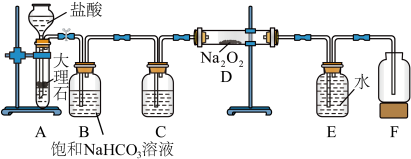
(2)指出装置
 中的错误之处:
中的错误之处:(3)取
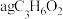 在氧气中完全燃烧,将其产物与足量
在氧气中完全燃烧,将其产物与足量 固体完全反应,反应后固体质量的增加量
固体完全反应,反应后固体质量的增加量 。
。实验Ⅱ:利用如图所示装置(省略夹持装置)模拟工业级
 的制备。
的制备。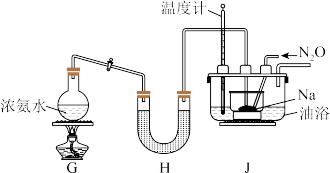
 。
。(4)装置
 中盛放的药品为
中盛放的药品为(5)实验中使用油浴加热而不使用水浴加热的原因是
(6)氨气与熔融钠反应生成
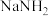 的化学方程式为
的化学方程式为
您最近半年使用:0次
解题方法
5 . 在生活中亚硝酸钠 应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知
应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知 ,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
②酸性高锰酸钾溶液可将 氧化成
氧化成 。
。
回答下列问题:
Ⅰ. 的制备:
的制备:
(1)装置A中的仪器名称分别是______ ,仪器按气流方向连接顺序为b→______ 。
(2)反应开始前打开止水夹a,通入过量氮气的目的是______ ;反应结束后打开止水夹a,再通入过量氮气的目的是______ 。
(3)装置D的作用是______ 。
(4)判断 已被NO反应完全的现象是
已被NO反应完全的现象是______ 。
Ⅱ.
(5)写出实验室制氨气的化学方程式______ 。
Ⅲ.测定的纯度(假设杂质不与反应):
(6)准确称取反应后的固体3.000g于烧杯中,加入蒸馏水溶解,配成250mL的溶液;取出25.00mL的溶液于锥形瓶中,滴入 的酸性
的酸性 溶液至恰好完全反应,用去16mL的酸性
溶液至恰好完全反应,用去16mL的酸性 溶液。固体中
溶液。固体中 的纯度为
的纯度为______ %。
 应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知
应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知 ,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。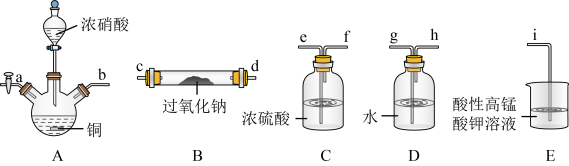
②酸性高锰酸钾溶液可将
 氧化成
氧化成 。
。回答下列问题:
Ⅰ.
 的制备:
的制备:(1)装置A中的仪器名称分别是
(2)反应开始前打开止水夹a,通入过量氮气的目的是
(3)装置D的作用是
(4)判断
 已被NO反应完全的现象是
已被NO反应完全的现象是Ⅱ.
(5)写出实验室制氨气的化学方程式
Ⅲ.测定的纯度(假设杂质不与反应):
(6)准确称取反应后的固体3.000g于烧杯中,加入蒸馏水溶解,配成250mL的溶液;取出25.00mL的溶液于锥形瓶中,滴入
 的酸性
的酸性 溶液至恰好完全反应,用去16mL的酸性
溶液至恰好完全反应,用去16mL的酸性 溶液。固体中
溶液。固体中 的纯度为
的纯度为
您最近半年使用:0次
6 . 利用废旧锂电池可回收金属元素。已知废旧锂离子电池的主要成分为 以及
以及 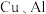 等单质,回收工艺流程如图:
等单质,回收工艺流程如图:
(1)“反萃取”中主要用到的玻璃仪器是_______(填字母)。
(2)“生化反应”后溶液中存在的主要阳离子有 、
、_______ 。“生化反应”最初使用的是 和
和  ,该过程中反应的
,该过程中反应的  与还原剂的物质的量之比为
与还原剂的物质的量之比为_______ ,使用细菌的优点是_______ 。
(3) 萃取率随温度变化如图所示,请解释变化的原因:
萃取率随温度变化如图所示,请解释变化的原因:_______ 。_______ 。
(5) (相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,加热到
(相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,加热到 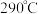 过程中,若生成两种气体,剩余固体的质量为
过程中,若生成两种气体,剩余固体的质量为 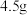 ,所得固体成分为
,所得固体成分为_______ (填化学式)。
(6)金属铜的晶胞如图所示,此晶胞的边长为 ,设
,设  为阿伏加德罗常数的值,则铜晶胞的密度ρ=
为阿伏加德罗常数的值,则铜晶胞的密度ρ=_______ g∙cm-3 (用含  的代数式表示)。
的代数式表示)。
 以及
以及 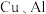 等单质,回收工艺流程如图:
等单质,回收工艺流程如图: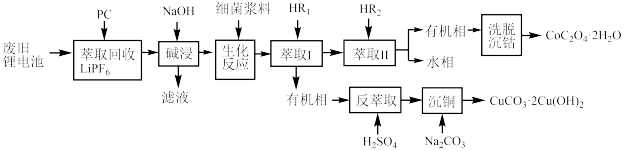
(1)“反萃取”中主要用到的玻璃仪器是_______(填字母)。
| A.漏斗 | B.胶头滴管 | C.分液漏斗 | D.蒸馏烧瓶 |
(2)“生化反应”后溶液中存在的主要阳离子有
 、
、 和
和  ,该过程中反应的
,该过程中反应的  与还原剂的物质的量之比为
与还原剂的物质的量之比为(3)
 萃取率随温度变化如图所示,请解释变化的原因:
萃取率随温度变化如图所示,请解释变化的原因: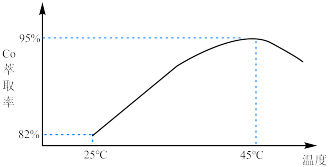
(5)
 (相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,加热到
(相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,加热到 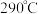 过程中,若生成两种气体,剩余固体的质量为
过程中,若生成两种气体,剩余固体的质量为 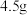 ,所得固体成分为
,所得固体成分为(6)金属铜的晶胞如图所示,此晶胞的边长为
 ,设
,设  为阿伏加德罗常数的值,则铜晶胞的密度ρ=
为阿伏加德罗常数的值,则铜晶胞的密度ρ= 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
7 . 在实验室可用Cl2和NH4Cl溶液反应制取NCl3,所用仪器如图所示(忽略部分夹持装置):
回答下列问题:
(1)盛装NH4Cl的仪器名称为___________ ;药品X可为___________ ;根据气流方向,各仪器的连接顺序为___________ (用各接口字母表示,各接口所需橡胶塞已省略)。
(2)待反应至油状液体不再增加,用止水夹夹住ab间的橡胶管,控制水浴加热的温度范围为___________ ,将产品NCl3蒸出。
(3) NCl3含量测定:NCl3可将HCl氧化为Cl2其化学反应方程式为___________ 。
(4)利用间接碘量法测定氯气的量即可测定NCl3的纯度。实验步骤如下:
ⅰ.准确称量C中的产物0.5g置于三颈烧瓶中,加入10mL足量浓盐酸,使用磁力搅拌器搅拌,并鼓入氮气;
ⅱ.将混合气通入200mL0.1 mol∙L-1KI溶液中,待试管中无色液体变成黄色且颜色不再变化,关闭氮气(溶液体积变化忽略不计);
ⅲ.量取20.00mL吸收液,加入淀粉指示剂,用0.1 mol∙L-1 Na2S2O3标准液进行滴定,滴定至终点时消耗Na2S2O3溶液18.00mL。(已知:反应原理为I2+2Na2S2O3=2NaI+Na2S4O6)
①确定滴定终点的现象为___________ 。
②NCl3的质量为___________ g。(精确到小数点后四位)。
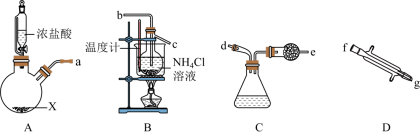
回答下列问题:
(1)盛装NH4Cl的仪器名称为
(2)待反应至油状液体不再增加,用止水夹夹住ab间的橡胶管,控制水浴加热的温度范围为
(3) NCl3含量测定:NCl3可将HCl氧化为Cl2其化学反应方程式为
(4)利用间接碘量法测定氯气的量即可测定NCl3的纯度。实验步骤如下:
ⅰ.准确称量C中的产物0.5g置于三颈烧瓶中,加入10mL足量浓盐酸,使用磁力搅拌器搅拌,并鼓入氮气;
ⅱ.将混合气通入200mL0.1 mol∙L-1KI溶液中,待试管中无色液体变成黄色且颜色不再变化,关闭氮气(溶液体积变化忽略不计);
ⅲ.量取20.00mL吸收液,加入淀粉指示剂,用0.1 mol∙L-1 Na2S2O3标准液进行滴定,滴定至终点时消耗Na2S2O3溶液18.00mL。(已知:反应原理为I2+2Na2S2O3=2NaI+Na2S4O6)
①确定滴定终点的现象为
②NCl3的质量为
您最近半年使用:0次
名校
8 . 乙苯是主要的有机化工产品。某课题组拟制备乙苯,其反应原理为: (已知:
(已知: 易升华,冷却易结块,易潮解)
易升华,冷却易结块,易潮解)
___________ 
___________ , 的作用是
的作用是___________ 。
(2)装置 为冷凝并收集
为冷凝并收集 。装置
。装置 、
、 存在的安全隐患为
存在的安全隐患为___________ 。
Ⅱ.制备乙苯
步骤1:连接装置并检查气密性(如图所示,夹持装置省略)。
步骤2:用酒精灯微热三颈烧瓶。
步骤3:向三颈烧瓶中加入 苯(过量)和
苯(过量)和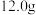 无水
无水 ,在搅拌下滴加
,在搅拌下滴加 溴乙烷,
溴乙烷, 下加热
下加热 。
。
步骤4:提纯产品。
(3)本实验宜采用的加热方式为___________ ,为了证明三颈烧瓶中已发生了上述反应,烧杯中的“ 溶液”可以是
溶液”可以是___________ (填字母序号)。
A. 溶液B.石蕊试液C.品红溶液D.
溶液B.石蕊试液C.品红溶液D. 溶液
溶液
(4)提纯产品的步骤有:①用大量水洗;②用稀盐酸洗除;③少量蒸馏水水洗;④加入大量无水氯化钙;⑤___________ ;(填操作名称,下同)⑥___________ ,并收集 时的产品。
时的产品。
(5)实验中收集到 乙苯,则乙苯的产率为
乙苯,则乙苯的产率为___________ 。
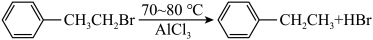
 (已知:
(已知: 易升华,冷却易结块,易潮解)
易升华,冷却易结块,易潮解)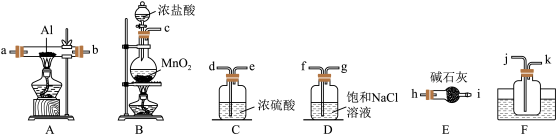


 的作用是
的作用是(2)装置
 为冷凝并收集
为冷凝并收集 。装置
。装置 、
、 存在的安全隐患为
存在的安全隐患为Ⅱ.制备乙苯
| 名称 | 分子量 | 沸点 | 密度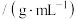 | 实验装置 |
| 苯 | 78 |  | 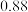 |
|
| 溴乙烷 | 109 |  |  | |
| 乙苯 | 106 | 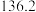 | 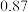 |
步骤2:用酒精灯微热三颈烧瓶。
步骤3:向三颈烧瓶中加入
 苯(过量)和
苯(过量)和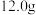 无水
无水 ,在搅拌下滴加
,在搅拌下滴加 溴乙烷,
溴乙烷,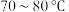 下加热
下加热 。
。步骤4:提纯产品。
(3)本实验宜采用的加热方式为
 溶液”可以是
溶液”可以是A.
 溶液B.石蕊试液C.品红溶液D.
溶液B.石蕊试液C.品红溶液D. 溶液
溶液(4)提纯产品的步骤有:①用大量水洗;②用稀盐酸洗除;③少量蒸馏水水洗;④加入大量无水氯化钙;⑤
 时的产品。
时的产品。(5)实验中收集到
 乙苯,则乙苯的产率为
乙苯,则乙苯的产率为
您最近半年使用:0次
解题方法
9 . 某同学欲利用如图装置制取能较长时间存在的 ,其中实验所用溶液现配现用且蒸馏水先加热煮沸。下列分析正确的是
,其中实验所用溶液现配现用且蒸馏水先加热煮沸。下列分析正确的是
 ,其中实验所用溶液现配现用且蒸馏水先加热煮沸。下列分析正确的是
,其中实验所用溶液现配现用且蒸馏水先加热煮沸。下列分析正确的是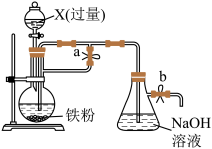
| A.X只能是稀硫酸 |
| B.实验开始时应先关闭止水夹a、打开止水夹b,再向烧瓶中加入X |
| C.反应一段时间后可在烧瓶中观察到白色沉淀 |
D.反应结束后若关闭b及分液漏斗活塞,则 可较长时间存在 可较长时间存在 |
您最近半年使用:0次
名校
解题方法
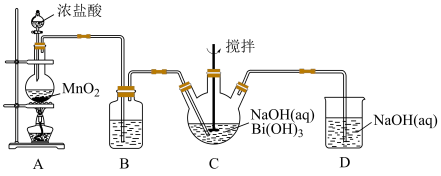
10 . 利用如图的装置制备NaBiO3(铋酸钠):
(1)A装置中反应的化学方程式:_______ 。
(2)B装置中试剂是_______ 。
(3)C装置中白色固体完全反应后立即停止通入氯气,其原因是_______ 。
(4)D装置中反应的离子方程式:_______ 。
(5)实验完毕后,为了提高产品纯度,需要的操作有_______ 、过滤、洗涤、干燥。
(6)写出装置C中发生反应的化学方程式:_______ 。
(7)探究NaBiO3的性质:
①在酸性条件下, 、NaBiO3、Cl2中氧化性最强的是
、NaBiO3、Cl2中氧化性最强的是_______ 。
②结合第(3)小题C装置中的反应,分析NaBO3和Cl2氧化性强弱不一致的主要原因是_______ 。
| 物质 | NaBiO3 | Bi(OH)3 |
| 性质 | 不溶于冷水、在酸性溶液中迅速分解;浅黄色 | 难溶于水、白色 |
(2)B装置中试剂是
(3)C装置中白色固体完全反应后立即停止通入氯气,其原因是
(4)D装置中反应的离子方程式:
(5)实验完毕后,为了提高产品纯度,需要的操作有
(6)写出装置C中发生反应的化学方程式:
(7)探究NaBiO3的性质:
| 实验 | 操作 | 现象 |
| Ⅰ | 取少量NaBiO3于试管中,加入浓盐酸,振荡;用镊子夹一块湿润的淀粉KI试纸放置在试管口上方 | 浅黄色固体溶解,产生黄绿色气体,试纸变蓝色 |
| Ⅱ | 在稀硫酸酸化的MnSO4溶液中加入NaBiO3粉末,振荡 | 无色溶液变紫红色溶液 |
 、NaBiO3、Cl2中氧化性最强的是
、NaBiO3、Cl2中氧化性最强的是②结合第(3)小题C装置中的反应,分析NaBO3和Cl2氧化性强弱不一致的主要原因是
您最近半年使用:0次