名校
1 . 已知:钴是一种中等活泼金属,常见化合价为+2价和+3价,CoCl2 易溶于水。南宁三中化学课外活动小组同学设计实验制取(CH3COO)2Co(乙酸钴)并验证其分解产物。请回答下列问题:
(1)甲同学用Co2O3与盐酸反应制备CoCl2,其实验装置如下:
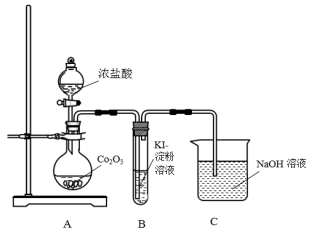
①盛装浓盐酸的仪器名称______ ;烧瓶中发生反应的化学方程式为______ 。
②由以上实验事实并结合已学知识分析,氧化性Co2O3______ MnO2 (填“大于”、“小于”或“无法判断”)。
(2)利用甲同学制得的CoCl2可进一步制得(CH3COO)2Co的结晶水合物。乙同学利用下列装置检验(CH3COO)2Co结晶水合物在氮气气氛中的分解产物。其中E、F、G中的试剂均足量。已知PdCl2溶液能被CO还原为Pd。
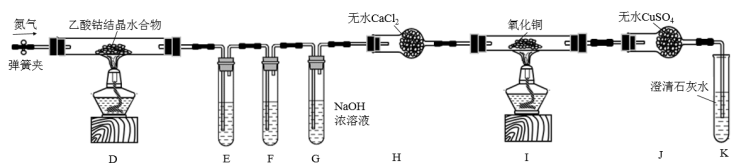
①装置E、F是用于检验分解产物中的CO和CO2,则E中所盛的溶液是______ 。
②经分析知分解产物还有C2H6,已知C2H6在较高温度下具有还原性,则上述实验中可确定有C2H6生成的现象是______ 。
③实验结束后,正确的操作是:______ 。(填字母)
a. 先熄灭D、I处的酒精灯再停止通N2 b. 先停止通N2再熄灭D、I处的酒精灯
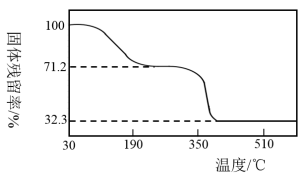
④另取一定量乙酸钴结晶水合物样品[Co(CH3COO)2·4H2O](M=249g/mol)隔绝空气加热,样品的固体残留率( ×100%)随温度的变化如图所示(样品在200℃时已完全失去结晶水,350℃以上残留固体为金属氧化物)。根据以上实验数据和实验事实写出200℃~350℃阶段分解的化学方程式:
×100%)随温度的变化如图所示(样品在200℃时已完全失去结晶水,350℃以上残留固体为金属氧化物)。根据以上实验数据和实验事实写出200℃~350℃阶段分解的化学方程式:______ 。
(1)甲同学用Co2O3与盐酸反应制备CoCl2,其实验装置如下:

①盛装浓盐酸的仪器名称
②由以上实验事实并结合已学知识分析,氧化性Co2O3
(2)利用甲同学制得的CoCl2可进一步制得(CH3COO)2Co的结晶水合物。乙同学利用下列装置检验(CH3COO)2Co结晶水合物在氮气气氛中的分解产物。其中E、F、G中的试剂均足量。已知PdCl2溶液能被CO还原为Pd。

①装置E、F是用于检验分解产物中的CO和CO2,则E中所盛的溶液是
②经分析知分解产物还有C2H6,已知C2H6在较高温度下具有还原性,则上述实验中可确定有C2H6生成的现象是
③实验结束后,正确的操作是:
a. 先熄灭D、I处的酒精灯再停止通N2 b. 先停止通N2再熄灭D、I处的酒精灯
④另取一定量乙酸钴结晶水合物样品[Co(CH3COO)2·4H2O](M=249g/mol)隔绝空气加热,样品的固体残留率(
 ×100%)随温度的变化如图所示(样品在200℃时已完全失去结晶水,350℃以上残留固体为金属氧化物)。根据以上实验数据和实验事实写出200℃~350℃阶段分解的化学方程式:
×100%)随温度的变化如图所示(样品在200℃时已完全失去结晶水,350℃以上残留固体为金属氧化物)。根据以上实验数据和实验事实写出200℃~350℃阶段分解的化学方程式:
您最近一年使用:0次
2021-01-30更新
|
211次组卷
|
2卷引用:广西南宁市普高联盟2022-2023学年高二下学期期末联考化学试题
名校
2 . 亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图所示(部分夹持装置略)。

已知:①NaNO2为白色固体,具有氧化性和还原性;
②室温下, ;
;
③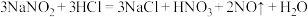 ;
;
④酸性条件下,NO或 都能与
都能与 反应生成
反应生成 和
和 。
。
回答下列问题:
(1)组装好仪器后,首先进行的操作是___________ ;装入药品后,需要先通入一段时间N2的目的是排除装置内的空气,防止NO被空气中的氧气氧化;实验结束后仍需通一段时间N2,其目的是___________ 。
(2)仪器a的名称为___________ 。
(3)写出装置A中发生的主要反应的化学方程式:___________ 。
(4)装置B中观察到的现象是___________ ,装置F的作用是___________ 。
(5)检验装置D产物中有亚硝酸钠的方法是___________ 。
(6)若将装置C中的碱石灰撤去,在装置D中收集的产物中,可能含有的副产物是___________ (填化学式)。
(7)工业制得的NaNO2产品中往往混有Na2CO3等杂质,现对产品的纯度进行测定,步骤如下:
①配制250mL溶液:称取固体产品4.000g,用新煮沸并冷却的蒸馏水在烧杯中溶解,完全溶解后,全部转移至___________ 中,加蒸馏水至刻度线。
②测定:取25.00mL溶液于锥形瓶中,用0.1000mol·L-1酸性KMnO4溶液进行测定(已知杂质不与酸性KMnO4溶液反应),实验数据如下表所示:
根据表中数据,计算所得固体中亚硝酸钠的质量分数为___________ %(保留4位有效数字)。

已知:①NaNO2为白色固体,具有氧化性和还原性;
②室温下,
 ;
;③
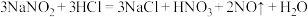 ;
;④酸性条件下,NO或
 都能与
都能与 反应生成
反应生成 和
和 。
。回答下列问题:
(1)组装好仪器后,首先进行的操作是
(2)仪器a的名称为
(3)写出装置A中发生的主要反应的化学方程式:
(4)装置B中观察到的现象是
(5)检验装置D产物中有亚硝酸钠的方法是
(6)若将装置C中的碱石灰撤去,在装置D中收集的产物中,可能含有的副产物是
(7)工业制得的NaNO2产品中往往混有Na2CO3等杂质,现对产品的纯度进行测定,步骤如下:
①配制250mL溶液:称取固体产品4.000g,用新煮沸并冷却的蒸馏水在烧杯中溶解,完全溶解后,全部转移至
②测定:取25.00mL溶液于锥形瓶中,用0.1000mol·L-1酸性KMnO4溶液进行测定(已知杂质不与酸性KMnO4溶液反应),实验数据如下表所示:
| 测定次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 消耗KMnO4溶液体积/mL | 20.98 | 21.02 | 21.00 | 21.60 |
您最近一年使用:0次
3 . 氯碱工业是化工产业的重要基础,其装置示意图如图。生产过程中产生的氯酸盐副产物需要处理。
已知:当pH升高时, 易歧化为
易歧化为 和
和 。
。

(1)电解饱和食盐水的离子方程式为_______ 。
(2)下列关于 产生的说法中,合理的是
产生的说法中,合理的是_______ (填序号)。
a. 主要在阴极室产生
主要在阴极室产生
b. 在电极上放电,可能产生
在电极上放电,可能产生
c.阳离子交换膜破损导致 向阳极室迁移,可能产生
向阳极室迁移,可能产生
(3)测定副产物 含量的方法如下图。
含量的方法如下图。

①加入 的目的是消耗水样中残留的
的目的是消耗水样中残留的 和
和 。若测定中未加入
。若测定中未加入 ,则水样中
,则水样中 的浓度将
的浓度将_______ (填“偏大”“偏小”或“不受影响”)。
②滴定至终点时消耗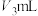 酸性
酸性 溶液,水样中
溶液,水样中 的计算式为
的计算式为_______ 。
(4)可用盐酸处理淡盐水中的 并回收
并回收 。
。
①反应的离子方程式为_______ 。
②处理 时,
时, 可能的作用是:
可能的作用是:
i.提高 ,使
,使 氧化性提高或
氧化性提高或 还原性提高;
还原性提高;
ii.提高 ,
,_______ 。
已知:当pH升高时,
 易歧化为
易歧化为 和
和 。
。
(1)电解饱和食盐水的离子方程式为
(2)下列关于
 产生的说法中,合理的是
产生的说法中,合理的是a.
 主要在阴极室产生
主要在阴极室产生b.
 在电极上放电,可能产生
在电极上放电,可能产生
c.阳离子交换膜破损导致
 向阳极室迁移,可能产生
向阳极室迁移,可能产生
(3)测定副产物
 含量的方法如下图。
含量的方法如下图。
①加入
 的目的是消耗水样中残留的
的目的是消耗水样中残留的 和
和 。若测定中未加入
。若测定中未加入 ,则水样中
,则水样中 的浓度将
的浓度将②滴定至终点时消耗
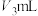 酸性
酸性 溶液,水样中
溶液,水样中 的计算式为
的计算式为(4)可用盐酸处理淡盐水中的
 并回收
并回收 。
。①反应的离子方程式为
②处理
 时,
时, 可能的作用是:
可能的作用是:i.提高
 ,使
,使 氧化性提高或
氧化性提高或 还原性提高;
还原性提高;ii.提高
 ,
,
您最近一年使用:0次
2023-01-20更新
|
503次组卷
|
2卷引用:北京市第二十中学2022-2023学年高二上学期期末考试化学试题
名校
4 . 高铁酸钾( )是一种新型绿色、高效的水处理剂,对病毒的去除率可达99.95%。某兴趣小组设计如下实验制备
)是一种新型绿色、高效的水处理剂,对病毒的去除率可达99.95%。某兴趣小组设计如下实验制备 并探究其性质。
并探究其性质。
已知:① 为紫色固体,微溶于
为紫色固体,微溶于 溶液;
溶液;
② 具有强氧化性,在酸性或中性溶液中能快速产生
具有强氧化性,在酸性或中性溶液中能快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。

(1)制备 (夹持装置略)
(夹持装置略)
①如图所示,装置A为氯气发生装置,橡胶管的作用是___________ 。
②装置B的作用是___________ 。
③装置C中的 溶液需过量,目的是
溶液需过量,目的是___________ 。
④C中得到紫色固体。则C中发生反应生成 和
和 的离子方程式为
的离子方程式为___________ 。
(2)探究 的性质甲同学取装置C中溶液,加入稀硫酸,产生黄绿色气体,经检验气体中含有
的性质甲同学取装置C中溶液,加入稀硫酸,产生黄绿色气体,经检验气体中含有 。该现象
。该现象___________ (填“能”或“不能”)证明“酸性条件下 氧化性强于
氧化性强于 ”,原因是
”,原因是___________ 。
(3) 在酸性条件下发生的离子反应为
在酸性条件下发生的离子反应为 (未配平),现取C中洗涤并干燥后的样品
(未配平),现取C中洗涤并干燥后的样品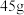 ,加入稀硫酸,收集到
,加入稀硫酸,收集到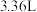 气体(标准状况下)。计算样品中高铁酸钾的质量分数为
气体(标准状况下)。计算样品中高铁酸钾的质量分数为___________ (写出计算过程,计算结果保留到0.1%)。
 )是一种新型绿色、高效的水处理剂,对病毒的去除率可达99.95%。某兴趣小组设计如下实验制备
)是一种新型绿色、高效的水处理剂,对病毒的去除率可达99.95%。某兴趣小组设计如下实验制备 并探究其性质。
并探究其性质。已知:①
 为紫色固体,微溶于
为紫色固体,微溶于 溶液;
溶液;②
 具有强氧化性,在酸性或中性溶液中能快速产生
具有强氧化性,在酸性或中性溶液中能快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
(1)制备
 (夹持装置略)
(夹持装置略)①如图所示,装置A为氯气发生装置,橡胶管的作用是
②装置B的作用是
③装置C中的
 溶液需过量,目的是
溶液需过量,目的是④C中得到紫色固体。则C中发生反应生成
 和
和 的离子方程式为
的离子方程式为(2)探究
 的性质甲同学取装置C中溶液,加入稀硫酸,产生黄绿色气体,经检验气体中含有
的性质甲同学取装置C中溶液,加入稀硫酸,产生黄绿色气体,经检验气体中含有 。该现象
。该现象 氧化性强于
氧化性强于 ”,原因是
”,原因是(3)
 在酸性条件下发生的离子反应为
在酸性条件下发生的离子反应为 (未配平),现取C中洗涤并干燥后的样品
(未配平),现取C中洗涤并干燥后的样品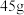 ,加入稀硫酸,收集到
,加入稀硫酸,收集到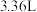 气体(标准状况下)。计算样品中高铁酸钾的质量分数为
气体(标准状况下)。计算样品中高铁酸钾的质量分数为
您最近一年使用:0次
5 . 过硫酸钠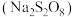 常用作漂白剂、氧化剂等。装研究小组利用如图所示装置制备
常用作漂白剂、氧化剂等。装研究小组利用如图所示装置制备 并探究其性质(加热及夹持仪器略去)。
并探究其性质(加热及夹持仪器略去)。
(一)制备
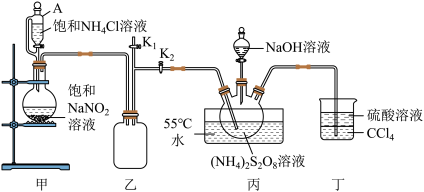
已知:①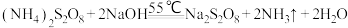 ;
;
② ;
;
③ 是白色晶状粉末,易溶于水,加热至
是白色晶状粉末,易溶于水,加热至 就会发生分解。
就会发生分解。
回答下列问题:
(1)装置丁的作用是_______ 。
(2)实验时需要将装置甲中反应产生的 持续通入装置丙中,目的是
持续通入装置丙中,目的是_______ 。
(3)反应完毕,将三颈烧瓶中的溶液减压蒸发、结晶过滤、洗涤干燥,可得过硫酸钠,减压蒸发的原因是_______ 。
(二)探究 的氧化性
的氧化性
(4)用 溶液与
溶液与 溶液反应,实验操作与现象如下表所示:
溶液反应,实验操作与现象如下表所示:
实验Ⅱ中 起催化作用,总反应分两步进行:
起催化作用,总反应分两步进行:
a. ;
;
b._______。
请你补充反应
_______ 。设计实验证明实验Ⅱ反应后的溶液中含有
_______ 。
(5)已知:酸性过硫酸钠溶液,在 催化作用下可以把
催化作用下可以把 氧化为
氧化为 ,该方法可用于检验
,该方法可用于检验 ,所得溶液除去
,所得溶液除去 后加入
后加入 溶液可以产生白色沉淀。在
溶液可以产生白色沉淀。在 催化作用下,用酸性
催化作用下,用酸性 溶液检验
溶液检验 时的实验现象为
时的实验现象为_______ ,该反应的离子方程式为_______ 。
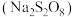 常用作漂白剂、氧化剂等。装研究小组利用如图所示装置制备
常用作漂白剂、氧化剂等。装研究小组利用如图所示装置制备 并探究其性质(加热及夹持仪器略去)。
并探究其性质(加热及夹持仪器略去)。(一)制备


已知:①
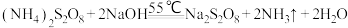 ;
;②
 ;
;③
 是白色晶状粉末,易溶于水,加热至
是白色晶状粉末,易溶于水,加热至 就会发生分解。
就会发生分解。回答下列问题:
(1)装置丁的作用是
(2)实验时需要将装置甲中反应产生的
 持续通入装置丙中,目的是
持续通入装置丙中,目的是(3)反应完毕,将三颈烧瓶中的溶液减压蒸发、结晶过滤、洗涤干燥,可得过硫酸钠,减压蒸发的原因是
(二)探究
 的氧化性
的氧化性(4)用
 溶液与
溶液与 溶液反应,实验操作与现象如下表所示:
溶液反应,实验操作与现象如下表所示:| 实验 | 操作 | 现象 |
| Ⅰ | 在 含淀粉的 含淀粉的 溶液中滴加 溶液中滴加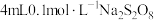 溶液 溶液 | 一段时间后,溶液缓慢变蓝色 |
| Ⅱ | 在 含淀粉的 含淀粉的 溶液中先滴几滴 溶液中先滴几滴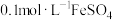 溶液,再滴加 溶液,再滴加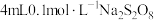 溶液 溶液 | 溶液迅速变蓝色 |
 起催化作用,总反应分两步进行:
起催化作用,总反应分两步进行:a.
 ;
;b._______。
请你补充反应


(5)已知:酸性过硫酸钠溶液,在
 催化作用下可以把
催化作用下可以把 氧化为
氧化为 ,该方法可用于检验
,该方法可用于检验 ,所得溶液除去
,所得溶液除去 后加入
后加入 溶液可以产生白色沉淀。在
溶液可以产生白色沉淀。在 催化作用下,用酸性
催化作用下,用酸性 溶液检验
溶液检验 时的实验现象为
时的实验现象为
您最近一年使用:0次
名校
解题方法
6 . 某小组同学在实验室制备高铁酸钾 ,并探究制备的适宜条件。制备
,并探究制备的适宜条件。制备 的实验装置如下(夹持装置略)。
的实验装置如下(夹持装置略)。

资料: 为紫色固体,微溶于
为紫色固体,微溶于 溶液。
溶液。
(1)装置A中产生 的化学方程式是
的化学方程式是_______ (锰元素被还原为 )。
)。
(2)研究试剂a对 产率的影响,对比实验如下。
产率的影响,对比实验如下。
注:上述实验中,溶液总体积、 和
和 的物质的量、
的物质的量、 的通入量均相同。
的通入量均相同。
①实验II、III产生 ,将方程式补充完整
,将方程式补充完整______ 。
还原反应: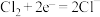 ;
;
氧化反应: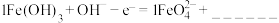 。
。
②对实验I未产生 而实验II能产生的原因提出假设:实验Ⅱ溶液碱性较强,增强+3价铁的还原性。以下实验证实了该假设。
而实验II能产生的原因提出假设:实验Ⅱ溶液碱性较强,增强+3价铁的还原性。以下实验证实了该假设。

步骤1:通入 ,电压表示数为
,电压表示数为 ;
;
步骤2:向右侧烧杯中加入_______ (填试剂),电压表示数为 。
。
③反思装置B的作用:用饱和 溶液除去
溶液除去 ,目的是
,目的是_______ 。
④实验II中 的产率比实验III低,试解释原因:
的产率比实验III低,试解释原因:_______ 。
(3)向实验II所得紫色溶液中继续通入 ,观察到溶液紫色变浅。可能原因是通入
,观察到溶液紫色变浅。可能原因是通入 后发生
后发生_______ (填离子方程式)而使溶液碱性减弱,进而导致 分解。
分解。
(4)综上,制备 的适宜条件是
的适宜条件是_______ 。
 ,并探究制备的适宜条件。制备
,并探究制备的适宜条件。制备 的实验装置如下(夹持装置略)。
的实验装置如下(夹持装置略)。
资料:
 为紫色固体,微溶于
为紫色固体,微溶于 溶液。
溶液。(1)装置A中产生
 的化学方程式是
的化学方程式是 )。
)。(2)研究试剂a对
 产率的影响,对比实验如下。
产率的影响,对比实验如下。| 实验编号 | 试剂a | 实验现象 |
| I |  和少量 和少量 | 无明显现象 |
| II |  和过量 和过量 | 得到紫色溶液,无紫色固体 |
| III | 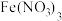 和过量 和过量 | 得到紫色溶液(颜色比II深),有紫色固体 |
 和
和 的物质的量、
的物质的量、 的通入量均相同。
的通入量均相同。①实验II、III产生
 ,将方程式补充完整
,将方程式补充完整还原反应:
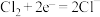 ;
;氧化反应:
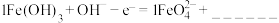 。
。②对实验I未产生
 而实验II能产生的原因提出假设:实验Ⅱ溶液碱性较强,增强+3价铁的还原性。以下实验证实了该假设。
而实验II能产生的原因提出假设:实验Ⅱ溶液碱性较强,增强+3价铁的还原性。以下实验证实了该假设。
步骤1:通入
 ,电压表示数为
,电压表示数为 ;
;步骤2:向右侧烧杯中加入
 。
。③反思装置B的作用:用饱和
 溶液除去
溶液除去 ,目的是
,目的是④实验II中
 的产率比实验III低,试解释原因:
的产率比实验III低,试解释原因:(3)向实验II所得紫色溶液中继续通入
 ,观察到溶液紫色变浅。可能原因是通入
,观察到溶液紫色变浅。可能原因是通入 后发生
后发生 分解。
分解。(4)综上,制备
 的适宜条件是
的适宜条件是
您最近一年使用:0次
2023-01-08更新
|
461次组卷
|
4卷引用: 北京市第一七一中学2023-2024学年高二上学期10月月考化学试题
北京市第一七一中学2023-2024学年高二上学期10月月考化学试题北京市朝阳区2022-2023学年高三上学期期末考试化学试题北京市第六十五中学2023-2024学年高三上学期期中达标测试化学试题(已下线)河南省湘豫名校联考2022-2023学年高三上学期12月期末摸底考试变式汇编(17-21)
名校
7 . 某化学兴趣小组查阅文献资料了解到湿法合成高铁酸钾(K2FeO4)是目前人工成本最低、产品纯度最高的合成方法,其合成路线如图:
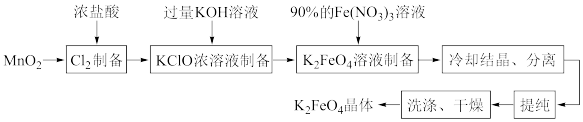
该兴趣小组根据文献资料设计了如图所示装置(部分夹持仪器已省略)制取K2FeO4。
已知:K2FeO4为紫色固体,具有强氧化性;在酸性或中性溶液中快速产生O2,在0℃~5℃、强碱性溶液中较稳定。
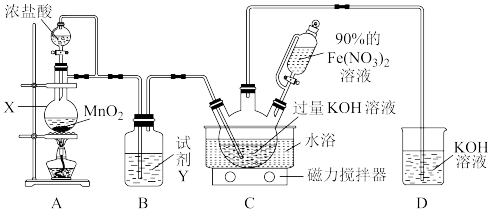
(1)仪器X的名称是_______ 。试剂Y的作用为_______ 。
(2)水浴方式是_______ (填“冷水浴”或“热水浴”)。
(3)装置C中KOH过量的原因是_______ 。
(4)上述流程中,“提纯”所用的方法是_______ 。
(5)称取1.98 g高铁酸钾样品,完全溶解于浓KOH溶液中,再加入足量亚铬酸钾{K[Cr(OH)4]}反应后配成100.00 mL溶液;取上述溶液20.00 mL于锥形瓶中,加入稀硫酸调至pH=2,并加入1 mL苯二胺磺酸钠作指示剂,用1.00 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定,消耗(NH4)2Fe(SO4)2溶液5.76 mL。测定过程中发生反应:
a. Cr(OH) +FeO
+FeO =Fe(OH)3+CrO
=Fe(OH)3+CrO +OH-
+OH-
b. 2CrO +2H+=Cr2O
+2H+=Cr2O +H2O
+H2O
c. Cr2O +6Fe2++14H+=2Cr3++6Fe3++7H2O
+6Fe2++14H+=2Cr3++6Fe3++7H2O
则K2FeO4样品的纯度是_______ 。
(6)K2FeO4是一种新型、高效、多功能水处理剂,既能杀菌消毒,又能净化水中悬浮杂质,请解释K2FeO4作为多功能水处理剂的原理:_______ 。
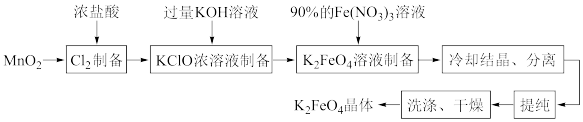
该兴趣小组根据文献资料设计了如图所示装置(部分夹持仪器已省略)制取K2FeO4。
已知:K2FeO4为紫色固体,具有强氧化性;在酸性或中性溶液中快速产生O2,在0℃~5℃、强碱性溶液中较稳定。

(1)仪器X的名称是
(2)水浴方式是
(3)装置C中KOH过量的原因是
(4)上述流程中,“提纯”所用的方法是
(5)称取1.98 g高铁酸钾样品,完全溶解于浓KOH溶液中,再加入足量亚铬酸钾{K[Cr(OH)4]}反应后配成100.00 mL溶液;取上述溶液20.00 mL于锥形瓶中,加入稀硫酸调至pH=2,并加入1 mL苯二胺磺酸钠作指示剂,用1.00 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定,消耗(NH4)2Fe(SO4)2溶液5.76 mL。测定过程中发生反应:
a. Cr(OH)
 +FeO
+FeO =Fe(OH)3+CrO
=Fe(OH)3+CrO +OH-
+OH-b. 2CrO
 +2H+=Cr2O
+2H+=Cr2O +H2O
+H2Oc. Cr2O
 +6Fe2++14H+=2Cr3++6Fe3++7H2O
+6Fe2++14H+=2Cr3++6Fe3++7H2O则K2FeO4样品的纯度是
(6)K2FeO4是一种新型、高效、多功能水处理剂,既能杀菌消毒,又能净化水中悬浮杂质,请解释K2FeO4作为多功能水处理剂的原理:
您最近一年使用:0次
2022-01-12更新
|
158次组卷
|
4卷引用:福建省泉州市永春第一中学2022-2023学年高二下学期6月期末考试化学试题
福建省泉州市永春第一中学2022-2023学年高二下学期6月期末考试化学试题(已下线)江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题变式题(工业流程题)(已下线)工业流程题吉林省长春吉大附中实验学校2021-2022学年高三上学期第三次摸底考试化学试题
名校
解题方法
8 . 二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
I、某化学兴趣小组为制备S2Cl2,模拟工业生产进行如下实验。利用熔化的硫与少量氯气在110~140℃反应制得S2Cl2粗品。

(1)装置连接顺序:___________
(2)实验前打开K1,通入一段时间的氮气排尽装置内的空气。实验结束停止加热后,再通入一段时间的氮气,其目的是___________
(3)D装置的名称是___________ ,所填充试剂是___________
(4)为了提高S2Cl2的纯度,实验的关键是控制好温度和___________
(5)S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式___________
II、某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数,设计了如图实验方案:

(6)该混合气体中气体X的体积分数为___________ (用含V、m的式子表示)。
| 物质 | 色态 | 熔点/℃ | 沸点/℃ | 其他性质 |
| S2Cl2 | 金黄色液体 | -122 | 138 | 遇水会发生水解,并放出腐蚀性烟气;300℃以上完全分解生成S和Cl2;能被Cl2氧化为SCl2;遇高热或与明火接触,有引起燃烧的危险 |

(1)装置连接顺序:
(2)实验前打开K1,通入一段时间的氮气排尽装置内的空气。实验结束停止加热后,再通入一段时间的氮气,其目的是
(3)D装置的名称是
(4)为了提高S2Cl2的纯度,实验的关键是控制好温度和
(5)S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式
II、某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数,设计了如图实验方案:

(6)该混合气体中气体X的体积分数为
您最近一年使用:0次
9 .  呈白色粉末状,是一种化工品,常用作腌制食品的防腐剂。某小组设计实验制备
呈白色粉末状,是一种化工品,常用作腌制食品的防腐剂。某小组设计实验制备 并探究其性质。
并探究其性质。
实验(一):制备
资料显示: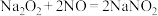 。
。 都能与酸性
都能与酸性 溶液反应。
溶液反应。
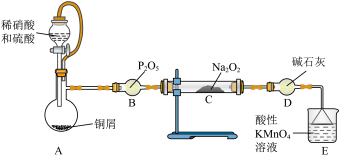
(1)D装置作用是___________ 。
(2)C装置中发生反应的现象是___________ 。
(3)已知: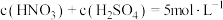 ,当
,当
___________ 时等体积混酸溶解铜的质量最大。
实验(二):测定产品纯度
称取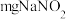 产品溶于蒸馏水配制成
产品溶于蒸馏水配制成 溶液,准确量取
溶液,准确量取 配制的溶液于锥形瓶,加入适量稀硫酸,用
配制的溶液于锥形瓶,加入适量稀硫酸,用 标准溶液滴定至终点,消耗滴定液
标准溶液滴定至终点,消耗滴定液 。
。
(4)该产品纯度为___________ (用含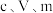 的代数式表示),若滴定前仰视读数,终点时俯视读数,测得结果
的代数式表示),若滴定前仰视读数,终点时俯视读数,测得结果___________ (填“偏高”“偏低”或“无影响”)。
实检(三):探究影响 水解程度的外界因素
水解程度的外界因素
为了探究外界条件对 水解程度的影响,设计如下实验:
水解程度的影响,设计如下实验:
(5)
___________ 。设计实验Ⅰ、Ⅱ的目的是___________ 。
(6)根据相关原理,小组预测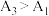 ,实验测得结果:
,实验测得结果: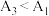 。理论预测和实验结果矛盾,其原因可能是
。理论预测和实验结果矛盾,其原因可能是___________ 。
 呈白色粉末状,是一种化工品,常用作腌制食品的防腐剂。某小组设计实验制备
呈白色粉末状,是一种化工品,常用作腌制食品的防腐剂。某小组设计实验制备 并探究其性质。
并探究其性质。实验(一):制备

资料显示:
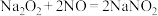 。
。 都能与酸性
都能与酸性 溶液反应。
溶液反应。
(1)D装置作用是
(2)C装置中发生反应的现象是
(3)已知:
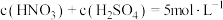 ,当
,当
实验(二):测定产品纯度
称取
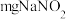 产品溶于蒸馏水配制成
产品溶于蒸馏水配制成 溶液,准确量取
溶液,准确量取 配制的溶液于锥形瓶,加入适量稀硫酸,用
配制的溶液于锥形瓶,加入适量稀硫酸,用 标准溶液滴定至终点,消耗滴定液
标准溶液滴定至终点,消耗滴定液 。
。(4)该产品纯度为
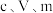 的代数式表示),若滴定前仰视读数,终点时俯视读数,测得结果
的代数式表示),若滴定前仰视读数,终点时俯视读数,测得结果实检(三):探究影响
 水解程度的外界因素
水解程度的外界因素为了探究外界条件对
 水解程度的影响,设计如下实验:
水解程度的影响,设计如下实验:| 原号 | 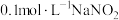 溶液 溶液 | 蒸馏水 | 水浴温度 | 溶液 |
| Ⅰ |  | 0 |  |  |
| Ⅱ |  |  |  |  |
| Ⅲ |  | 0 | 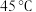 |  |
(5)

(6)根据相关原理,小组预测
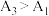 ,实验测得结果:
,实验测得结果: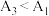 。理论预测和实验结果矛盾,其原因可能是
。理论预测和实验结果矛盾,其原因可能是
您最近一年使用:0次
名校
解题方法
10 . 平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵晶体:
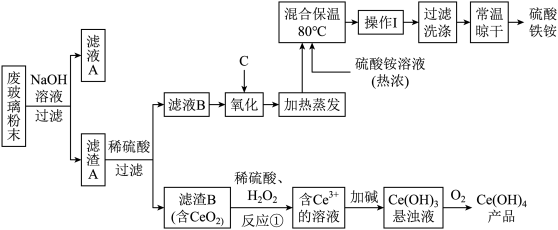
ⅰ.酸性条件下,铈在水溶液中有 、
、 两种主要存在形式,
两种主要存在形式, 易水解,
易水解, 有较强氧化性。
有较强氧化性。
ⅱ.CeO2不溶于稀硫酸
ⅲ.硫酸铁铵晶体广泛用于水的净化处理。
(1)在氧化环节,下列物质中最适合用作氧化剂C的是_____________。
(2)操作Ⅰ的名称是_____ ,检验硫酸铁铵溶液中含有 的方法是:
的方法是:_______________ 。
(3)反应①之前先要洗涤滤渣B,其目的是为了除去______ (填离子符号);反应①的离子方程式为___________________________________________ 。
(4)用滴定法测定制得的Ce(OH)4产品纯度:

滴定时所用定量仪器的最小刻度为________ ;所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数_________ 。(填“偏大”、“偏小”或“无影响”)
(5)称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应。则该硫酸铁铵的化学式为___________ 。

ⅰ.酸性条件下,铈在水溶液中有
 、
、 两种主要存在形式,
两种主要存在形式, 易水解,
易水解, 有较强氧化性。
有较强氧化性。ⅱ.CeO2不溶于稀硫酸
ⅲ.硫酸铁铵晶体广泛用于水的净化处理。
(1)在氧化环节,下列物质中最适合用作氧化剂C的是_____________。
| A.NaClO | B.H2O2 | C.KMnO4 | D.浓硫酸 |
(2)操作Ⅰ的名称是
 的方法是:
的方法是:(3)反应①之前先要洗涤滤渣B,其目的是为了除去
(4)用滴定法测定制得的Ce(OH)4产品纯度:

滴定时所用定量仪器的最小刻度为
(5)称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应。则该硫酸铁铵的化学式为
您最近一年使用:0次
2016-12-09更新
|
168次组卷
|
2卷引用: 北京市第一六一中学2023-2024学年高二上学期12月份月考化学试卷



