广西南宁市第三中学2020-2021学年高二上学期期末考试化学(理)试题
广西
高二
期末
2021-02-24
775次
整体难度:
适中
考查范围:
化学反应原理、有机化学基础、化学与STSE、认识化学科学、常见无机物及其应用、化学实验基础
广西南宁市第三中学2020-2021学年高二上学期期末考试化学(理)试题
广西
高二
期末
2021-02-24
775次
整体难度:
适中
考查范围:
化学反应原理、有机化学基础、化学与STSE、认识化学科学、常见无机物及其应用、化学实验基础
一、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
解题方法
1. 下列说法正确的是
| A.石油是一种可再生的清洁能源 |
| B.“一带一路”被誉为现代丝绸之路,丝绸属于纤维素 |
| C.“煮豆燃豆萁”中涉及的能量变化只有化学能转化为热能 |
| D.葡萄中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
2. 下列化学用语表示正确的是
A.CaO2的电子式: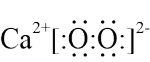 | B.N2H4的结构式: |
| C.氯化钠的分子式:NaCl | D.CO2的球棍模型: |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
3. NA为阿伏加德罗常数的值,下列说法中正确的是
| A.11.2 L CH3Cl 中含有的C-Cl键的个数为0.5NA |
| B.2.0 g H218O与D2O的混合物中所含中子数为NA |
| C.0.1 mol Fe在足量氯气中充分燃烧,转移电子数为0.2NA |
| D.密闭容器中,2 mol NO(g)与1 mol O2(g)充分反应,产物的分子数为2NA |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
4. 下列离子方程式书写正确的是
A.制硅酸胶体:SiO + 2H+ = H2SiO3↓ + 2H+ = H2SiO3↓ |
B.漂白粉的漂白原理:2ClO- + CO2 + H2O = 2HClO + CO |
C.饱和碳酸氢钠溶液除去CO2中的HCl:HCO + H+ = CO2↑+ H2O + H+ = CO2↑+ H2O |
D.吸收铜与浓硝酸反应后的尾气:NO2 + 2OH- = NO + H2O + H2O |
【知识点】 离子方程式的正误判断解读
您最近一年使用:0次
单选题
|
适中(0.65)
名校
5. 下列物质的转化在给定条件下能实现的是
A.S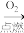 SO3 SO3 H2SO4 H2SO4 |
B.Fe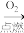 Fe2O3 Fe2O3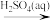 Fe2(SO4)3 Fe2(SO4)3 |
C.Al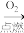 Al2O3 Al2O3 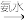 NaAlO2 NaAlO2 |
D.N2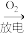 NO NO NO2 NO2  HNO3 HNO3 |
【知识点】 物质的转化
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
6. 下列实验不能达到相应实验目的的是
| 操作及现象 | 实验目的 | |
| A | 向5 mL 0.005 mol/L FeCl3溶液中加入5 mL 0.1mol/L KSCN溶液,充分反应后,再滴加4滴饱和FeCl3溶液,充分振荡,溶液红色加深 | 探究浓度对平衡移动的影响 |
| B | 分别向装有2 mL 0.1 mol/L H2C2O4溶液和2 mL 0.2 mol/L H2C2O4溶液的两支试管中加入4 mL 0.01mol/L酸性KMnO4溶液,振荡,后者溶液先褪色 | 探究浓度对反应速率的影响 |
| C | 将研细后的20 g Ba(OH)2·8H2O晶体与10 g NH4Cl晶体一起放入烧杯中,用玻璃棒快速搅拌,闻到刺激性气味的气体,烧杯壁温度下降 | 证明Ba(OH)2·8H2O晶体与NH4Cl晶体的反应是吸热反应 |
| D | 将50 mL 0.55 mol/L 的烧碱溶液分多次加入到盛有50 mL 0.5 mol/L 盐酸的量热计中,温度计示数由T1升高至T2 | 测定并计算中和热 |
| A.A | B.B | C.C | D.D |
【知识点】 测定某些反应的反应速率解读
您最近一年使用:0次
2021-01-30更新
|
219次组卷
|
2卷引用:广西南宁市第三中学2020-2021学年高二上学期期末考试化学(理)试题
单选题
|
适中(0.65)
名校
解题方法
7. 可逆反应2A(g)+B(g) 2C(g),ΔH<0,P2>P1判断下列图像错误的是
2C(g),ΔH<0,P2>P1判断下列图像错误的是
 2C(g),ΔH<0,P2>P1判断下列图像错误的是
2C(g),ΔH<0,P2>P1判断下列图像错误的是A.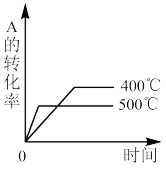 | B.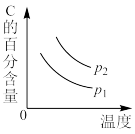 |
C.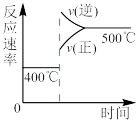 | D.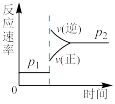 |
您最近一年使用:0次
2020-12-14更新
|
763次组卷
|
10卷引用:贵州省铜仁市伟才学校2020-2021学年高二上学期第三次半月考化学试题
贵州省铜仁市伟才学校2020-2021学年高二上学期第三次半月考化学试题甘肃省兰州市第一中学2020-2021学年高二上学期期末考试化学试题广西南宁市第三中学2020-2021学年高二上学期期末考试化学(理)试题新疆乌苏市第一中学2020-2021学年高二下学期入学检测化学(1-3班)试题河南省重点高中2021-2022学年高二下学期阶段性调研联考一化学试题新疆乌苏市第一中学2021-2022学年高二下学期开学考试化学试题浙江省舟山市舟山中学2021-2022学年高一下学期阶段性检测化学试题天津市第二十一中学2022-2023学年高二上学期期中调研化学试题 黑龙江省大庆市大庆中学2022-2023学年高二下学期开学考试化学试题天津市实验中学滨海学校2023-2024学年高二上学期期中质量调查化学试题
单选题
|
适中(0.65)
8. 已知NO2与N2O4可相互转化:2NO2(g)⇌N2O4(g) ΔH=-24.2 kJ/mol,在恒温下,将一定量NO2和N2O4的混合气体充入体积为2 L的密闭容器中,其中物质的量浓度随时间变化的关系如图所示。下列推理分析不合理的是


| A.b点所在的曲线代表NO2 |
| B.b、d两点均有v(正)=v(逆) |
| C.25 min时改变的条件可能是升高温度 |
| D.25 min时,正反应速率增大 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
9. 工业合成氨的反应原理为:N2(g) + 3H2(g)⇌2NH3(g) ΔH=-Q kJ/mol。下列说法正确的是
| A.工业上一般充入较多的氢气,以提高氢气的转化率 |
| B.合成氨的反应是放热反应,所以工业上选择反应温度越低越好 |
| C.若键能E(N≡N)=a kJ/mol,E(H-H)=b kJ/mol,E(H-N)=c kJ/mol,则Q=6c-a-3b |
| D.已知标况下44.8 L氢气燃烧生成水蒸气放热为571.6 kJ,则氢气燃烧热的热化学方程式可表示为2H2(g) + O2(g) = 2H2O(l) ΔH=-571.6 kJ/mol |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
10. 下列说法错误的是
A.聚碳酸酯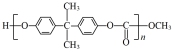 可通过缩聚反应制得 可通过缩聚反应制得 |
B.合成高聚物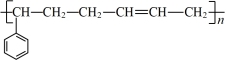 的单体一共有三种 的单体一共有三种 |
C.已知: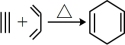 ,则合成 ,则合成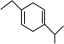 的原料可以是1-丁炔和2-异丙基-1,3-丁二烯 的原料可以是1-丁炔和2-异丙基-1,3-丁二烯 |
D.某中性有机物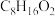 在稀硫酸的作用下加热得到X和Y两种有机物,Y经氧化可最终得到X,则Y的结构有2种 在稀硫酸的作用下加热得到X和Y两种有机物,Y经氧化可最终得到X,则Y的结构有2种 |
您最近一年使用:0次
2021-01-30更新
|
324次组卷
|
2卷引用:广西南宁市第三中学2020-2021学年高二上学期期末考试化学(理)试题
单选题
|
适中(0.65)
名校
解题方法
11. 一种兴奋剂的结构如图,关于它的说法中正确的是
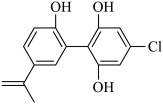

| A.该物质的分子式为C15H13ClO3 |
| B.1 mol该物质与溴水反应,最多消耗5 mol Br2 |
| C.该分子中最多有12个碳原子共平面 |
| D.该物质在一定条件下可发生取代反应、消去反应和加成反应 |
您最近一年使用:0次
2021-01-30更新
|
599次组卷
|
8卷引用:广西南宁市第三中学2020-2021学年高二上学期期末考试化学(理)试题
广西南宁市第三中学2020-2021学年高二上学期期末考试化学(理)试题(已下线)专题五 醇 酚-2020-2021学年高二《新题速递·化学》(人教版2019选择性必修3)3月刊 (同步课堂必刷题)(已下线)专题四 醇 酚-2020-2021学年高二《新题速递·化学》(人教版选修5)3月刊 (同步课堂必刷题)(已下线)3.1 醇和酚(B级能力练)-2020-2021学年高二化学章节分层检测ABC(人教版选修5)(已下线)3.2 醇 酚(B级能力练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修3)广西南宁市第十中学2020-2021学年高二下学期3月月考化学试题(已下线)第14讲 酚(word讲义)-【帮课堂】2021-2022学年高二化学同步精品讲义(人教2019选择性必修3)(已下线)烃的衍生物——课时3酚
单选题
|
较难(0.4)
名校
解题方法
12. 化合物乙可由化合物甲经多步反应得到。下列有关化合物甲、乙的说法正确的是
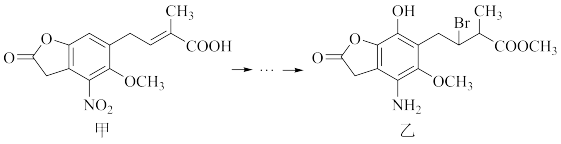

| A.甲分子极易溶于水 |
| B.乙中含有2个手性碳原子 |
| C.用NaHCO3溶液或FeCl3溶液不能鉴别化合物甲、乙 |
| D.乙能与盐酸、NaOH溶液反应,且1 mol乙最多能与4 mol NaOH反应 |
您最近一年使用:0次
2021-01-30更新
|
787次组卷
|
6卷引用:广西南宁市第三中学2020-2021学年高二上学期期末考试化学(理)试题
广西南宁市第三中学2020-2021学年高二上学期期末考试化学(理)试题(已下线)专题七 羧酸 羧酸衍生物-2020-2021学年高二《新题速递·化学》(人教版2019选择性必修3)3月刊 (同步课堂必刷题)(已下线)3.3 羧酸 酯(B级能力练)-2020-2021学年高二化学章节分层检测ABC(人教版选修5)(已下线)专题六 羧酸和酯-2020-2021学年高二《新题速递·化学》(人教版选修5)3月刊 (同步课堂必刷题)(已下线)3.4 羧酸 羧酸衍生物(B级能力练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修3)安徽省怀宁中学2021-2022学年高二下学期5月阶段考试化学试题
单选题
|
较难(0.4)
名校
解题方法
13. 在恒容密闭容器中充入1 mol A(g)和2 mol B(g),发生如下反应:A(g) + B(g)⇌C(g) + D(g) ΔH>0。如图所示为该反应正反应的平衡常数K正和逆反应的平衡常数K逆随温度变化的曲线。下列分析正确的是
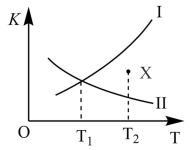

| A.曲线Ⅰ为K逆,曲线Ⅱ为K正 |
| B.T2时,X点v正>v逆 |
| C.T1时,A的平衡转化率为50% |
| D.若B、C、D都是固体,其他条件不变,则平衡后再充入1 mol A(g),再次平衡后,A的浓度比原平衡时大 |
【知识点】 化学平衡题中基于图表数据的相关计算解读
您最近一年使用:0次
2021-01-30更新
|
378次组卷
|
3卷引用:广西南宁市第三中学2020-2021学年高二上学期期末考试化学(理)试题
14. 我国有较多的科研人员在研究甲醛的氧化,有人提出HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程示意图如图(图中只画出了HAP的部分结构)。
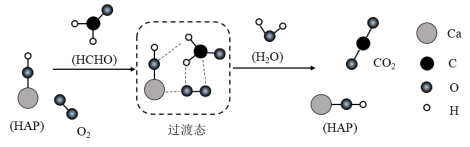
下列说法正确的是

下列说法正确的是
| A.该过程中只有非极性键断裂 |
| B.HCHO在反应过程中有C=O键发生断裂 |
| C.根据图示信息,CO2分子中的氧原子全部来自O2 |
| D.HAP能降低HCHO与O2反应的活化能,但不改变焓变 |
您最近一年使用:0次
单选题
|
较易(0.85)
名校
解题方法
15. 甲烷与氯气在光照条件下取代反应的部分反应历程和能量变化如下:
链引发:Cl2(g) → 2Cl·(g) ΔH1=+242.7 kJ/mol
链增长
①:CH4(g) + Cl·(g) → CH3·(g) + HCl(g) ΔH2=+7.5 kJ/mol
②:CH3·(g) + Cl2(g) → CH3Cl(g) + Cl·(g) ΔH3=-129 kJ/mol
……
链终止:Cl·(g) + CH3·(g) → CH3Cl(g) ΔH4=-371.7 kJ/mol
(其中CH3·表示甲基,Cl·表示氯原子)下列说法错误的是
链引发:Cl2(g) → 2Cl·(g) ΔH1=+242.7 kJ/mol
链增长
①:CH4(g) + Cl·(g) → CH3·(g) + HCl(g) ΔH2=+7.5 kJ/mol
②:CH3·(g) + Cl2(g) → CH3Cl(g) + Cl·(g) ΔH3=-129 kJ/mol
……
链终止:Cl·(g) + CH3·(g) → CH3Cl(g) ΔH4=-371.7 kJ/mol
(其中CH3·表示甲基,Cl·表示氯原子)下列说法错误的是
| A.在链终止的过程中,还可能会生成少量的乙烷 |
| B.CH3Cl(g)中C-Cl键的键能小于Cl2(g)中Cl-Cl键的键能 |
| C.CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g) ΔH=-121.5 kJ/mol |
| D.若是CH4与Br2(g)发生取代反应,则链增长①反应的ΔH>+7.5 kJ/mol |
【知识点】 反应焓变与热化学方程式的关系解读
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
16. CO2催化重整CH4的反应:(I)CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ΔH1
主要副反应:(II)H2(g)+CO2(g)⇌CO(g)+H2O(g) ΔH2>0
(III)4H2(g)+CO2(g)⇌CH4(g)+2H2O(g) ΔH3<0。
在恒容反应器中按体积分数V(CH4)∶V(CO2)=50%∶50%充入气体,加入催化剂,测得反应器中平衡时各物质的体积分数与温度的关系如图所示。下列说法错误的是
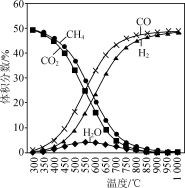
主要副反应:(II)H2(g)+CO2(g)⇌CO(g)+H2O(g) ΔH2>0
(III)4H2(g)+CO2(g)⇌CH4(g)+2H2O(g) ΔH3<0。
在恒容反应器中按体积分数V(CH4)∶V(CO2)=50%∶50%充入气体,加入催化剂,测得反应器中平衡时各物质的体积分数与温度的关系如图所示。下列说法错误的是

| A.ΔH1>0 |
| B.其它条件不变,适当增大起始时V(CH4)∶V(CO2),可抑制副反应(Ⅱ)、(Ⅲ)的进行 |
| C.300~580℃时,H2O的体积分数不断增大,是由于反应(Ⅲ)生成H2O的量大于反应(Ⅱ)消耗的量 |
| D.T℃时,在2.0 L容器中加入2 mol CH4、2 mol CO2以及催化剂进行重整反应,测得CO2的平衡转化率为75%,则反应(I)的平衡常数小于81 |
【知识点】 化学平衡图像分析 化学平衡常数的有关计算解读
您最近一年使用:0次
二、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
名校
17. 已知:钴是一种中等活泼金属,常见化合价为+2价和+3价,CoCl2 易溶于水。南宁三中化学课外活动小组同学设计实验制取(CH3COO)2Co(乙酸钴)并验证其分解产物。请回答下列问题:
(1)甲同学用Co2O3与盐酸反应制备CoCl2,其实验装置如下:
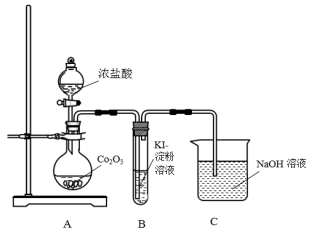
①盛装浓盐酸的仪器名称______ ;烧瓶中发生反应的化学方程式为______ 。
②由以上实验事实并结合已学知识分析,氧化性Co2O3______ MnO2 (填“大于”、“小于”或“无法判断”)。
(2)利用甲同学制得的CoCl2可进一步制得(CH3COO)2Co的结晶水合物。乙同学利用下列装置检验(CH3COO)2Co结晶水合物在氮气气氛中的分解产物。其中E、F、G中的试剂均足量。已知PdCl2溶液能被CO还原为Pd。
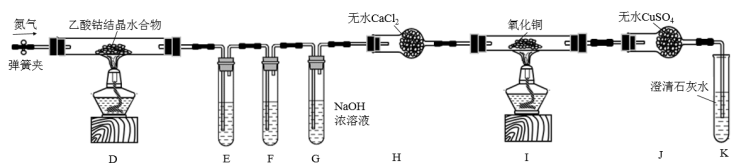
①装置E、F是用于检验分解产物中的CO和CO2,则E中所盛的溶液是______ 。
②经分析知分解产物还有C2H6,已知C2H6在较高温度下具有还原性,则上述实验中可确定有C2H6生成的现象是______ 。
③实验结束后,正确的操作是:______ 。(填字母)
a. 先熄灭D、I处的酒精灯再停止通N2 b. 先停止通N2再熄灭D、I处的酒精灯
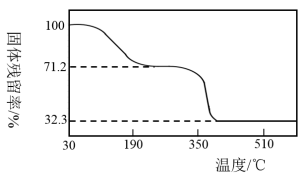
④另取一定量乙酸钴结晶水合物样品[Co(CH3COO)2·4H2O](M=249g/mol)隔绝空气加热,样品的固体残留率( ×100%)随温度的变化如图所示(样品在200℃时已完全失去结晶水,350℃以上残留固体为金属氧化物)。根据以上实验数据和实验事实写出200℃~350℃阶段分解的化学方程式:
×100%)随温度的变化如图所示(样品在200℃时已完全失去结晶水,350℃以上残留固体为金属氧化物)。根据以上实验数据和实验事实写出200℃~350℃阶段分解的化学方程式:______ 。
(1)甲同学用Co2O3与盐酸反应制备CoCl2,其实验装置如下:

①盛装浓盐酸的仪器名称
②由以上实验事实并结合已学知识分析,氧化性Co2O3
(2)利用甲同学制得的CoCl2可进一步制得(CH3COO)2Co的结晶水合物。乙同学利用下列装置检验(CH3COO)2Co结晶水合物在氮气气氛中的分解产物。其中E、F、G中的试剂均足量。已知PdCl2溶液能被CO还原为Pd。

①装置E、F是用于检验分解产物中的CO和CO2,则E中所盛的溶液是
②经分析知分解产物还有C2H6,已知C2H6在较高温度下具有还原性,则上述实验中可确定有C2H6生成的现象是
③实验结束后,正确的操作是:
a. 先熄灭D、I处的酒精灯再停止通N2 b. 先停止通N2再熄灭D、I处的酒精灯
④另取一定量乙酸钴结晶水合物样品[Co(CH3COO)2·4H2O](M=249g/mol)隔绝空气加热,样品的固体残留率(
 ×100%)随温度的变化如图所示(样品在200℃时已完全失去结晶水,350℃以上残留固体为金属氧化物)。根据以上实验数据和实验事实写出200℃~350℃阶段分解的化学方程式:
×100%)随温度的变化如图所示(样品在200℃时已完全失去结晶水,350℃以上残留固体为金属氧化物)。根据以上实验数据和实验事实写出200℃~350℃阶段分解的化学方程式:
您最近一年使用:0次
2021-01-30更新
|
217次组卷
|
2卷引用:广西南宁市第三中学2020-2021学年高二上学期期末考试化学(理)试题
解答题-工业流程题
|
较难(0.4)
名校
解题方法
18. 重铬酸钾(K2Cr2O7)在皮革、火柴、印染化学、电镀等方面应用广泛。回答下列问题:
(1)酒驾严重危害社会安全,早期用重铬酸钾测定是否饮酒。橙红色的重铬酸钾具有强氧化性,遇到有机物如乙醇会激烈反应,本身被还原成绿色的Cr3+,乙醇被氧化成乙酸。请写出用酸性重铬酸钾检验酒驾的离子方程式______ 。
(2)用铬铁矿(FeO·Cr2O3,含Al2O3杂质)为原料制备重铬酸钾的工艺流程如下:
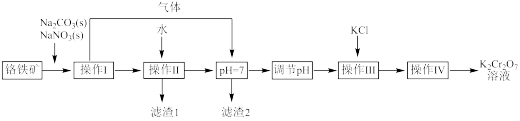
已知:
i.上述工艺流程图中的操作I的主要反应为:
2FeO·Cr2O3+4Na2CO3+7NaNO3 4Na2CrO4+Fe2O3+4CO2↑+7NaNO2
4Na2CrO4+Fe2O3+4CO2↑+7NaNO2
Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
ⅱ.有关物质的溶解度曲线如图:

①写出生成滤渣2的离子方程式______ 。
②工艺流程图中,操作“调节pH”的作用是______ 。
③操作Ⅲ,在Na2Cr2O7溶液中加入固体KCl进行复分解反应即可制得橙色的K2Cr2O7,请分析此反应能发生的原因______ ;实验室中,操作IV用到的玻璃仪器有酒精灯、烧杯、______ 。
(1)酒驾严重危害社会安全,早期用重铬酸钾测定是否饮酒。橙红色的重铬酸钾具有强氧化性,遇到有机物如乙醇会激烈反应,本身被还原成绿色的Cr3+,乙醇被氧化成乙酸。请写出用酸性重铬酸钾检验酒驾的离子方程式
(2)用铬铁矿(FeO·Cr2O3,含Al2O3杂质)为原料制备重铬酸钾的工艺流程如下:

已知:
i.上述工艺流程图中的操作I的主要反应为:
2FeO·Cr2O3+4Na2CO3+7NaNO3
 4Na2CrO4+Fe2O3+4CO2↑+7NaNO2
4Na2CrO4+Fe2O3+4CO2↑+7NaNO2Al2O3+Na2CO3
 2NaAlO2+CO2↑
2NaAlO2+CO2↑ⅱ.有关物质的溶解度曲线如图:

①写出生成滤渣2的离子方程式
②工艺流程图中,操作“调节pH”的作用是
③操作Ⅲ,在Na2Cr2O7溶液中加入固体KCl进行复分解反应即可制得橙色的K2Cr2O7,请分析此反应能发生的原因
【知识点】 几种铁的氧化物的化学性质解读
您最近一年使用:0次
19. I.汽车尾气中的NO(g)和CO(g)在一定条件下可发生反应生成无毒的N2和CO2。
(1)已知:①N2(g)+O2(g)⇌2NO(g) ΔH1= +180.5 kJ·mol-1,
②CO的燃烧热ΔH2=-283.0 kJ·mol-l,
则反应③2NO(g)+2CO(g)⇌N2(g)+2CO2(g) ΔH3=______ 。
(2)南宁三中化学研究小组在三个容积为5 L的恒容密闭容器中,分别充入0.4 mol NO和0.4 mol CO,发生反应③。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示:
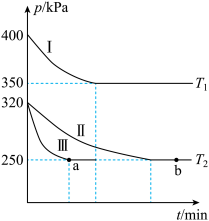
①温度:T1______ T2(填“<”“=”或“>”)。
②CO的平衡转化率:Ⅰ______ Ⅱ______ Ⅲ(填“<”“=”或“>”)。
③T2时的平衡常数K=______ 。(列出计算式)
Ⅱ.氧化亚氮(N2O)是一种强温室气体,且易转换成颗粒污染物。研究氧化亚氮分解对环境保护有重要意义。
(1)在一定温度下的恒容容器中,反应2N2O(g)⇌2N2(g)+O2(g)的部分实验数据如下:
①在0~20 min,反应速率v(O2)为______ mol·L-1·min-1。
②若N2O起始浓度c0为0.150 mol·L-1,则反应至30 min时N2O的转化率α=______ 。
③该反应达到平衡的标志有______
a.混合气体的密度保持不变
b.混合气体的平均摩尔质量保持不变
c.v正(N2O):v逆(O2) = 2:1
d.c(N2O):c(N2):c(O2) = 2:2:1
e.单位时间内有1 mol O=O键断裂同时有2 mol N≡N形成
(2)碘蒸气的存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)⇌2I(g) (快速平衡,平衡常数为K)
第二步I(g)+N2O(g)⇌N2(g)+IO(g) (慢反应,v=k1·c(N2O)·c(I),k1为速率常数)
第三步IO(g)+N2O(g)⇌N2(g)+O2(g)+I(g) (快反应)
①其中可近似认为第二步反应不影响第一步的平衡。实验表明,含碘时N2O分解速率方程v=k2·c(N2O)·[c(I2)]0.5(k2为速率常数)。下列表述正确的是______ (填标号)。
a.第一步对总反应速率起决定作用
b.第二步活化能比第三步大
c.I2浓度与N2O分解速率无关
d.催化剂会降低反应的活化能,从而影响△H
②若第二步反应的速率等于N2O分解的总反应速率,则k2=______ (用含K和k1的代数式表示)
(1)已知:①N2(g)+O2(g)⇌2NO(g) ΔH1= +180.5 kJ·mol-1,
②CO的燃烧热ΔH2=-283.0 kJ·mol-l,
则反应③2NO(g)+2CO(g)⇌N2(g)+2CO2(g) ΔH3=
(2)南宁三中化学研究小组在三个容积为5 L的恒容密闭容器中,分别充入0.4 mol NO和0.4 mol CO,发生反应③。在三种不同实验条件下进行上述反应(体系各自保持温度不变),反应体系总压强随时间的变化如图所示:

①温度:T1
②CO的平衡转化率:Ⅰ
③T2时的平衡常数K=
Ⅱ.氧化亚氮(N2O)是一种强温室气体,且易转换成颗粒污染物。研究氧化亚氮分解对环境保护有重要意义。
(1)在一定温度下的恒容容器中,反应2N2O(g)⇌2N2(g)+O2(g)的部分实验数据如下:
| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| c(N2O)/mol/L | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.010 |
①在0~20 min,反应速率v(O2)为
②若N2O起始浓度c0为0.150 mol·L-1,则反应至30 min时N2O的转化率α=
③该反应达到平衡的标志有
a.混合气体的密度保持不变
b.混合气体的平均摩尔质量保持不变
c.v正(N2O):v逆(O2) = 2:1
d.c(N2O):c(N2):c(O2) = 2:2:1
e.单位时间内有1 mol O=O键断裂同时有2 mol N≡N形成
(2)碘蒸气的存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)⇌2I(g) (快速平衡,平衡常数为K)
第二步I(g)+N2O(g)⇌N2(g)+IO(g) (慢反应,v=k1·c(N2O)·c(I),k1为速率常数)
第三步IO(g)+N2O(g)⇌N2(g)+O2(g)+I(g) (快反应)
①其中可近似认为第二步反应不影响第一步的平衡。实验表明,含碘时N2O分解速率方程v=k2·c(N2O)·[c(I2)]0.5(k2为速率常数)。下列表述正确的是
a.第一步对总反应速率起决定作用
b.第二步活化能比第三步大
c.I2浓度与N2O分解速率无关
d.催化剂会降低反应的活化能,从而影响△H
②若第二步反应的速率等于N2O分解的总反应速率,则k2=
您最近一年使用:0次
解答题-有机推断题
|
较难(0.4)
名校
20. 环丁基甲酸是重要的有机合成中间体,其一种合成路线如下:
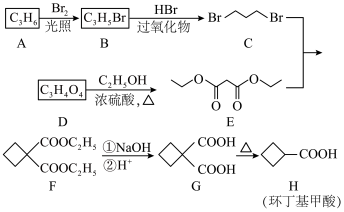
回答以下问题:
(1)A属于烯烃,其结构简式为______ 。
(2)E的化学名称是______ 。
(3)E→F的反应类型是______ 。
(4)已知H的一种同分异构体为丙烯酸乙酯(CH2=CH—COOC2H5),写出聚丙烯酸乙酯在NaOH溶液中水解的化学方程式______ 。
(5)写出同时满足下列条件的G的所有同分异构体______ (写结构简式,不考虑立体异构)。
①核磁共振氢谱为3组峰;
②能使溴的四氯化碳溶液褪色;
③1mol该同分异构体与足量饱和NaHCO3反应产生88g气体。
(6)参照上述合成路线,以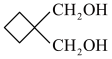 和化合物E为原料(无机试剂任选),设计制备
和化合物E为原料(无机试剂任选),设计制备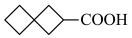 的合成路线:
的合成路线:______ 。

回答以下问题:
(1)A属于烯烃,其结构简式为
(2)E的化学名称是
(3)E→F的反应类型是
(4)已知H的一种同分异构体为丙烯酸乙酯(CH2=CH—COOC2H5),写出聚丙烯酸乙酯在NaOH溶液中水解的化学方程式
(5)写出同时满足下列条件的G的所有同分异构体
①核磁共振氢谱为3组峰;
②能使溴的四氯化碳溶液褪色;
③1mol该同分异构体与足量饱和NaHCO3反应产生88g气体。
(6)参照上述合成路线,以
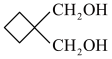 和化合物E为原料(无机试剂任选),设计制备
和化合物E为原料(无机试剂任选),设计制备 的合成路线:
的合成路线:
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:化学反应原理、有机化学基础、化学与STSE、认识化学科学、常见无机物及其应用、化学实验基础
试卷题型(共 20题)
题型
数量
单选题
16
解答题
4
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 能量的相互转化 蛋白质 化石能源 | |
| 2 | 0.65 | 有关粒子结构的化学用语 化学用语综合判断 共价型分子结构式、电子式 | |
| 3 | 0.65 | 结合气体物质与NA相关推算 结合氧化还原反应知识与NA相关推算 结合物质结构基础知识与NA相关推算 | |
| 4 | 0.65 | 离子方程式的正误判断 | |
| 5 | 0.65 | 物质的转化 | |
| 6 | 0.65 | 测定某些反应的反应速率 | |
| 7 | 0.65 | 温度对化学平衡移动的影响 外界条件对化学平衡影响的图像 与转化率变化有关图像的分析 产物的物质的量与温度、压强的图像关系分析 | |
| 8 | 0.65 | 影响化学反应速率的因素 化学平衡的移动及其影响因素 外界条件对化学平衡影响的图像 | |
| 9 | 0.65 | 燃烧热 根据△H=反应物的键能之和-生成物的键能之和进行计算 化学平衡的移动及其影响因素 | |
| 10 | 0.65 | 同分异构体的数目的确定 加聚物的单体、链节及聚合度的确定 缩聚反应机理及判断 有机物的合成 | |
| 11 | 0.65 | 有机分子中原子共面的判断 酚类的取代反应 含有酚羟基的物质性质的推断 多官能团有机物的结构与性质 | |
| 12 | 0.4 | 酚类的显色反应 含酯基有机物水解消耗NaOH的量的计算 | |
| 13 | 0.4 | 化学平衡题中基于图表数据的相关计算 | |
| 14 | 0.65 | 反应热与焓变概念比较 有机物中的化学键类型判断 甲醛组成与结构 | |
| 15 | 0.85 | 反应焓变与热化学方程式的关系 | |
| 16 | 0.65 | 化学平衡图像分析 化学平衡常数的有关计算 | |
| 二、解答题 | |||
| 17 | 0.65 | 氧化还原反应方程式的配平 氯气的实验室制法 物质制备的探究 | 实验探究题 |
| 18 | 0.4 | 几种铁的氧化物的化学性质 | 工业流程题 |
| 19 | 0.65 | 盖斯定律及其有关计算 化学反应速率计算 化学平衡的有关计算 化学平衡状态的判断方法 | 原理综合题 |
| 20 | 0.4 | 根据要求书写同分异构体 取代反应 根据题给物质选择合适合成路线 有机推断综合考查 | 有机推断题 |



