真题
名校
1 . 下列实验操作不当的是
| A.用稀硫酸和锌粒制取H2时,加几滴CuSO4溶液以加快反应速率 |
| B.用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择酚酞为指示剂 |
| C.用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有Na+ |
| D.常压蒸馏时,加入液体的体积不超过圆底烧瓶容积的三分之二 |
您最近一年使用:0次
2018-06-09更新
|
10524次组卷
|
26卷引用:2018年全国普通高等学校招生统一考试化学(新课标III卷)
2018年全国普通高等学校招生统一考试化学(新课标III卷)(已下线)2018年高考题及模拟题汇编 专题11 化学实验基础(已下线)高考母题题源11 化学实验仪器、基本操作辽宁省沈阳市东北育才学校2019届高三上学期第一次模拟考试化学试题【全国百强校】浙江省嘉兴市第一中学2019届高三上学期期末考试化学试题贵州省独山县高级中学2020届高三上学期开学考试理综化学试题湖北省利川市第三中学2019届高三一模化学试题(已下线)专题10.1 常见仪器使用和实验基本操作(讲)-《2020年高考一轮复习讲练测》(已下线)专题10.1 常见仪器使用和实验基本操作(练)-《2020年高考一轮复习讲练测》2019-2020学年高三化学二轮复习选择题强化训练:实验选择题训练(三)——叙述类实验(已下线)《2020年新高考政策解读与配套资源》模拟试题05-2020年北京新高考化学模拟试题(已下线)《2020年新高考政策解读与配套资源》模拟试题07-2020年北京新高考化学模拟试题天津市和平区2020届高三下学期线上学习阶段性评估检测化学试题河北省唐山遵化市2018-2019学年高二下学期期末考试化学试题黑龙江省哈尔滨市第三十二中学2019-2020学年高二下学期期末考试化学试题四川省成都市棠湖中学2019-2020学年高二下学期期末模拟考试化学试题(已下线)第01讲 化学实验基础知识和技能(精讲)——2021年高考化学一轮复习讲练测(已下线)第01讲 化学实验基础知识和技能(精练)——2021年高考化学一轮复习讲练测四川省成都经济技术开发区实验中学2021届高三上学期入学考试化学试题(已下线)【全国百强校】广西桂林市第十八中学2018-2019学年高二下学期期中段考化学试题(已下线)考点29 化学实验基础-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点28 化学实验仪器与基本操作-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时41 酸碱中和滴定及拓展应用-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考向33 从实验到化学-备战2022年高考化学一轮复习考点微专题(已下线)专题11化学实验基础-五年(2018~2022)高考真题汇编(全国卷)天津市咸水沽第一中学2023届高三上学期第一次模拟考试化学试题
真题
名校
2 . 针对下列实验现象表述不正确 的是
| A.用同一针筒先后抽取80 mL氯气、20 mL水,振荡,气体完全溶解,溶液变为黄绿色 |
| B.在表面皿中加入少量胆矾,再加入3 mL浓硫酸,搅拌,固体由蓝色变白色 |
| C.向二氧化硫水溶液中滴加氯化钡溶液,再滴加双氧水,产生白色沉淀 |
| D.将点燃后的镁条伸入充满二氧化碳的集气瓶,镁条剧烈燃烧,有白色、黑色固体生成 |
您最近一年使用:0次
2019-04-12更新
|
5145次组卷
|
20卷引用:2019年4月浙江省普通高校招生选考科目考试化学试题
2019年4月浙江省普通高校招生选考科目考试化学试题【全国百强校】黑龙江省哈尔滨市第六中学2020届高三上学期第一次调研考试(9月)化学试题吉林省吉林市第一中学2020届高三上学期第二次调研考试(11月)化学试题2019-2020学年高三化学二轮复习选择题强化训练:实验选择题训练(三)——叙述类实验福建省福州一中2019—2020年高三上学期期末考试化学试题专题3.2 非金属及其化合物(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升浙江省瑞安市上海新纪元高级中学2019-2020学年高一(7-10)班下学期期初考试化学试题山西省临汾市洪洞县第一中学2020届高三上学期期中考试化学试题四川省北大成都附属实验中学2021届高三上学期开学考试化学试题(已下线)小题必刷13 镁及其化合物——2021年高考化学一轮复习小题必刷(通用版)(已下线)小题必刷18 氯及其化合物——2021年高考化学一轮复习小题必刷(通用版)(已下线)小题必刷19 硫及其化合物——2021年高考化学一轮复习小题必刷(通用版)上海交通大学附属中学2021届高三下学期3月月考化学试题河北饶阳中学2020-2021学年高一下学期第一次月考(实验部)化学试题(已下线)考点28 化学实验仪器与基本操作-备战2022年高考化学一轮复习考点帮(浙江专用)甘肃省嘉峪关市第一中学2021届高三上学期三模考试化学试题(已下线)专题16.化学实验仪器和基本操作-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)专题05 化学基础实验—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)2019年高考浙江卷化学试题变式题(单选题11-15)北京市第一六一中学2021-2022学年高三上学期期中考试化学试题
真题
名校
3 . 下列有关实验的操作正确的是
| 实验 | 操作 | |
| A | 配制稀硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
| B | 排水法收集KMnO4分解产生的O2 | 先熄灭酒精灯,后移出导管 |
| C | 浓盐酸与MnO2反应制备纯净Cl2 | 气体产物先通过浓硫酸,后通过饱和食盐水 |
| D | CCl4萃取碘水中的I2 | 先从分液漏斗下口放出有机层,后从上口倒出水层 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2016-12-09更新
|
4409次组卷
|
43卷引用:2015-2016学年河北省景县中学高一下学期升级考试化学试卷
2015-2016学年河北省景县中学高一下学期升级考试化学试卷2016年全国普通高等学校招生统一考试化学(新课标3卷精编版)2015-2016学年山东省桓台二中高二下期末化学试卷2017届新疆兵团农二师华山中学高三上学前考试化学试卷2016-2017学年山西省山西大学附中高二上9月月考化学卷2017届山东省莱州一中高三上第一次质检化学试卷2016-2017学年福建省厦门第一中学高一下学期开学考试化学试卷四川省彭州市五校2016-2017学年高二下学期期中联考化学试题2018版化学(苏教版)高考总复习专题十对接高考精练--化学实验常用仪器及基本操作江西省南昌市2018届高三摸底调研考试化学试题安徽省淮北市第一中学2017-2018学年高二上学期第一次月考化学试题安徽省淮北市第一中学2017-2018学年高一上学期第一次月考(开学考)化学试题云南民族大学附属中学2017-2018学年高二下学期第一次月考化学试题云南省玉溪第一中学2017-2018学年高一下学期4月月考化学试题云南省玉溪市玉溪一中2017-2018学年高一下学期4月月考化学试题江西省抚州市临川区第一中学2017-2018学年高二下学期期中考试化学试题(已下线)《考前20天终极攻略》-5月21日 基础实验黑龙江省齐齐哈尔市第八中学2017-2018学年高二6月月考化学试题(已下线)解密16 化学实验基础(教师版)——备战2018年高考化学之高频考点解密四川省眉山市眉山中学2018-2019学年高二上学期10月月考理科综合化学试题黑龙江省哈尔滨师范大学附属中学2019届高三上学期第一次月考化学试题云南省腾冲市第八中学2018-2019学年高二上学期期中考试化学试题湖南省邵东县创新实验学校2019届高三上学期第五次月考化学试题2016年全国普通高等学校招生统一考试化学(全国3卷参考版)江西省南昌市八一中学、洪都中学、十七中、实验中学四校2018-2019学年高一下学期3月联考化学试题云南省玉溪一中2018-2019学年高一下学期期中考试化学试题 四川省南充市阆中中学2018-2019学年高二6月月考理科综合化学试题浙江省金华市2018-2019学年高一上学期期末考试化学试题(已下线)专题10.1 常见仪器使用和实验基本操作(讲)-《2020年高考一轮复习讲练测》(已下线)【南昌新东方】2019 八一、洪都 高一下 第一次月考江西省宜春市上高二中2021届高三上学期第一次月考化学试题内蒙古通辽市科左后旗甘旗卡第二高级中学2021届高三9月月考化学试题(已下线)【南昌新东方】1. 进贤二中 田荣达河南省安阳市实验中学2020-2021学年高一上学期阶段性考试化学试题专题3 第一单元综合拔高练-高中化学苏教2019版必修第一册上海外国语大学附属大境中学2021-2022学年高一上学期10月月考化学试卷上海市虹口区复兴高级中学2021-2022学年高一上学期期中考试化学试题广西南宁市普通高中联盟2021-2022学年高二上学期期末联考化学试题广西河池市高级中学2021-2022学年高三上学期第三次月考化学试题上海市闵行区第三中学2021-2022学年高一上学期期中考试化学试题上海市上海中学2022-2023学年高一上学期期中考试化学试题广西贺州市钟山县钟山中学2020-2021学年高一上学期期末考试化学试题广西柳州市第三中学2022-2023学年高二下学期3月月考化学试题
真题
名校
4 . 正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
CH3CH2CH2CH2OH CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90—95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由_____ 。
(2)加入沸石的作用是_____ 。若加热后发现未加沸石,应采取的正确方法是______ 。
(3)上述装置图中,B仪器的名称是_____ ,D仪器的名称是_____ 。
(4)分液漏斗使用前必须进行的操作是_____ (填正确答案标号)。
a.润湿b.干燥c.检漏d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在_____ 层(填“上”或“下”)
(6)反应温度应保持在90—95℃,其原因是_____ 。
(7)本实验中,正丁醛的产率为_____ %。

CH3CH2CH2CH2OH
 CH3CH2CH2CHO
CH3CH2CH2CHO反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90—95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由
(2)加入沸石的作用是
(3)上述装置图中,B仪器的名称是
(4)分液漏斗使用前必须进行的操作是
a.润湿b.干燥c.检漏d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在
(6)反应温度应保持在90—95℃,其原因是
(7)本实验中,正丁醛的产率为
您最近一年使用:0次
2019-01-30更新
|
3266次组卷
|
9卷引用:2013年全国普通高等学校招生统一考试理科综合能力测试化学(新课标Ⅱ卷)
名校
解题方法
5 . 乙醇催化氧化制取乙醛(沸点为20.8℃,能与水混溶)的装置(夹持装置已略) 如图所示。下列说法错误的是
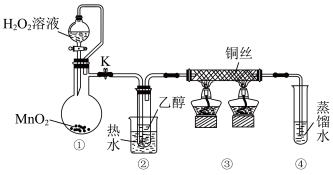

| A.①中用胶管连接其作用是平衡气压,便于液体顺利流下 |
| B.实验过程中铜丝会出现红黑交替变化 |
| C.实验开始时需先加热②,再通O2,然后加热③ |
| D.实验结束时需先将④中的导管移出,再停止加热。 |
您最近一年使用:0次
2020-04-05更新
|
1108次组卷
|
10卷引用:山东省枣庄三中、高密一中、莱西一中2020届高三下学期第一次在线联考化学试题
山东省枣庄三中、高密一中、莱西一中2020届高三下学期第一次在线联考化学试题广东省深圳中学2020届高三第六次理科综合能力测试化学试题江西省井冈山中学2020届高三四月检测理综化学试题湖北省名师联盟2020届高三第三次模拟考试化学试题江西省赣州市第一中学2019-2020学年高二下学期月考化学试题河北省保定市高碑店一中2020-2021学年高二上学期期末考试(励志班)化学试题黑龙江省绥化市明水县第一中学2020-2021学年高二4月月考化学试题(已下线)押广东卷化学第12题 物质制备与方案评价-备战2022年高考化学临考题号押题(广东卷)(已下线)专题08 化学实验基础-备战2023年高考化学母题题源解密(广东卷)第二节 醇酚 第1课时 醇
名校
6 . 实验室用Ca与H2反应制取氢化钙(CaH2)。下列实验装置和原理不能达到实验目的的是( )
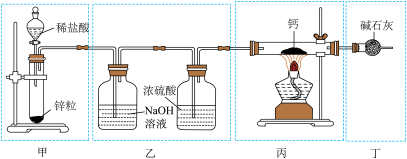

| A.装置甲制取H2 | B.装置乙净化干燥H2 |
| C.装置丙制取CaH2 | D.装置丁吸收尾气 |
您最近一年使用:0次
2019-05-24更新
|
1182次组卷
|
10卷引用:【市级联考】江苏省苏锡常镇四市2019届高三下学期第三次模拟考试化学试题
【市级联考】江苏省苏锡常镇四市2019届高三下学期第三次模拟考试化学试题江苏省扬州中学2020届高三下学期4月考化学试题河南省洛阳市新安县第一高级中学2021届高三入学测试化学试题广东省广州市天河中学2021届高三上学期1月月考化学试题广东省汕头市金山中学2021届高三下学期学科素养测试化学试题(已下线)押全国卷理综第9题 化学实验基础-备战2021年高考化学临考题号押题(课标全国卷)河南省洛阳市2021届高三5月第三次统一考试理综化学试题天津市南开中学2021届高三年级高考模拟考试化学试题(已下线)卷12 化学综合实验选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)湖南省益阳市沅江市第一中学2022届高三下学期第二次模拟考试试题
名校
7 . 溴乙烷是卤代烃的代表,通过对溴乙烷的探究来掌握卤代烃的性质,可以达到举一反三、触类旁通的效果。
I.已知:NaBr+H2SO4(浓) NaHSO4+ HBr CH3CH2OH+HBr
NaHSO4+ HBr CH3CH2OH+HBr CH3CH2Br+H2O
CH3CH2Br+H2O
溴乙烷的沸点38.4℃,实验室制备溴乙烷(CH3CH2Br)的装置和步骤如下:
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应。

回答下列问题:
(1)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是_______________ 。
(2)浓硫酸具有强氧化性,能氧化还原性气体HBr为Br2,导致U形管中粗制的溴乙烷呈棕黄色。为了除去粗产品中的杂质Br2,可选择下列试剂中的:______ (填序号)
A.NaOH溶液B.H2O
C.Na2SO3溶液D.CCl4
分离时所需的主要玻璃仪器是______________ (填仪器名称)。要进一步制得纯净的溴乙烷,可用水洗,然后加入无水CaCl2,再进行_________ (填操作名称)。
II.溴乙烷在不同溶剂中与NaOH可发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。

(1)在试管中加入5 mL 1 mol/L NaOH水溶液和5 mL溴乙烷,将试管如图固定后,加热。
①试管口安装一长导管的作用是_____________________________ 。
②鉴定生成物中乙醇的结构,可用的波谱是___________________ 和___________________ 。
(2)在试管中加入5 mL NaOH乙醇溶液和5 mL溴乙烷,将试管如图固定后,加热。
①请写出该反应的化学方程式____________________________________________________ 。
②为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在设计的实验方案中,需要检验的是___________ ,检验的装置如图所示,在气体通入酸性高锰酸钾溶液前加一个盛水的试管,其作用是_____________ 。

I.已知:NaBr+H2SO4(浓)
 NaHSO4+ HBr CH3CH2OH+HBr
NaHSO4+ HBr CH3CH2OH+HBr CH3CH2Br+H2O
CH3CH2Br+H2O溴乙烷的沸点38.4℃,实验室制备溴乙烷(CH3CH2Br)的装置和步骤如下:
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应。

回答下列问题:
(1)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是
(2)浓硫酸具有强氧化性,能氧化还原性气体HBr为Br2,导致U形管中粗制的溴乙烷呈棕黄色。为了除去粗产品中的杂质Br2,可选择下列试剂中的:
A.NaOH溶液B.H2O
C.Na2SO3溶液D.CCl4
分离时所需的主要玻璃仪器是
II.溴乙烷在不同溶剂中与NaOH可发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。

(1)在试管中加入5 mL 1 mol/L NaOH水溶液和5 mL溴乙烷,将试管如图固定后,加热。
①试管口安装一长导管的作用是
②鉴定生成物中乙醇的结构,可用的波谱是
(2)在试管中加入5 mL NaOH乙醇溶液和5 mL溴乙烷,将试管如图固定后,加热。
①请写出该反应的化学方程式
②为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在设计的实验方案中,需要检验的是

您最近一年使用:0次
2019-04-17更新
|
1129次组卷
|
3卷引用:【全国百强校】重庆市铜梁一中2018-2019学年高二下学期4月月考化学试题
名校
8 . 连二亚硫酸钠(Na2S2O4)俗称保险粉,白色晶体,可溶于水,微溶于乙醇;暴露在空气中易被氧化成亚硫酸氢钠或硫酸氢钠,75℃以上会分解。
(1)Na2S2O4的制取(实验装置如图):
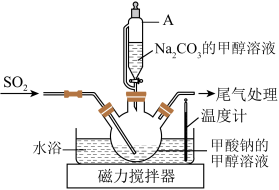
在甲酸钠(HCOONa)的甲醇溶液中,边搅拌边滴加Na2CO3的甲醇溶液,同时通SO2,反应放热,保持温度为60~70℃,即可生成Na2S2O4,同时生成另一种气体。
①仪器A的名称是__________ ,与普通分液漏斗相比,其优点是__________ 。
②三颈烧瓶中生成Na2S2O4的离子方程式为____________ 。
③为了使反应充分进行,得到更多更纯的产品Na2S2O4,应采取的主要措施有_______ 。
A.控制水浴温度不超过75℃
B.加快通SO2的速率
C.加快滴加Na2CO3的甲醇溶液的速率
D.充分搅拌,使反应物充分接触
E.用乙醇洗涤产品,减少因溶解导致的损失
F.在通入SO2前还应该通入一段时间N2,以排尽装置内的空气
(2)Na2S2O4的性质:
取纯净的Na2S2O4晶体,隔绝空气加热,Na2S2O4固体完全分解得到固体产物Na2SO3、Na2S2O3和气体产物_____ (填化学式)。请设计实验验证Na2S2O4固体完全分解后的固体产物中有Na2S2O3存在,完成下表中内容。(供选择的试剂:稀盐酸、稀硝酸、BaCl2溶液、KMnO4溶液)
实验步骤预期现象和结论
(3)Na2S2O4的应用:
六价铬对人体有毒,Na2S2O4可以用于处理含铬废水,使含六价铬的离子浓度降低而达到排放标准,即含六价铬的离子浓度≤0.5mg∙L-1。具体操作是:在含六价铬( )的酸性废水中先加入Na2S2O4,再加入过量的石灰水,生成的沉淀主要有
)的酸性废水中先加入Na2S2O4,再加入过量的石灰水,生成的沉淀主要有_______ (用化学式表示)。
(1)Na2S2O4的制取(实验装置如图):

在甲酸钠(HCOONa)的甲醇溶液中,边搅拌边滴加Na2CO3的甲醇溶液,同时通SO2,反应放热,保持温度为60~70℃,即可生成Na2S2O4,同时生成另一种气体。
①仪器A的名称是
②三颈烧瓶中生成Na2S2O4的离子方程式为
③为了使反应充分进行,得到更多更纯的产品Na2S2O4,应采取的主要措施有
A.控制水浴温度不超过75℃
B.加快通SO2的速率
C.加快滴加Na2CO3的甲醇溶液的速率
D.充分搅拌,使反应物充分接触
E.用乙醇洗涤产品,减少因溶解导致的损失
F.在通入SO2前还应该通入一段时间N2,以排尽装置内的空气
(2)Na2S2O4的性质:
取纯净的Na2S2O4晶体,隔绝空气加热,Na2S2O4固体完全分解得到固体产物Na2SO3、Na2S2O3和气体产物
实验步骤预期现象和结论
| 实验步骤 | 预期现象和结论 |
(3)Na2S2O4的应用:
六价铬对人体有毒,Na2S2O4可以用于处理含铬废水,使含六价铬的离子浓度降低而达到排放标准,即含六价铬的离子浓度≤0.5mg∙L-1。具体操作是:在含六价铬(
 )的酸性废水中先加入Na2S2O4,再加入过量的石灰水,生成的沉淀主要有
)的酸性废水中先加入Na2S2O4,再加入过量的石灰水,生成的沉淀主要有
您最近一年使用:0次
名校
解题方法
9 . 葡萄糖酸亚铁[(C6H11O7)2Fe]是医疗上常用的补铁剂,易溶于水,几乎不溶于乙醇。某实验小组同学拟用下图装置先制备FeCO3,再用FeCO3与葡萄糖酸反应进一步制得葡萄糖酸亚铁。

请回答下列问题:
(1)与普通漏斗比较,a漏斗的优点是___ 。
(2)按如图连接好装置,检查气密性后加入药品,打开K1和K3,关闭K2。
①b中的实验现象___ 。
②一段时间后,关闭___ ,打开___ (选填“K1”“K2”或“K3”),观察到b中的溶液会流入c中,同时c中析出FeCO3沉淀。
③b中产生的气体的作用是___ 。
(3)将c中制得的碳酸亚铁在空气中过滤时间较长时,表面会变为红褐色,用化学方程式说明其原因:___ 。
(4)将葡萄糖酸与碳酸亚铁混合,须将溶液的pH调节至5.8,其原因是___ 。向上述溶液中加入乙醇即可析出产品,加入乙醇的目的是___ 。
(5)有同学提出用NaHCO3溶液代替Na2CO3溶液制得的碳酸亚铁纯度更高,其可能的原因是___ 。

请回答下列问题:
(1)与普通漏斗比较,a漏斗的优点是
(2)按如图连接好装置,检查气密性后加入药品,打开K1和K3,关闭K2。
①b中的实验现象
②一段时间后,关闭
③b中产生的气体的作用是
(3)将c中制得的碳酸亚铁在空气中过滤时间较长时,表面会变为红褐色,用化学方程式说明其原因:
(4)将葡萄糖酸与碳酸亚铁混合,须将溶液的pH调节至5.8,其原因是
(5)有同学提出用NaHCO3溶液代替Na2CO3溶液制得的碳酸亚铁纯度更高,其可能的原因是
您最近一年使用:0次
2019-12-05更新
|
1178次组卷
|
6卷引用:【全国百强校】陕西省宝鸡中学2019届高三下学期第三次模拟考试理科综合化学试题
【全国百强校】陕西省宝鸡中学2019届高三下学期第三次模拟考试理科综合化学试题2020届二轮复习 综合实验探究 专题卷(全国通用)2020届人教版高三化学二轮复习非选择题专攻练——化学实验设计与评价的综合应用1(已下线)04 常考题空4 实验简答题的精准描述 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)题型32 原因描述型实验(已下线)题型一 实验简答题答题规范-备战2024年高考化学答题技巧与模板构建
名校
10 . 在实验探究课上,同学们积极思考,共设计出如图所示的四种实验方案用以验证浓硫酸的吸水性,其中在理论上可行的是( )


| A.①②③④ |
| B.①③④ |
| C.①②④ |
| D.②③④ |
您最近一年使用:0次
2018-01-17更新
|
985次组卷
|
13卷引用:浙江省诸暨中学2017-2018学年高一上学期第二阶段考化学试题
浙江省诸暨中学2017-2018学年高一上学期第二阶段考化学试题5.1.2 硫酸不同价态含硫物质的转化——2020年春高一新人教版第二册化学一课一练广西壮族自治区来宾市忻城县民族中学2019-2020学年高一上学期期末考试化学试题2020年春高一化学新人教版第二册课后同步:5.1.2 硫酸不同价态含硫物质的转化(已下线)3.2.2 硫酸 酸雨及其防治练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)专题4 第二单元 综合拔高练-高中化学苏教2019版必修第一册人教版2019必修第二册 第五章 第一节 第2课时 硫酸 硫酸根离子的检验山西省太原市五十六中2020-2021学年高一下学期第一次月考化学试题吉林省汪清县第四中学2020-2021学年高一下学期第一次阶段考试化学试题安徽省六安市舒城县2020-2021学年高一下学期期末考试化学试题河北省张家口市第一中学2021-2022学年高二上学期开学检测化学试题(已下线)第02讲 三氧化硫和硫酸(讲义)-【寒假自学课】2023年高一化学寒假精品课(人教版2019必修第二册)安徽省合肥市第一中学2022-2023学年高一下学期第一次月考化学试题



