11-12高二下·北京朝阳·期末
名校
解题方法
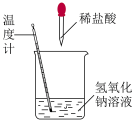
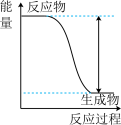
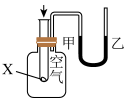
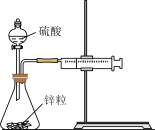
1 . 下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是
|
|
|
|
| A.温度计的水银柱不断上升 | B.反应物总能量大于生成物总能量 | C.反应开始后,甲处液面低于乙处液面 | D.反应开始后,针筒活塞向右移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-01-27更新
|
210次组卷
|
113卷引用:2011-2012学年北京市朝阳区高二下学期期末统一考试化学试卷
(已下线)2011-2012学年北京市朝阳区高二下学期期末统一考试化学试卷【全国区级联考】北京市东城区2017-2018学年高二下学期期末考试化学试题北京市第一七一中学2018-2019学年高二上学期期中考试化学试题北京二中2019-2020学年高二下学期选修 IV模块考试化学试题2016-2017学年福建省龙岩四校高二上学期期中联考化学试卷2016-2017学年江西省奉新县第一中学高二下学期第一次月考化学试卷天津市红桥区2016-2017学年高一下学期期中考试化学试题吉林省辽源市第五中学2016-2017学年高二下学期期末考试化学试题福建省清流一中2017-2018学年高二上学期第二阶段(期中)考试化学(理)试题【全国百强校】贵州省思南中学2017-2018学年高一下学期期中考试化学试题高二人教版选修4 第一章 第一节 化学反应与能量的变化【全国百强校】甘肃省兰州市第一中学2018-2019学年高一下学期3月月考化学试题【全国百强校】吉林省延边第二中学2018-2019学年高一下学期期中考试化学试题步步为赢 高一化学暑假作业:作业六 化学能与热能黑龙江省哈尔滨市第三中学校2018-2019学年高一下学期第二学段考试化学试题西藏林芝市第二中学2019-2020学年高二上学期第一次月考理综化学试题河北省张家口市第一中学西校区、万全中学2019-2020学年高二第一学期期初考试化学试题河北省秦皇岛市第一中学2018-2019学年高二第一学期第一次月考化学试题(已下线)2019年3月17日 《每日一题》 必修2 每周一测浙江省金华市方格外国语学校2019-2020学年高二上学期期中考试化学试题广东省深圳市新安中学2019-2020学年高二上学期期中考试化学试题湖北省宜昌市第二中学(人文艺术高级中学)2019-2020学年高二上学期10月月考化学试题第一节 化学能与热能——A学习区 夯实基础(人教版必修2)课时1 化学反应与热能——A学习区 夯实基础(人教版(2019)第二册)河北省唐山市第一中学2019-2020学年高一下学期第二次月考化学试题专题2 化学反应与能量转化 易错疑难集训(二)——A学习区 夯实基础(苏教版必修2)山东省烟台市第二中学2019-2020学年高一下学期4月月考化学试题河北省邯郸市磁县第二中学2019-2020学年高一下学期期中考试化学试卷福建省莆田第二十四中学2019-2020学年高一化学下学期期中测试卷江西省抚州市南城县第二中学2019-2020学年高一下学期开学考试(自强班)化学试题甘肃省张掖市高台县第一中学2019-2020学年高一下学期期中考试化学试题山西省晋中市平遥中学2019-2020高一下学期在线学习质量检测化学试题山东省烟台市第三中学2019-2020学年高一下学期4月月考化学试题浙江省杭州市塘栖中学2019-2020学年高二下学期3月阶段性检测-化学试题黑龙江省齐齐哈尔市实验中学2019-2020 学年高一下学期期中考试化学试题广东省第二师范学院番禺附属中学2019-2020学年高一下学期期中段考化学试题(已下线)第09练 化学反应与能量的变化-2020年【衔接教材·暑假作业】新高二化学(人教版)河北省衡水市桃城区第十四中学2019-2020学年高一下学期第四次综合测试化学试题黑龙江省哈尔滨师范大学青冈实验中学校2020-2021学年高二上学期开学考试化学试题河北省邯郸市大名县第一中学2020-2021学年高二上学期9月月考化学试题鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第1节 化学反应的热效应 课时1 化学反应的反应热必修第二册RJ第6章第一节 化学反应与能量变化 课时1鲁科版(2019)高二选择性必修第一册第1章 化学反应与能量变化 第1节 化学反应的热效应 课时1 化学反应的反应热、内能变化与焓变浙江省东阳中学2020-2021学年高二上学期10月阶段考试化学试题人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 第一节 反应热 课时1 反应热 焓变江西省宜丰二中2021届高三上学期第一次月考化学试题福建省三明市三地三校2020-2021学年高二上学期期中联考化学试题江西省南昌市新建区第一中学2020-2021学年高二上学期第二次月考化学试题湖北省部分高中2020-2021学年高二上学期期中考试化学试题湖北省石首市第一中学2020-2021学年高二上学期9月月考化学试题浙江省嘉兴市第五高级中学2018-2019学年高二下学期期中考试化学(学考)试题(苏教版2019)必修第二册专题6 化学反应与能量变化 第二单元 化学反应中的热 课时1 化学反应中的能量变化河北省安平中学2019--2020学年下学期高一第二次质量检测考试化学试题山西省朔州市怀仁县大地学校2020-2021学年高二上学期第一次月考化学试题人教版2019必修第二册 第六章 第一节综合拔高练(鲁科版2019)必修第二册 第2章 化学键 化学反应规律 综合检测卷江苏省沭阳县修远中学2020-2021学年高二下学期第一次联考化学试题浙江省杭州市富阳区场口中学2020-2021学年高一下学期3月教学质量检测化学试题甘肃省兰州市第一中学2020-2021学年高一下学期4月月考化学试题江苏省扬州中学2020-2021学年高一下学期期中考试化学试题山西省柳林县2020--2021学年高一下学期期中考试化学试题甘肃省会宁县第一中学2020-2021学年高一下学期期中考试化学试题黑龙江省双鸭山市第一中学2020-2021学年高一下学期期中考试化学试题(已下线)作业01 反应热-2021年高二化学暑假作业(人教版2019)新疆塔什库尔干塔吉克自治县深塔中学2020-2021学年高二下学期期末考试化学试题选择性必修1(SJ)专题1第一单元课时1 化学反应的熔变选择性必修1专题1第一单元 课时1 化学反应的焓变重庆市第七中学校2020-2021学年高一下学期半期考试化学试题(已下线)第1章 化学反应与能量(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)江苏省镇江市丹阳高级中学2021-2022学年高二上学期10月大练化学试题甘肃省张掖市第二中学2021-2022学年高二上学期10月月考(B班)化学试题甘肃省张掖市第二中学2021-2022学年高二上学期10月月考(A班)化学试题广东省佛山市南海区桂城中学2021-2022学年高二上学期第一次月考化学试题江苏省宿迁市沭阳县2021-2022学年高二上学期期中调研测试化学试题(已下线)1.1.1 反应热 焓变(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)辽宁师范大学附属中学2021-2022学年高二上学期10月月考化学试题四川省西昌市2020-2021学年高一下学期期中检测化学试题吉林省松原市前郭尔罗斯蒙古族自治县第五中学2021-2022学年高一下学期第一次线上测试化学试题江苏省太湖高级中学2021-2022学年高一下学期期中考试化学试题安徽省蚌埠第三中学2021-2022学年高一下学期4月阶段测试化学试题四川省宜宾市叙州区第一中学校2021-2022学年高一下学期期中考试化学试题广东省揭阳华侨高级中学2021-2022学年高二上学期第一次阶段考试化学试题广东省徐闻县徐闻中学2022-2023学年高二上学期开学测试化学试题第一章 化学反应的热效应(B卷·能力提升练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)陕西省西安市临潼区铁路中学2021-2022学年高一下学期5月第二次月考化学试题广西柳州市第三中学2022-2023学年高二上学期10月月考化学试题甘肃省庆阳第六中学2022-2023学年高二上学期第一次月考化学试题新疆乌鲁木齐市第八中学2022-2023学年高二上学期期中考试化学试题浙江省嘉兴市第一中学2022-2023学年高二上学期期中检测化学试题广东省深圳实验学校高中部2022-2023学年高二上学期第一阶段考试化学试题河北省卢龙县第二高级中学2021-2022学年高二上学期期中考试化学试题江苏省宿迁市北大附属宿迁实验学校2022-2023学年高二上学期11月期中化学试题重庆市西南大学附属中学校2022-2023学年高三上学期第二次月考化学试题湖南省邵阳市新邵县第八中学2022-2023学年高二上学期期末质量检测化学试题湖南省邵阳市新邵县2022-2023学年高二上学期期末质量检测化学试题湖北省部分普通高中联盟2022-2023学年高一下学期期中联考化学试题1.1.1化学反应的焓变 课后湖南省株洲市炎陵县2022-2023学年高一下学期4月期中素质检测化学试题浙江省杭州市四校2023-2024学年高二上学期10月联考化学试题湖南省南雅中学2023-2024学年高二上学期第一次月考化学试题山西省太原市第五中学校2023-2024学年高二上学期10月月考化学试题山西省大同市第一中学校2023-2024学年高二上学期10月月考化学试题河南省焦作市博爱县第一中学2023-2024学年高二上学期第一次半月考化学试题江西省宜春市丰城市第九中学2023-2024学年高二上学期开学考试化学(B卷)试题陕西省汉中市乡县第一中学2023-2024学年高二上学期10月月考化学试题河南省驻马店高级中学2023-2024学年高二上学期期中考试化学试题新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高二上学期第二次月考试化学试卷安徽省安庆市岳西中学2023-2024学年高二上学期9月月考化学试题浙江省杭州东方中学2023-2024学年高二上学期期中考试化学试题广东省汕头市潮南区龙岭中英文学校2023-2024学年高二上学期10月月考化学试题新疆阿克苏市实验中学2023-2024学年高二上学期第一次月考化学试题重庆市巴渝学校2023-2024学年高二上学期期中(半期)考试化学试题河北省石家庄市第二中学2023-2024学年高一下学期期中考试化学试题
名校
解题方法
2 . 某小组以Ba(OH)2、水、H2SO4、Na2SO4为实验对象探究离子反应发生的条件。
(1) Ba(OH)2与H2SO4在溶液中能发生__________ 反应。
a.置换反应 b.酸碱中和反应 c.复分解反应
(2) ①中灯泡不亮而②中加H2O后灯泡变亮的原因是加水后,Ba(OH)2发生了_______________ 。
(3) 用离子方程式 解释过程I中灯泡变暗的原因_______________ 。
(4) 实验2:用Na2SO4溶液替代稀H2SO4,重复实验进行对照。加入Na2SO4溶液过程中灯泡不熄灭,原因是_____ 。
通过实验1和2可知:离子反应发生的条件之一是生成沉淀。
(5) 在两份完全相同的Ba(OH)2溶液中,分别滴入H2SO4和NaHSO4溶液(说明:等体积溶液含H2SO4和NaHSO4微粒数相同),其导电能力随滴入溶液体积变化的曲线如图所示。
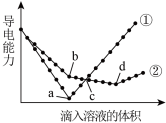
下列分析不正确 的是__________ 。
A. ①代表滴加H2SO4溶液的变化曲线
B. b点,溶液中大量存在的离子是Na+、OH-、SO
C. c点,两份溶液中含有相同量的OH-
D. a、d两点对应的溶液均显中性
| 实验1:向烧杯中 | |
 | ①Ba(OH)2粉末:灯泡不亮 ②加入蒸馏水:灯泡变亮 ③逐滴滴加0.1 mol/L H2SO4,灯泡变化如下: 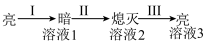 |
a.置换反应 b.酸碱中和反应 c.复分解反应
(2) ①中灯泡不亮而②中加H2O后灯泡变亮的原因是加水后,Ba(OH)2发生了
(3) 用
(4) 实验2:用Na2SO4溶液替代稀H2SO4,重复实验进行对照。加入Na2SO4溶液过程中灯泡不熄灭,原因是
通过实验1和2可知:离子反应发生的条件之一是生成沉淀。
(5) 在两份完全相同的Ba(OH)2溶液中,分别滴入H2SO4和NaHSO4溶液(说明:等体积溶液含H2SO4和NaHSO4微粒数相同),其导电能力随滴入溶液体积变化的曲线如图所示。

下列分析
A. ①代表滴加H2SO4溶液的变化曲线
B. b点,溶液中大量存在的离子是Na+、OH-、SO

C. c点,两份溶液中含有相同量的OH-
D. a、d两点对应的溶液均显中性
您最近一年使用:0次
2020-11-10更新
|
419次组卷
|
5卷引用:北京交通大学附属中学2020-2021学年高一上学期期中考试化学试题
北京交通大学附属中学2020-2021学年高一上学期期中考试化学试题北京市中关村中学2021-2022学年高一上学期期中考试化学试题(已下线)专题卷一 离子反应(A卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)黑龙江省绥化市第一中学2021-2022学年高一上学期期中考试化学试卷江西省兴国中学2023-2024学年高一下学期第一次月考(开学)化学试题
解题方法
3 . 某化学小组在学习元素周期律后,对教材中Fe2+氧化为Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化为Fe3+,那么Br2和I2能否将Fe2+氧化为Fe3+?
(一)理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是___ 。
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为Fe3+而I2不能。他们思考的依据是从上到下卤素单质氧化性减弱。
(二)设计实验进行验证
在大试管中加适量铁粉,加入10mL稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验。
(三)实验现象的分析与解释
(I)同学甲认为①中现象说明溴水能将Fe2+氧化,离子方程式为___ 。
同学乙认为应该补充实验,才能得出同学甲的结论。请你帮助同学乙完成实验:
实验2:
(II)该小组同学对②中溶液呈黄色的原因展开了讨论:
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色。
可能2:___ 。
实验3:进行实验以确定可能的原因。
同学丙认为该实验现象可以说明是“可能2”成立,同学丁认为不严谨,理由是___ 。
于是,同学丁重新设计实验得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小。
(III)Cl2、Br2、I2氧化Fe2+的能力逐渐减弱,用原子结构解释原因:___ 。
(一)理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为Fe3+而I2不能。他们思考的依据是从上到下卤素单质氧化性减弱。
(二)设计实验进行验证
在大试管中加适量铁粉,加入10mL稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验。
| 试管 | 操作 | 现象 |
| ① | 先向试管中加入2mLFeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
| ② | 先向试管中加入2mLFeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
(三)实验现象的分析与解释
(I)同学甲认为①中现象说明溴水能将Fe2+氧化,离子方程式为
同学乙认为应该补充实验,才能得出同学甲的结论。请你帮助同学乙完成实验:
实验2:
| 操作 | 应该观察到的现象 |
| (3) | (4) |
(II)该小组同学对②中溶液呈黄色的原因展开了讨论:
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色。
可能2:
实验3:进行实验以确定可能的原因。
| 操作 | 现象 |
| 向试管②所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后。取出上层溶液,滴加KSCN溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN溶液后,出现浅红色 |
同学丙认为该实验现象可以说明是“可能2”成立,同学丁认为不严谨,理由是
于是,同学丁重新设计实验得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小。
(III)Cl2、Br2、I2氧化Fe2+的能力逐渐减弱,用原子结构解释原因:
您最近一年使用:0次
4 . 某化学小组同学探究在实验室中 检验的干扰因素。
检验的干扰因素。
(1)检验溶液中是否含有 时先用过量盐酸将溶液酸化,其目的是排除
时先用过量盐酸将溶液酸化,其目的是排除_______________ 、 、Ag+等离子可能造成的干扰。
、Ag+等离子可能造成的干扰。
(2)为了验证盐酸能否排除 的干扰,该小组同学进行了如下实验:
的干扰,该小组同学进行了如下实验:
Ⅰ.量取一定体积的浓盐酸(盛放浓盐酸试剂瓶的标签中部分信息如下图),稀释,配制成 5 mol/L 的稀盐酸。

Ⅱ.甲同学取 0.3 g 未变质的 Na2SO3 固体,向其中加入上述 5mol/L 稀盐酸至过量,产生大量气泡。充分振荡后滴加 4 滴BaCl2溶液,迅速产生白色浑浊,产生白色浑浊的原因可能是:
①______________ 。
②盐酸中含有 Fe3+,实验证实含有 Fe3+的方案是:___________________ ,用离子方程式解释由 Fe3+产生白色浑浊的原因:__________ 。
(3)乙同学提出,检验 时能否用硝酸酸化来排除
时能否用硝酸酸化来排除 的干扰,丙同学认为不可行,理由是(用离子方程式表示)
的干扰,丙同学认为不可行,理由是(用离子方程式表示)____________________________ ,继续实验:称取 5 份 0.3 g 未变质的Na2SO3固体,分别向其中加入 10 mL 不同浓度的硝酸, 振荡;再滴加 4 滴BaCl2 溶液,观察并记录实验现象如下表。
依据上述实验得出的结论是:________________ 。
(4)丙同学查阅资料后提出:Cl-的存在也会对 的检验产生干扰。在 Cl-催化作用下,稀硝酸可将
的检验产生干扰。在 Cl-催化作用下,稀硝酸可将 氧化为
氧化为  。为证明上述观点,设计如下实验,请将实验ⅱ的操作补充完整。
。为证明上述观点,设计如下实验,请将实验ⅱ的操作补充完整。
 检验的干扰因素。
检验的干扰因素。(1)检验溶液中是否含有
 时先用过量盐酸将溶液酸化,其目的是排除
时先用过量盐酸将溶液酸化,其目的是排除 、Ag+等离子可能造成的干扰。
、Ag+等离子可能造成的干扰。(2)为了验证盐酸能否排除
 的干扰,该小组同学进行了如下实验:
的干扰,该小组同学进行了如下实验:Ⅰ.量取一定体积的浓盐酸(盛放浓盐酸试剂瓶的标签中部分信息如下图),稀释,配制成 5 mol/L 的稀盐酸。

Ⅱ.甲同学取 0.3 g 未变质的 Na2SO3 固体,向其中加入上述 5mol/L 稀盐酸至过量,产生大量气泡。充分振荡后滴加 4 滴BaCl2溶液,迅速产生白色浑浊,产生白色浑浊的原因可能是:
①
②盐酸中含有 Fe3+,实验证实含有 Fe3+的方案是:
(3)乙同学提出,检验
 时能否用硝酸酸化来排除
时能否用硝酸酸化来排除 的干扰,丙同学认为不可行,理由是(用离子方程式表示)
的干扰,丙同学认为不可行,理由是(用离子方程式表示)| 硝酸浓度(mol/L) | 滴加氯化钡溶液之前现象 | 滴加氯化钡溶液之后现象 |
| 15.0(浓硝酸) | 产生大量红棕色气体,溶液呈黄色 | 立即产生大量白色沉淀 |
| 7.5 | 产生大量红棕色气体,溶液呈淡黄色 | 立即产生大量白色沉淀 |
| 4.8 | 产生少量无色、刺激性气味气体,溶液无色 | 开始无现象,约 60 min 后溶液开始变浑浊 |
| 2.0 | 产生少量无色、刺激性气味气体,溶液无色 | 开始无现象,约 70 min 后溶液开始变浑浊 |
| 0.5 | 产生少量无色、刺激性气味气体,溶液无色 | 开始无现象,约 120 min 后溶液开始变浑浊 |
(4)丙同学查阅资料后提出:Cl-的存在也会对
 的检验产生干扰。在 Cl-催化作用下,稀硝酸可将
的检验产生干扰。在 Cl-催化作用下,稀硝酸可将 氧化为
氧化为  。为证明上述观点,设计如下实验,请将实验ⅱ的操作补充完整。
。为证明上述观点,设计如下实验,请将实验ⅱ的操作补充完整。| 实验 | 实验操作 | 实验现象 |
| ⅰ | 将 0.3 g Na2SO3和 0.3 g NaCl 固体混合,加入 10 mL 2.0mol/L 的稀硝酸,振荡后,再滴加 4 滴 BaCl2溶液。 | 立即产生大量白色沉淀。 |
| ⅱ | 放置两小时后溶液未变浑浊。 |
您最近一年使用:0次
解题方法
5 . 某小组探究清洗试管(内壁附着银镜)的反应原理,进行下列实验。
I.初步探究
(1)将稀硝酸加入附着银镜的试管中,记录现象如下:
①补全反应中的实验现象___ 。
②实验Ⅰ中银镜消失发生反应的化学方程式为____ 。
(2)为消除实验Ⅰ中氮氧化物的污染,将双氧水溶液加入附着银镜的试管中。
①由现象推测H2O2将Ag氧化为Ag+,但通过实验排除了这种可能。该实验方案是:在反应后的液体中,加入___ 。
②查阅资料发现:该实验中银镜溶解后最终产物为颗粒很小(直径在1~100nm之间)的Ag,其分散在液体中,肉眼无法识别。该同学通过实验证实了这种可能性。他的操作及现象是:___ 。
③写出该实验Ⅱ中发生反应的化学方程式:___ 。
II.查阅资料,继续探究
查阅文献:Ag2O+4NH3•H2O=2[Ag(NH3)2]++2OH-+3H2O
(3)探究Ag 2O在H 2O 2分解反应中的作用,进行如下实验。
根据实验Ⅲ的现象猜想:Ag 2O在反应中作氧化剂。继续实验,在实验Ⅲ反应后的试管中加入足量的溶液x后,固体仍有剩余。由此验证了该猜想的正确。
①在实验中加入足量的溶液x是____ 。
②实验Ⅲ中发生反应的化学方程式为___ 。
I.初步探究
(1)将稀硝酸加入附着银镜的试管中,记录现象如下:
实验Ⅰ | 实验操作 | 实验现象 |
 | 银镜上出现气泡,在液面下方为无色气体,在试管口附近......;试管内壁上的银逐渐溶解。 |
②实验Ⅰ中银镜消失发生反应的化学方程式为
(2)为消除实验Ⅰ中氮氧化物的污染,将双氧水溶液加入附着银镜的试管中。
实验Ⅱ | 实验操作 | 实验现象 |
 | 剧烈反应,有大量无色气体产生,该气体可以使带火星的木条复燃;试管内壁上的银逐渐溶解。 |
②查阅资料发现:该实验中银镜溶解后最终产物为颗粒很小(直径在1~100nm之间)的Ag,其分散在液体中,肉眼无法识别。该同学通过实验证实了这种可能性。他的操作及现象是:
③写出该实验Ⅱ中发生反应的化学方程式:
II.查阅资料,继续探究
查阅文献:Ag2O+4NH3•H2O=2[Ag(NH3)2]++2OH-+3H2O
(3)探究Ag 2O在H 2O 2分解反应中的作用,进行如下实验。
实验Ⅲ | 实验操作 | 实验现象 |
 | 剧烈反应,产生大量的无色气体,同时在试管底部仍有少量黑色固体 |
①在实验中加入足量的溶液x是
②实验Ⅲ中发生反应的化学方程式为
您最近一年使用:0次
2020-06-06更新
|
206次组卷
|
2卷引用:北京市密云2020届高三第二次模拟考试化学试题
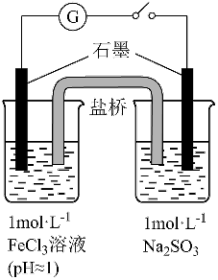
6 . 某实验小组研究 FeCl3溶液与 Na2SO3溶液之间的反应,进行如下实验探究
(1)配制 FeCl3溶液时,先将 FeCl3溶于浓盐酸,再稀释至指定浓度。结合化学用语说 明浓盐酸的作用:______ 。
(2)甲同学认为,上述实验在开始混合时观察到的现象不涉及氧化还原反应,实验 I中红褐色比 II 中略浅的原因是______ 。
(3)乙同学认为实验 II 可能发生了氧化还原反应,为了探究反应的产物做了实验 III和生成物检验。
① 取少量 Na2SO3溶液电极附近的混合液,加入______ ,产生白色沉淀,证明产生了 SO42-。
② 该同学又设计实验探究另一电极的产物,取少量FeCl3溶液电极附近的混合液,加入铁氰化钾溶液,产生____________________ ,证明产生了Fe2+。
(4)实验 III 发生反应的方程式是______ 。
(5)实验小组查阅资料:溶液中 Fe3+、 SO32-、OH-三种微粒会形成红色配合物并存在如下转化:

从反应速率和化学平衡两个角度解释实验 I、II 现象背后的原因可能是:______ 。
 | 编号 | 实验试剂及用量 | 开始混合时现象 | 30min时 | 3天后 |
I | 取1.0mol/LNa2SO3溶液2mL 滴加1.0mol/L FeCl3溶液2滴 | 溶液立即变为红褐色,比II中略浅 | 与开始混合时一致 | 溶液呈黄绿色 | |
II | 取1.0mol/L FeCl3溶液2mL 滴加1.0mol/L Na2SO3溶液2滴 | 溶液立即变为红褐色 | 红褐色明显变浅 | 溶液呈黄绿色 |
(1)配制 FeCl3溶液时,先将 FeCl3溶于浓盐酸,再稀释至指定浓度。结合化学用语说 明浓盐酸的作用:
(2)甲同学认为,上述实验在开始混合时观察到的现象不涉及氧化还原反应,实验 I中红褐色比 II 中略浅的原因是
(3)乙同学认为实验 II 可能发生了氧化还原反应,为了探究反应的产物做了实验 III和生成物检验。
 | 编号 | 实验操作及现象 |
III | 闭合开关后灵敏电流计指针发生偏转 |
① 取少量 Na2SO3溶液电极附近的混合液,加入
② 该同学又设计实验探究另一电极的产物,取少量FeCl3溶液电极附近的混合液,加入铁氰化钾溶液,产生
(4)实验 III 发生反应的方程式是
(5)实验小组查阅资料:溶液中 Fe3+、 SO32-、OH-三种微粒会形成红色配合物并存在如下转化:

从反应速率和化学平衡两个角度解释实验 I、II 现象背后的原因可能是:
您最近一年使用:0次
名校
解题方法
7 . 用 与
与 反应制备KI固体,装置如图所示。实验步骤:①检查装置的气密性;②关闭K,在各装置中加入相应试剂,向装置B中滴入30%的KOH溶液,制得
反应制备KI固体,装置如图所示。实验步骤:①检查装置的气密性;②关闭K,在各装置中加入相应试剂,向装置B中滴入30%的KOH溶液,制得 ;③打开K,通入
;③打开K,通入 直至饱和可制得KI,同时有黄色沉淀生成;④关闭K,向所得溶液滴入稀硫酸,水浴加热,充分逸出
直至饱和可制得KI,同时有黄色沉淀生成;④关闭K,向所得溶液滴入稀硫酸,水浴加热,充分逸出 ;⑤把装置B中混合液倒入烧杯,为除去硫酸,加入足量碳酸钡,再经过一系列操作可得成品。下列有关该实验的叙述错误的是
;⑤把装置B中混合液倒入烧杯,为除去硫酸,加入足量碳酸钡,再经过一系列操作可得成品。下列有关该实验的叙述错误的是

 与
与 反应制备KI固体,装置如图所示。实验步骤:①检查装置的气密性;②关闭K,在各装置中加入相应试剂,向装置B中滴入30%的KOH溶液,制得
反应制备KI固体,装置如图所示。实验步骤:①检查装置的气密性;②关闭K,在各装置中加入相应试剂,向装置B中滴入30%的KOH溶液,制得 ;③打开K,通入
;③打开K,通入 直至饱和可制得KI,同时有黄色沉淀生成;④关闭K,向所得溶液滴入稀硫酸,水浴加热,充分逸出
直至饱和可制得KI,同时有黄色沉淀生成;④关闭K,向所得溶液滴入稀硫酸,水浴加热,充分逸出 ;⑤把装置B中混合液倒入烧杯,为除去硫酸,加入足量碳酸钡,再经过一系列操作可得成品。下列有关该实验的叙述错误的是
;⑤把装置B中混合液倒入烧杯,为除去硫酸,加入足量碳酸钡,再经过一系列操作可得成品。下列有关该实验的叙述错误的是
| A.步骤②可观察到固体溶解,溶液由棕黄色变为无色 |
B.步骤③装置B中发生反应的离子方程式为 |
| C.步骤⑤中一系列操作为过滤,洗涤,合并滤液和洗液,蒸馏 |
| D.装置C中氢氧化钠溶液的作用是吸收硫化氢 |
您最近一年使用:0次
2020-04-04更新
|
550次组卷
|
8卷引用:北京市昌平区新学道临川学校2020届高三上学期期末考试化学试题
北京市昌平区新学道临川学校2020届高三上学期期末考试化学试题河北省衡水中学2020届高三第一次联合考试化学试题2020届高考化学小题狂练(全国通用版)专练7 非金属及其化合物四川省成都市双流棠湖中学高2020届高三下学期3月理科综合训练(一)化学试题山东省实验中学2020届高三下学期线上周测化学试题(已下线)考点16 非金属元素及其化合物-2020年高考化学命题预测与模拟试题分类精编(已下线)小题必刷18 氯及其化合物——2021年高考化学一轮复习小题必刷(通用版)福建泉州实验中学2021-2022学年高三上学期12月月考化学试题
名校
8 . 下述实验方案中均使用了NaCl溶液,能达到实验目的的是( )
| 编号 | A | B | C | D |
| 实验 方案 | 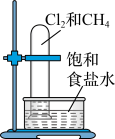 置于光亮处 | 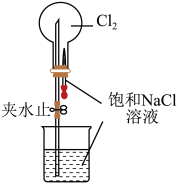 | 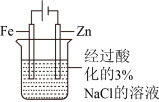 片刻后在Fe电极附近滴入K3[Fe(CN)6]溶液 | 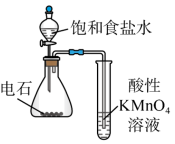 |
| 实验 目的 | 验证甲烷与氯气发生化学反应 | 进行喷泉实验 | 验证Fe电极被保护 | 验证乙炔的还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-01-14更新
|
250次组卷
|
2卷引用:北京市房山区2020届高三上学期期末考试化学试题
9 . 某学习小组为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,设计了如下实验。请补充完成该实验报告。
(1)【实验原理】
溶液的导电性由溶液中离子的浓度及离子电荷数决定。观察_____ ,据此判断溶液中自由移动的离子浓度的变化,从而证明反应是离子反应。
(2)【实验装置】如图1所示。

【实验过程与记录】
(3)整个过程中混合溶液的导电能力(用电流强度Ⅰ表示)可近似地用图2中的_____ (填序号)曲线表示。
(4)下列三种情况下,与上述实验中离子方程式相同的是_____ 。
A 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42﹣恰好完全沉淀
B 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至至溶液显中性
C 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(5)已知:PbSO4难溶于水,但可溶于醋酸氨溶液中形成无色溶液,其化学方程式为:PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4.写出该反应的离子方程式为_____ 。
(1)【实验原理】
溶液的导电性由溶液中离子的浓度及离子电荷数决定。观察
(2)【实验装置】如图1所示。

【实验过程与记录】
| 实验步骤 | 实验现象 | 实验结论 |
| 连接好装置,向烧杯中加入25mL1mol•L﹣1的Ba(OH)2溶液和2滴酚酞溶液,逐滴滴加1mol•L﹣1的H2SO4溶液直至过量,边滴边振荡。 | (2) | Ba(OH)2溶液和H2SO4溶液的反应是离子反应 |
(4)下列三种情况下,与上述实验中离子方程式相同的是
A 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42﹣恰好完全沉淀
B 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至至溶液显中性
C 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(5)已知:PbSO4难溶于水,但可溶于醋酸氨溶液中形成无色溶液,其化学方程式为:PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4.写出该反应的离子方程式为
您最近一年使用:0次
10 . 某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊.A受热分解的化学方程式为_____ .
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL 蒸馏水,振荡,恢复至室温,发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论_____ .
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中.
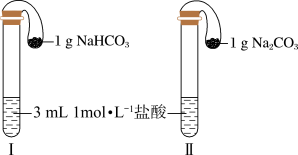
①两试管中均产生气体,_____ (填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈.
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是_____ .
a 装置 I的气球体积较大 b 装置Ⅱ的气球体积较大
c 装置 I的气球体积等于装置Ⅱ的气球体积 d 无法判断
(4)同学们将两种固体分别配制成0.5mol•L﹣1的溶液,设计如下方案并对反应现象做出预测:
操作1反应的离子方程式为________________ ,实施试验后,发现操作2的现象与预测有差异,产生白色沉淀和气体,则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为____________ .
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊.A受热分解的化学方程式为
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL 蒸馏水,振荡,恢复至室温,发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中.

①两试管中均产生气体,
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是
a 装置 I的气球体积较大 b 装置Ⅱ的气球体积较大
c 装置 I的气球体积等于装置Ⅱ的气球体积 d 无法判断
(4)同学们将两种固体分别配制成0.5mol•L﹣1的溶液,设计如下方案并对反应现象做出预测:
| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2mL Na2CO3溶液中滴加1mL 0.5mol•L﹣1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32﹣浓度较大,能与CaCl2发生反应 |
| 操作2:向2mL NaHCO3溶液中滴加1mL 0.5mol•L﹣1CaCl2溶液 | 无白色沉淀 | Na2CO3溶液中的CO32﹣浓度很小,不能与CaCl2发生反应。 |
您最近一年使用:0次