13-14高二上·广东·期中
名校
1 . KI淀粉溶液在酸性条件下能与氧气反应。现有以下实验记录:
回答下列问题:
(1)该反应的离子方程式为___________ 。
(2)该实验的目的是___________ 。
(3)实验试剂除了1 KI溶液、0.1
KI溶液、0.1 H2SO4溶液外,还需要的试剂是
H2SO4溶液外,还需要的试剂是___________ ,实验现象为___________ 。
(4)实验操作中除了需要上述条件外,还必须控制___________ (填字母)不变。
A.温度B.试剂的用量(体积)C.试剂添加的顺序
(5)由上述实验记录可得出的结论是___________ 。
(6)若要进行溶液酸性强弱对反应速率影响的探究实验,你会采取的实验方案是___________ 。
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度/℃ | 30 | 40 | 50 | 60 | 70 |
| 显色时间/s | 160 | 80 | 40 | 20 | 10 |
(1)该反应的离子方程式为
(2)该实验的目的是
(3)实验试剂除了1
 KI溶液、0.1
KI溶液、0.1 H2SO4溶液外,还需要的试剂是
H2SO4溶液外,还需要的试剂是(4)实验操作中除了需要上述条件外,还必须控制
A.温度B.试剂的用量(体积)C.试剂添加的顺序
(5)由上述实验记录可得出的结论是
(6)若要进行溶液酸性强弱对反应速率影响的探究实验,你会采取的实验方案是
您最近一年使用:0次
2021-10-19更新
|
147次组卷
|
21卷引用:2013-2014学年广东省执信中学高二上学期期中考试理科化学试卷
(已下线)2013-2014学年广东省执信中学高二上学期期中考试理科化学试卷2015-2016学年安徽师大附中高二下期中化学试卷江西省赣县三中2018-2019学年高二上学期9月月考化学试题【校级联考】安徽省定远重点中学2018-2019学年高二下学期开学考试化学试题广东省揭阳市惠来县第一中学2019-2020学年高二上学期第一次阶段考试化学试题2019年10月21日《每日一题》2019-2020学年高二化学人教选修4——化学反应速率的实验探究山西省阳泉市2019-2020学年高二上学期期末考试化学试题(已下线)2.2+影响化学反应速率的因素-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)陕西省汉中市五校2020-2021学年高二上学期第一次月考化学试题四川省凉山宁南中学2019-2020学年高二上学期第一次月考化学试题(已下线)2.3.3 化学反应速率综合分析-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修1)云南省新平县一中2020-2021学年高二下学期期中考试化学试题(已下线)考向21 化学反应速率及影响因素-备战2022年高考化学一轮复习考点微专题福建省福州格致中学2021-2022学年高二上学期第一阶段测试化学试题(10月)云南省丘北县第一中学2021-2022学年高二下学期3月份考试 化学试题云南省玉龙县第一中学2021-2022学年高二下学期3月份考试化学试题四川省广元市八二一中学2021-2022学年高二上学期期中考试化学试题云南省广南县二中2021-2022年学年高二下学期开学考试化学试题云南省楚雄第一中学2022-2023学年高二下学期期末考试化学试题安徽省滁州市定远县第三中学等2校2022-2023学年高二上学期12月月考化学试题(已下线)专题03 化学反应速率及影响因素、活化能【考题猜想】(9大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)
名校
解题方法
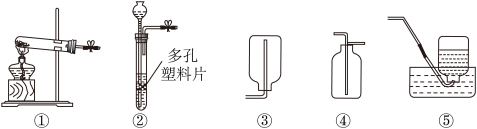
2 . 实验室制取氯化氢气体时有如下操作,操作顺序正确的是( )
①连接好装置,检查气密性;②缓缓加热,加快反应,使气体均匀逸出;③在烧瓶中入氯化钠固体;④往分液漏斗中加入浓硫酸,再缓缓滴入烧瓶中;⑤用向上排空气法收集氯化氢气体,尾气导入吸收剂中。
①连接好装置,检查气密性;②缓缓加热,加快反应,使气体均匀逸出;③在烧瓶中入氯化钠固体;④往分液漏斗中加入浓硫酸,再缓缓滴入烧瓶中;⑤用向上排空气法收集氯化氢气体,尾气导入吸收剂中。
| A.①③④②⑤ | B.①②③④⑤ | C.①④②③⑤ | D.③①②④⑤ |
您最近一年使用:0次
解题方法
3 . 某中学有甲、乙两个探究型学习小组,他们用镁条与足量稀硫酸的反应测定通常状况下(约20℃, )气体摩尔体积。
)气体摩尔体积。
甲组同学拟选用下列实验装置完成实验:

(1)该组同学必须选用的装置接口的连接顺序是
______ 。
(2)实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸不能顺利滴入锥形瓶。请你帮助分析原因_______ 。
(3)实验结束时,该组同学需要读取的数据是________ 。
乙组同学仔细分析甲组同学的实验装置后,认为:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小,于是他们设计了如下图所示的实验装置。

(4)装置中导管a的作用是:_________ 。
(5)实验步骤:
①_________ (填写实验操作)。
②将镁条用砂纸仔细擦去表面氧化层后、称量其质量为 ;
;
③加入药品、连接好装置,并将量气管与左侧集气装置的液面调至相平;
④打开分液漏斗活塞开始反应;
……
反应结束后量气管中气体体积为 。则通常状况下气体摩尔体积
。则通常状况下气体摩尔体积
______ (用含m、V的代数式表示).
(6)若乙组同学的测定结果比理论值偏高,下列原因中可能的是________ 。
a.实验中硫酸不足
b.生成的 未经干燥
未经干燥
c.未等气体冷却至室温即进行读数
d.读数时量气管中液面高于左侧集气装置液面
 )气体摩尔体积。
)气体摩尔体积。甲组同学拟选用下列实验装置完成实验:

(1)该组同学必须选用的装置接口的连接顺序是

(2)实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸不能顺利滴入锥形瓶。请你帮助分析原因
(3)实验结束时,该组同学需要读取的数据是
乙组同学仔细分析甲组同学的实验装置后,认为:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小,于是他们设计了如下图所示的实验装置。

(4)装置中导管a的作用是:
(5)实验步骤:
①
②将镁条用砂纸仔细擦去表面氧化层后、称量其质量为
 ;
;③加入药品、连接好装置,并将量气管与左侧集气装置的液面调至相平;
④打开分液漏斗活塞开始反应;
……
反应结束后量气管中气体体积为
 。则通常状况下气体摩尔体积
。则通常状况下气体摩尔体积
(6)若乙组同学的测定结果比理论值偏高,下列原因中可能的是
a.实验中硫酸不足
b.生成的
 未经干燥
未经干燥c.未等气体冷却至室温即进行读数
d.读数时量气管中液面高于左侧集气装置液面
您最近一年使用:0次
2020-11-17更新
|
211次组卷
|
2卷引用:上海市部分重点高中2020-2021学年高一上学期10月阶段性测试化学试题
名校
4 . 某课外实验小组设计的下列实验合理的是
A.配一定浓度硫酸 | B.制备少量氨气  |
C.制备并收集少量NO2 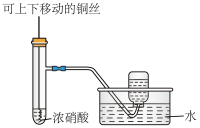 | D.制备少量氧气 |
您最近一年使用:0次
2020-10-31更新
|
193次组卷
|
7卷引用:上海市虹口区2016届高三12月第二次分层练习化学试题
上海市虹口区2016届高三12月第二次分层练习化学试题(已下线)上海虹口区2011届高三一模化学试题辽宁省丹东市2019—2020学年高三上学期期末考试理综化学试题福建省福州市福建师范大学附属中学2017-2018学年高一下学期期中考试化学试题河南省三门峡市2021届高三10月阶段性考试化学试题(已下线)第15单元 实验设计与评价(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷安徽省示范高中培优联盟2020-2021学年高二上学期冬季联赛化学试题
名校
解题方法
5 . 利用图示装置组合,能达到实验室制取气体目的的是( )

| A.大理石和稀硫酸反应,用②④制取二氧化碳,随时控制反应的发生与停止 |
| B.氯酸钾和二氧化锰混合,用①③制取氧气,不能随时控制反应的发生与停止 |
| C.双氧水和二氧化锰粉末,用②⑤制取氧气,随时控制反应的发生与停止 |
| D.锌粒和稀硫酸反应,用②③制取氢气,随时控制反应的发生与停止 |
您最近一年使用:0次
名校
6 . 实验室用二氧化锰和浓盐酸反应制备纯净、干燥的氯气,装置如图所示。

(1)写出仪器的名称:A______ 、B_______ ;
(2)C中装有的试剂是_______ ,它的作用除降低氯气在水中的溶解量外还包括_______ 。D中所盛试剂是浓硫酸,作用是_____ ;
(3)E采用的是______ 排空气法收集气体(填“向上”或“向下”);F中发生的化学反应为_______ ;
(4)某同学建议将F中的导管改为一个倒扣的漏斗,并使得漏斗下边缘与液面相切,这样改进的理由是______ ;
(5) 与浓盐酸反应时,每消耗
与浓盐酸反应时,每消耗 ,生成的
,生成的 在标况下的体积为
在标况下的体积为______ L;
(6)实验发现: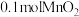 和
和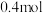 浓盐酸制得的氯气的产量往往远低于
浓盐酸制得的氯气的产量往往远低于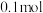 ,原因可能是
,原因可能是________ 。
(7)查资料得知:氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量 生成;
生成; 沸点为10℃,熔点为
沸点为10℃,熔点为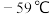 ,液体为红色;
,液体为红色; 沸点为
沸点为 ,液态为黄绿色。设计最简单的实验验证
,液态为黄绿色。设计最简单的实验验证 中是否含有
中是否含有 :
:______ 。

(1)写出仪器的名称:A
(2)C中装有的试剂是
(3)E采用的是
(4)某同学建议将F中的导管改为一个倒扣的漏斗,并使得漏斗下边缘与液面相切,这样改进的理由是
(5)
 与浓盐酸反应时,每消耗
与浓盐酸反应时,每消耗 ,生成的
,生成的 在标况下的体积为
在标况下的体积为(6)实验发现:
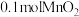 和
和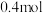 浓盐酸制得的氯气的产量往往远低于
浓盐酸制得的氯气的产量往往远低于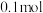 ,原因可能是
,原因可能是(7)查资料得知:氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量
 生成;
生成; 沸点为10℃,熔点为
沸点为10℃,熔点为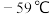 ,液体为红色;
,液体为红色; 沸点为
沸点为 ,液态为黄绿色。设计最简单的实验验证
,液态为黄绿色。设计最简单的实验验证 中是否含有
中是否含有 :
:
您最近一年使用:0次
2020-08-17更新
|
88次组卷
|
2卷引用:上海市金山中学2019-2020学年高一上学期期中考试化学试题
名校
7 . 氢化钙(CaH2)固体是登山运动常用的能源提供剂,氢化钙要封保存,一旦接触到水就发生反应生成氢氧化钙和氢气,氢化钙通常用氢气与金属钙加热制取,图1是模拟制取装置。


回答下列问题:
(1)利用图1实验装置进行实验,实验步骤如下:检查装置气密性后装入药品,打开分液漏斗活塞_____ (请按正确的顺序填入下列步骤的序号)。
①加热反应一段时间 ②收集气体并检验其纯度
③关闭分液漏斗活塞 ④停止加热,充分冷却
(2)为了确认进入装置C的氢气已经干燥,应在B、C之间再接一装置,该装置中加入的试剂是___ ,装置D的作用是________ 。
(3)某同学利用图2装置测定上述实验中得到的氢化钙的含量。他称取m g所制得的氢化钙样品,实验前后量气管中液面读数分别为V1 mL、V2 mL。(上述气体体积均换算为标准状况下)
①装置中导管a的作用是_______ 。
②如何判断样品与水完全反应:______ 。
③产生的氢气体积为________ mL。若未冷却至室温即读数,则氢化钙含量_______ (填“偏高”、“偏低”、“无影响”)。
(4)请你再设计一种氢化钙纯度的测定方法:__________ 。


回答下列问题:
(1)利用图1实验装置进行实验,实验步骤如下:检查装置气密性后装入药品,打开分液漏斗活塞
①加热反应一段时间 ②收集气体并检验其纯度
③关闭分液漏斗活塞 ④停止加热,充分冷却
(2)为了确认进入装置C的氢气已经干燥,应在B、C之间再接一装置,该装置中加入的试剂是
(3)某同学利用图2装置测定上述实验中得到的氢化钙的含量。他称取m g所制得的氢化钙样品,实验前后量气管中液面读数分别为V1 mL、V2 mL。(上述气体体积均换算为标准状况下)
①装置中导管a的作用是
②如何判断样品与水完全反应:
③产生的氢气体积为
(4)请你再设计一种氢化钙纯度的测定方法:
您最近一年使用:0次
2020-05-17更新
|
201次组卷
|
2卷引用:2019-2020学年上海市闵行区七宝中学高三下学期化学等级考练习(五)
名校
解题方法
8 . 探究铜和浓硫酸的反应,下列装置或操作错误的是
甲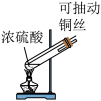 乙
乙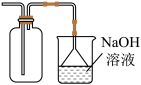 丙
丙
甲
 乙
乙 丙
丙
| A.上下移动装置甲中的铜丝可控制SO2的生成 |
| B.装置乙可用于收集SO2气体 |
| C.为确认甲中有CuSO4生成,向甲中反应后的试管中直接加水稀释,观察溶液颜色 |
| D.利用装置丙将硫酸铜溶液加热浓缩、冷却结晶,可析出CuSO4·5H2O晶体 |
您最近一年使用:0次
2020-04-22更新
|
397次组卷
|
6卷引用:天津市静海区第一中学2019-2020学年高一下学期期中考试(等级班)化学试题
名校
解题方法
9 . 某同学为了验证难溶的氯化银在水中也存在溶解平衡,设计了如下实验方案:( )
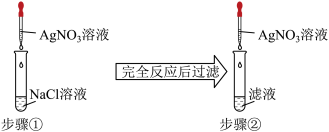

| A.步骤①中应加入过量的AgNO3溶液 |
| B.步骤①中应使NaCl溶液过量 |
| C.步骤②中现象是无沉淀产生 |
| D.步骤②中选用的AgNO3溶液浓度应小于步骤① |
您最近一年使用:0次
2020-04-03更新
|
219次组卷
|
2卷引用:2018年上海市高中学生化学竞赛(“华理一化工杯”)初赛试题
名校
解题方法
10 . 某同学采用BaSO4沉淀重量法测定样品中SO42-的含量时,发现滤液中有少许沉淀,检查滤纸并未破裂,此时他应该( )
| A.将滤液倒回漏斗重新过滤 |
| B.在漏斗中再加一张滤纸,将滤液重新过滤 |
| C.另取一漏斗,将滤液过滤后与原滤纸合并 |
| D.弃去,重新取样分析 |
您最近一年使用:0次
2020-04-03更新
|
141次组卷
|
2卷引用:2018年上海市高中学生化学竞赛(“华理一化工杯”)初赛试题



