名校
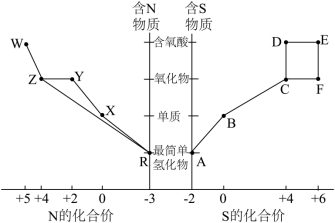
1 . I.元素的“价—类”二维图体现了化学变化之美。部分含硫、氮物质的类别与硫元素和氮元素化合价的对应关系如下图所示。
(1)写出实验室利用两种固体物质加热制备物质R的化学方程式___________ 。
(2)物质R→Y是工业制硝酸的重要反应,其化学方程式是___________ 。
(3)写出物质E的浓溶液与碳单质反应的化学方程式:___________ 。
(4)写出物质Z与水反应的离子方程式:___________ ,当反应消耗0.3mol物质Z时,转移电子数为___________ 。
(5)下列有关图中所示含N、S物质的叙述,正确的是___________(填标号)。
II.粗盐中含有泥沙及 、
、 、
、 等杂质,其提纯过程一般经过以下流程:
等杂质,其提纯过程一般经过以下流程: 溶液、
溶液、 溶液等药品以及必备的实验仪器若干。请回答下列问题:
溶液等药品以及必备的实验仪器若干。请回答下列问题:
(6)操作③按a、b、c顺序依次加入过量的试剂。若a为NaOH溶液,则c为___________ 。
(7)加盐酸调溶液pH的目的是___________ 。
(1)写出实验室利用两种固体物质加热制备物质R的化学方程式
(2)物质R→Y是工业制硝酸的重要反应,其化学方程式是
(3)写出物质E的浓溶液与碳单质反应的化学方程式:
(4)写出物质Z与水反应的离子方程式:
(5)下列有关图中所示含N、S物质的叙述,正确的是___________(填标号)。
| A.在催化剂的作用下,R可将Y、Z还原为X |
| B.图中所示的物质中,只有W、D、E属于电解质 |
| C.用玻璃棒分别蘸取浓的R溶液和浓的W溶液,玻璃棒靠近时有白烟产生 |
| D.Z、C、F均能与NaOH溶液反应,都是酸性氧化物 |
II.粗盐中含有泥沙及
 、
、 、
、 等杂质,其提纯过程一般经过以下流程:
等杂质,其提纯过程一般经过以下流程: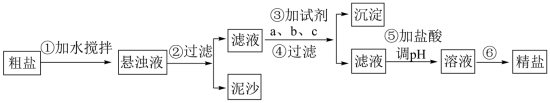
 溶液、
溶液、 溶液等药品以及必备的实验仪器若干。请回答下列问题:
溶液等药品以及必备的实验仪器若干。请回答下列问题:(6)操作③按a、b、c顺序依次加入过量的试剂。若a为NaOH溶液,则c为
(7)加盐酸调溶液pH的目的是
您最近一年使用:0次
解题方法
2 . 海洋是巨大的资源宝库,从海洋中获取部分资源的流程图如下:

回答下列问题:
Ⅰ.海水提溴
溴被称为“海洋元素”,空气吹出法从海水中提取溴单质的流程如下图所示:

(1)过程③中 所起的作用为
所起的作用为___________ (用离子方程式表示)
(2)上图过程①②③④中含Br元素的物质发生的变化依次为___________ ,___________ ,___________ ,___________ 。(选填字母标号并排序,选项可重复使用,也可不选用)
A.被氧化 B.被还原 C.未参与氧化还原反应
(3)步骤①已经获得 ,步骤②③④的目的是
,步骤②③④的目的是___________
Ⅱ.海水提镁
(4)该工业生产过程中,为了使 转化为
转化为 ,应加入的试剂为
,应加入的试剂为___________ (填化学式)。
(5)写出冶炼金属Mg的化学方程式___________ 。
Ⅲ.产品应用
(6)以下属于纯碱在日常生活或工业生产中的用途的有___________(填标号)。

回答下列问题:
Ⅰ.海水提溴
溴被称为“海洋元素”,空气吹出法从海水中提取溴单质的流程如下图所示:

(1)过程③中
 所起的作用为
所起的作用为(2)上图过程①②③④中含Br元素的物质发生的变化依次为
A.被氧化 B.被还原 C.未参与氧化还原反应
(3)步骤①已经获得
 ,步骤②③④的目的是
,步骤②③④的目的是Ⅱ.海水提镁
(4)该工业生产过程中,为了使
 转化为
转化为 ,应加入的试剂为
,应加入的试剂为(5)写出冶炼金属Mg的化学方程式
Ⅲ.产品应用
(6)以下属于纯碱在日常生活或工业生产中的用途的有___________(填标号)。
| A.抗酸药 | B.制玻璃 | C.去油污 | D.抗氧化剂 |
您最近一年使用:0次
名校
解题方法
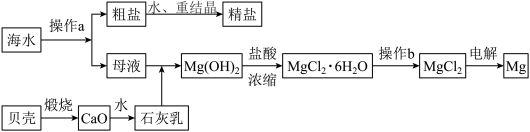
3 . 海水是一种丰富的资源,工业上可从海水中提取多种物质,广泛应用于生活、生产、科技等方面。下图是某工厂对海水资源进行综合利用的示意图。
回答下列问题:
(1)海水淡化的方法主要有_____ (填任意一种)。
(2)从离子反应的角度思考,往海水中加入石灰乳的作用是_____ 。
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是_____ (填具体操作)。
②操作b是在若在空气中加热,则会生成Mg(OH)2,写出有关反应的化学方程式:_____ 。
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为_____ ,从考虑成本和废物循环利用的角度,副产物氯气可以用于_____ 。

回答下列问题:
(1)海水淡化的方法主要有
(2)从离子反应的角度思考,往海水中加入石灰乳的作用是
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是
②操作b是在若在空气中加热,则会生成Mg(OH)2,写出有关反应的化学方程式:
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为
您最近一年使用:0次
名校
4 . 氯碱工业中使用的粗盐一般来自海水,粗盐中含有 、
、 、
、 等杂质。
等杂质。
(1)实验室中用粗盐制成精盐过程中通常经过以下步骤:
①粗盐加水溶解;
②向溶液中加入过量氢氧化钠溶液;
③加入___________ 溶液;
④加入___________ 溶液;
⑤___________ (填操作方法);
⑥加入盐酸调节pH近似为7;
⑦___________ (填操作方法);
其中⑤⑥⑦三个操作都会用到的玻璃仪器是___________ ,它在⑤中的作用是___________ 。
(2)在下图的电解装置中装入精制后的饱和食盐水并电解。
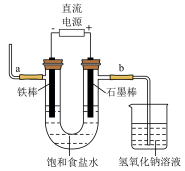
①写出电解饱和食盐水的化学方程式:___________ ;
②写出a处产生气体的一种用途:___________ ;
③写出与b连接的石墨棒上的电极反应式:___________ ;
④同样条件下收集的气体体积b处___________ a处(填“>”、“=”或“<”),原因是___________ 。
 、
、 、
、 等杂质。
等杂质。(1)实验室中用粗盐制成精盐过程中通常经过以下步骤:
①粗盐加水溶解;
②向溶液中加入过量氢氧化钠溶液;
③加入
④加入
⑤
⑥加入盐酸调节pH近似为7;
⑦
其中⑤⑥⑦三个操作都会用到的玻璃仪器是
(2)在下图的电解装置中装入精制后的饱和食盐水并电解。

①写出电解饱和食盐水的化学方程式:
②写出a处产生气体的一种用途:
③写出与b连接的石墨棒上的电极反应式:
④同样条件下收集的气体体积b处
您最近一年使用:0次
解题方法
5 . 海水中化学资源的综合开发利用,已受到各国的高度重视。Br2和Mg等两种单质都可以从海水中提取,如图为提取它们的主要步骤:

请回答:
Ⅰ.从海水中提取的溴占世界溴年产量的三分之一,主要方法就是上述流程中的空气吹出法。
(1)吸收塔中反应的离子方程式是______ ,工业生产1mol高浓度Br2,理论上需要Cl2的物质的量为______ 。
(2)10L海水经过提纯浓缩,向吸收塔吸收后的溶液中加入0.100mol/LAgNO3溶液8.0mL恰好完全反应,则海水中含溴的含量为______ mg/L(不考虑提纯过程中溴的损失)。
Ⅱ.镁及其合金是用途很广的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的。
(1)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用______ (写化学式)。
(2)步骤①包括______ 、______ 、过滤、洗涤、干燥。
(3)通电时无水MgCl2在熔融状态下反应的化学方程式是______ 。

请回答:
Ⅰ.从海水中提取的溴占世界溴年产量的三分之一,主要方法就是上述流程中的空气吹出法。
(1)吸收塔中反应的离子方程式是
(2)10L海水经过提纯浓缩,向吸收塔吸收后的溶液中加入0.100mol/LAgNO3溶液8.0mL恰好完全反应,则海水中含溴的含量为
Ⅱ.镁及其合金是用途很广的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的。
(1)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用
(2)步骤①包括
(3)通电时无水MgCl2在熔融状态下反应的化学方程式是
您最近一年使用:0次
解题方法
6 . 浩瀚的海洋是一个巨大的宝库,蕴含有80多种元素,如H、O、Cl、Na、K、Mg、Ca、S、Br等,可供提取利用的达50多种。
(1)下列物质不需要通过化学变化就能够从海水中获得的是___________ 。
A.食盐 B.金属钠 C.淡水 D.液溴
(2)“氯碱工业”是现代化学工业的重要支柱之一,其主要反应的化学方程式为: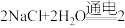
___________  。
。
(3)以下是从海水中提取各种物质的流程图,根据图给信息回答:

i.操作①的名称是___________ 。
ii.产物D为___________ 色。写出反应②的离子方程式:___________ 。
iii.B在工业上可用于生产盐酸,请举出B在工业上的另一种用途___________ (用化学方程式表示)。
(1)下列物质不需要通过化学变化就能够从海水中获得的是
A.食盐 B.金属钠 C.淡水 D.液溴
(2)“氯碱工业”是现代化学工业的重要支柱之一,其主要反应的化学方程式为:
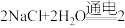
 。
。(3)以下是从海水中提取各种物质的流程图,根据图给信息回答:

i.操作①的名称是
ii.产物D为
iii.B在工业上可用于生产盐酸,请举出B在工业上的另一种用途
您最近一年使用:0次
解题方法
7 . 海水中含有丰富的自然资源,溶解着大量的 、
、 、
、 、
、 、
、 元素,其化合物在工农业生产中用途广泛,从海水中提取液溴的同时制取
元素,其化合物在工农业生产中用途广泛,从海水中提取液溴的同时制取 晶体的流程如下:
晶体的流程如下:
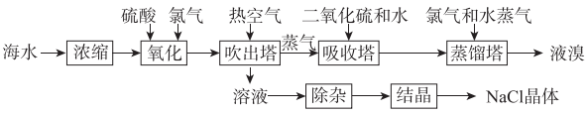
回答下列问题:
(1)“浓缩”的目的是___________ (任答1条即可)。
(2)流程中可用热空气吹出溴的原因为___________ (填选项字母)。
A.溴的氧化性较强 B.溴的熔点较低 C.溴的挥发性较强 D.溴在水中的溶解度较低
(3)上述流程中涉及的氧化还原反应有___________ 个。
(4)“吸收塔”中发生反应的离子方程式为___________ 。
(5)根据除杂原理,在表中填写“除杂”时依次添加的试剂及其预期除去的离子。
(6)制取 晶体的“结晶”操作为
晶体的“结晶”操作为___________ 。
 、
、 、
、 、
、 、
、 元素,其化合物在工农业生产中用途广泛,从海水中提取液溴的同时制取
元素,其化合物在工农业生产中用途广泛,从海水中提取液溴的同时制取 晶体的流程如下:
晶体的流程如下:
回答下列问题:
(1)“浓缩”的目的是
(2)流程中可用热空气吹出溴的原因为
A.溴的氧化性较强 B.溴的熔点较低 C.溴的挥发性较强 D.溴在水中的溶解度较低
(3)上述流程中涉及的氧化还原反应有
(4)“吸收塔”中发生反应的离子方程式为
(5)根据除杂原理,在表中填写“除杂”时依次添加的试剂及其预期除去的离子。
| 实验步骤 | 试剂 | 预期除去的离子 |
| 步骤1 |  |  |
| 步骤2 | ① | ② |
| 步骤3 |  | ③ |
| 步骤4 | ④ |  |
(6)制取
 晶体的“结晶”操作为
晶体的“结晶”操作为
您最近一年使用:0次
2021-07-10更新
|
315次组卷
|
3卷引用:广东省肇庆市2020-2021学年高一下学期期末教学质量检测化学试题
广东省肇庆市2020-2021学年高一下学期期末教学质量检测化学试题湖北省黄冈市2021-2022学年高一下学期期末考试化学试题(已下线)【期末复习】必刷题(4)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)
8 . 镁及其合金是用途很广的金属材料,目前世界上60%的镁是从海水中提取的。如图是工业上提镁的流程。
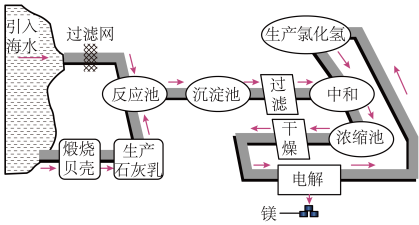
(1)电解熔融MgCl2制金属镁的化学方程式是________ 。
(2)“反应池’→……→‘中和’”过程的主要作用:①除去海水中的其他杂质;②________ 。
(3)“中和”时,Mg(OH)2与盐酸发生反应的离子方程式是________ 。
(4)在上述流程中,可循环使用的物质是________ 。

(1)电解熔融MgCl2制金属镁的化学方程式是
(2)“反应池’→……→‘中和’”过程的主要作用:①除去海水中的其他杂质;②
(3)“中和”时,Mg(OH)2与盐酸发生反应的离子方程式是
(4)在上述流程中,可循环使用的物质是
您最近一年使用:0次
9 . 下列说法正确的是
| A.工业上利用二氧化硅和焦炭在高温下反应制得单质硅和二氧化碳的原理制取粗硅 |
| B.海水是一个巨大的宝藏,氯、溴、碘、硫、钠、钾等重要元素主要来自于海水 |
C.工业上利用 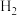 和 和  光照下反应生成 HCl,再将其溶于水生产盐酸 光照下反应生成 HCl,再将其溶于水生产盐酸 |
D.高炉炼铁得到的铁是含碳 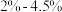 的生铁,通过炼制生铁可以得到用途更广泛的钢,钢的含碳量比生铁低 的生铁,通过炼制生铁可以得到用途更广泛的钢,钢的含碳量比生铁低 |
您最近一年使用:0次
名校
解题方法
10 . 海水中化学资源的综合开发利用,已受到各国的高度重视。Br2和Mg等两种单质都可以从海水中提取,如图为提取它们的主要步骤:
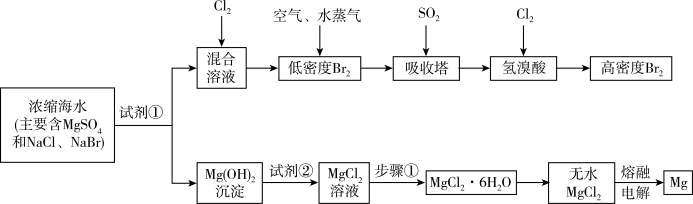
请回答:
Ⅰ.从海水中提取的溴占世界溴年产量的三分之一,主要方法就是上述流程中的空气吹出法。
(1)制取Br2时第一次通入Cl2时发生反应的离子方程式是_________ 。
(2)吸收塔中反应的离子方程式是_______ ,工业生产1mol Br2,理论上需要Cl2的物质的量为______ 。
(3)取10L海水经过提纯浓缩,向吸收塔吸收后的溶液中加入0.100 mol/L AgNO3溶液8.0 mL恰好完全反应,则海水中含溴的含量为______ mg/L(不考虑提纯过程中溴的损失)。
Ⅱ.镁及其合金是用途很广的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的。
(1)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用__________ (写化学式)。
(2)步骤①包括加热、蒸发、冷却、结晶、____________ 。
(3)通电时无水MgCl2在熔融状态下反应的化学方程式是_______________ 。

请回答:
Ⅰ.从海水中提取的溴占世界溴年产量的三分之一,主要方法就是上述流程中的空气吹出法。
(1)制取Br2时第一次通入Cl2时发生反应的离子方程式是
(2)吸收塔中反应的离子方程式是
(3)取10L海水经过提纯浓缩,向吸收塔吸收后的溶液中加入0.100 mol/L AgNO3溶液8.0 mL恰好完全反应,则海水中含溴的含量为
Ⅱ.镁及其合金是用途很广的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的。
(1)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用
(2)步骤①包括加热、蒸发、冷却、结晶、
(3)通电时无水MgCl2在熔融状态下反应的化学方程式是
您最近一年使用:0次
2020-06-05更新
|
323次组卷
|
3卷引用:四川省成都外国语学校2019-2020学年高一下学期期中考试化学试题
四川省成都外国语学校2019-2020学年高一下学期期中考试化学试题(已下线)第08练 自然资源的开发利用-2020年【衔接教材·暑假作业】新高二化学(人教版)河北省安平中学2020-2021学年高一上学期12月月考化学试题



