1 . 从海水中可提取多种化工原料,如图是工业上对海水的几项综合利用过程的示意图:
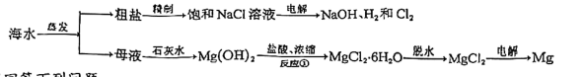
试回答下列问题:
(1)海水中按照质量分数,元素含量最多的前四位元素是___________。
(2)已知海水在浓缩过程中析出盐的种类和质量(单位:g·L-1)
根据上表信息,海水晒盐___________ (选填“需要”或“不需要”)将海水晒干,若选不需要,海水密度应该控制在___________ (选填范围)之内。
(3)如果粗盐中 含量较高,必须添加钡试剂除去
含量较高,必须添加钡试剂除去 ,该钡试剂可以是___________。
,该钡试剂可以是___________。
(4)有效除去 、
、 、
、 ,入试剂不合理的操作顺序为___________。
,入试剂不合理的操作顺序为___________。
(5)写出电解饱和氯化钠溶液的化学方程式:___________ 。
(6)阴极区的产物是___________ 。
(7)如何检验阳极产物?___________ 。(结合方程式解释)
(8)请写出反应①的反应方程式___________ 。
(9)工业上用电解饱和食盐水后的产物来制备氯化氢,其中___________ (填物质)稍微过量,火焰的颜色为___________ 。
(10)海水中硫元素为高价态,而在自然界中硫有各种价态,Na2S2O3中S的价态为___________ ;连多硫酸钠(Na2SmO6)中S的价态为___________ 。

试回答下列问题:
(1)海水中按照质量分数,元素含量最多的前四位元素是___________。
| A.O、H、Cl、Na | B.H、O、Na、Cl |
| C.Cl、Na、S、Ca | D.Na、Cl、Mg、S |
| 海水密度(g·mL-1) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
(3)如果粗盐中
 含量较高,必须添加钡试剂除去
含量较高,必须添加钡试剂除去 ,该钡试剂可以是___________。
,该钡试剂可以是___________。| A.Ba(OH)2 | B.Ba(NO3)2 | C.BaCl2 | D.BaSO4 |
 、
、 、
、 ,入试剂不合理的操作顺序为___________。
,入试剂不合理的操作顺序为___________。| A.NaOH、Na2CO3、钡试剂、盐酸、过滤 |
| B.NaOH、钡试剂、Na2CO3、过滤、盐酸 |
| C.钡试剂、NaOH、Na2CO3、过滤、盐酸 |
| D.钡试剂、Na2CO3、NaOH、过滤、盐酸 |
(6)阴极区的产物是
(7)如何检验阳极产物?
(8)请写出反应①的反应方程式
(9)工业上用电解饱和食盐水后的产物来制备氯化氢,其中
(10)海水中硫元素为高价态,而在自然界中硫有各种价态,Na2S2O3中S的价态为
您最近一年使用:0次
21-22高一上·浙江·阶段练习
解题方法
2 . 海水中含有多种盐类物质,在一定温度下将海水不断浓缩,其间会不断有晶体析出,且海水的密度逐渐增大,表中为一定温度下不同密度的海水中几种盐类的含量(g/mL)。
回答下列问题:
(1)在海水晒盐的过程中,卤水的密度应该控制在什么范围内?_____
(2)恒温下,当蒸发1m3密度为1.22g/mL的海水达到密度为1.26g/mL时,析出MgSO4的质量为_____ kg,析出NaCl的质量为_____ kg。
(3)请画出能较正确地反映浓缩过程中海水中NaCl的质量分数(A%)与海水密度(d)(密度区间为1.13g/mL-1.31g/mL)的关系图_____ 。
| 海水密度(g/mL) | CaSO4(g/L) | NaCl(g/L) | MgCl2(g/L) | MgSO4(g/L) | NaBr(g/L) |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
回答下列问题:
(1)在海水晒盐的过程中,卤水的密度应该控制在什么范围内?
(2)恒温下,当蒸发1m3密度为1.22g/mL的海水达到密度为1.26g/mL时,析出MgSO4的质量为
(3)请画出能较正确地反映浓缩过程中海水中NaCl的质量分数(A%)与海水密度(d)(密度区间为1.13g/mL-1.31g/mL)的关系图
您最近一年使用:0次
名校
解题方法
3 . 食盐是日常生活的必需品,也是重要的化工原料。试剂级NaCl可用海盐(含泥沙、海藻、K+、Ca2+、Mg2+、Fe3+、SO 等杂质)为原料制备。实验室提纯NaCl的流程如图:
等杂质)为原料制备。实验室提纯NaCl的流程如图:
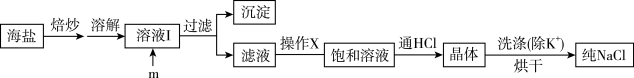
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳
(1)欲除去溶液I中的Ca2+、Mg2+、Fe3+、 ,在提供的试剂中,选出m所代表的试剂,按滴加顺序依次为
,在提供的试剂中,选出m所代表的试剂,按滴加顺序依次为_______ 、NaOH、_______ (只填化学式);洗涤除去NaCl晶体表面附带的少量KCl,在提供的试剂中,选用的试剂为_______ 。
(2)操作X为用提纯的NaCl配制500mL 4.00mol/L NaCl溶液,所用的玻璃仪器除烧杯、玻璃棒外还有_______ (填仪器名称)
(3)用如图所示装置,以焙炒后的海盐为原料制备HCl气体,并通入NaCl饱和溶液中使NaCl结晶析出。
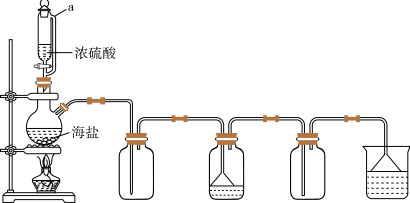
①用浓硫酸和海盐混合加热制取氯化氢利用了浓硫酸的性质是_______ (填编号),相比分液漏斗,选用仪器a的优点是_______ 。
a.高沸点 b.强酸性 c.强氧化性
②对比实验发现,将烧瓶中的海盐磨细可加快NaCl晶体的析出,其原因是_______ 。
(4)设计实验测定NaCl产品中SO 的含量,填写表格。
的含量,填写表格。
 等杂质)为原料制备。实验室提纯NaCl的流程如图:
等杂质)为原料制备。实验室提纯NaCl的流程如图:
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳
(1)欲除去溶液I中的Ca2+、Mg2+、Fe3+、
 ,在提供的试剂中,选出m所代表的试剂,按滴加顺序依次为
,在提供的试剂中,选出m所代表的试剂,按滴加顺序依次为(2)操作X为用提纯的NaCl配制500mL 4.00mol/L NaCl溶液,所用的玻璃仪器除烧杯、玻璃棒外还有
(3)用如图所示装置,以焙炒后的海盐为原料制备HCl气体,并通入NaCl饱和溶液中使NaCl结晶析出。

①用浓硫酸和海盐混合加热制取氯化氢利用了浓硫酸的性质是
a.高沸点 b.强酸性 c.强氧化性
②对比实验发现,将烧瓶中的海盐磨细可加快NaCl晶体的析出,其原因是
(4)设计实验测定NaCl产品中SO
 的含量,填写表格。
的含量,填写表格。| 操作 | 目的/结论 | |
| ① | 称取样品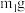 ,加水溶解,加盐酸调至弱酸性,滴加过量c1mol/LBaCl2溶液V1mL ,加水溶解,加盐酸调至弱酸性,滴加过量c1mol/LBaCl2溶液V1mL | 目的: |
| ② | 过滤洗涤,干燥后称得沉淀为m2g | 结论:样品中SO 的质量分数为 的质量分数为 |
您最近一年使用:0次
2021-04-11更新
|
275次组卷
|
3卷引用:上海市青浦区2021届高三等级考二模化学试题
名校
4 . 含钠化合物在工业生产和日常生活中应用广泛,请回答下列有关问题:
(1)钠元素的碱性氧化物的化学式为___________ ,钠另一种氧化物是一种淡黄色固体,写出其用于呼吸面具供氧剂的一个化学方程式:___________ 。
(2)NaOH是一种强碱,若实验室用NaOH浓溶液配制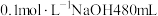 ,需量取密度为
,需量取密度为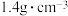 质量分数为40%的NaOH溶液
质量分数为40%的NaOH溶液___________ mL,该实验所需的玻璃仪器除玻璃棒、量筒、烧杯之外,还有___________ ,若量取浓NaOH溶液时俯视,则最终配制溶液浓度___________ (填“偏大”、“偏小”或“无影响”)。当450mL所配溶液与标准状况下672mLCO2恰好反应时,发生反应的离子方程式为___________ 。
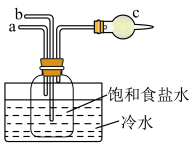
(3)如图是实验室模拟“侯氏制碱法”制取NaHCO3的部分装置。下列说正确的是___________(填序号)
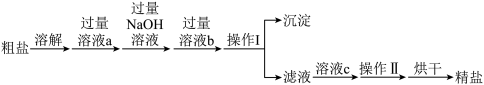
(4)粗盐常含有少量 以及泥沙等杂质,实验室中可用如下流程提纯NaCl,下列说法中正确的是___________(填序号)
以及泥沙等杂质,实验室中可用如下流程提纯NaCl,下列说法中正确的是___________(填序号)
(1)钠元素的碱性氧化物的化学式为
(2)NaOH是一种强碱,若实验室用NaOH浓溶液配制
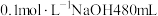 ,需量取密度为
,需量取密度为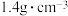 质量分数为40%的NaOH溶液
质量分数为40%的NaOH溶液(3)如图是实验室模拟“侯氏制碱法”制取NaHCO3的部分装置。下列说正确的是___________(填序号)

| A.a先通入CO2,然后b通入NH3,c中放碱石灰 |
| B.b先通入NH3,然后a通入CO2,c中放碱石灰 |
| C.a先通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉 |
| D.b先通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉 |
(4)粗盐常含有少量
 以及泥沙等杂质,实验室中可用如下流程提纯NaCl,下列说法中正确的是___________(填序号)
以及泥沙等杂质,实验室中可用如下流程提纯NaCl,下列说法中正确的是___________(填序号)
| A.溶液a和NaOH可用一种试剂来代替 |
| B.溶液a和溶液b的添加顺序可以互换 |
| C.操作Ⅱ为蒸发结晶,蒸发过程中当蒸发皿中有大量晶体析出时停止加热 |
| D.粗盐提纯的整个操作过程中共有两处需要使用玻璃棒 |
您最近一年使用:0次
名校
解题方法
5 . 菜之魂在味,在“七味八滋”中,盐应是百味之首。粗盐常含有少量 、
、 、
、 以及泥沙等杂质,实验室中提纯
以及泥沙等杂质,实验室中提纯 的流程如图所示。
的流程如图所示。
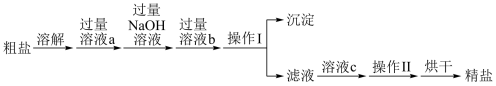
回答下列问题:
(1)操作I需要使用的玻璃仪器是___________ (填仪器名称)。
(2)溶液a和溶液b分别为___________ 溶液和___________ 溶液,加入过量溶液b的目的是___________ 和___________ (用离子方程式表示)。
(3)说明溶液c已经足量的现象为___________ 。
(4)称取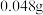 精盐,配制成
精盐,配制成 溶液;量取
溶液;量取 与
与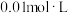 的
的 溶液反应,消耗
溶液反应,消耗 溶液的体积为
溶液的体积为 ,则该精盐样品中
,则该精盐样品中 的质量分数是
的质量分数是___________ 。
 、
、 、
、 以及泥沙等杂质,实验室中提纯
以及泥沙等杂质,实验室中提纯 的流程如图所示。
的流程如图所示。
回答下列问题:
(1)操作I需要使用的玻璃仪器是
(2)溶液a和溶液b分别为
(3)说明溶液c已经足量的现象为
(4)称取
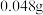 精盐,配制成
精盐,配制成 溶液;量取
溶液;量取 与
与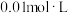 的
的 溶液反应,消耗
溶液反应,消耗 溶液的体积为
溶液的体积为 ,则该精盐样品中
,则该精盐样品中 的质量分数是
的质量分数是
您最近一年使用:0次
2022高一·上海·专题练习
名校
解题方法
6 . 如图所示是利用海水提取粗盐的过程:

根据海水晒盐的原理,下列说法中错误的是

根据海水晒盐的原理,下列说法中错误的是
| A.海水进入贮水池,海水的成分基本不变 |
| B.析出晶体后的母液是氯化钠的饱和溶液 |
| C.在蒸发池中,海水中氯化钠的质量分数逐渐增加 |
| D.在蒸发池中,海水中水的质量逐渐增加 |
您最近一年使用:0次
2022-08-24更新
|
140次组卷
|
3卷引用:2.1.1 粗盐的提纯和氯碱工业-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)
(已下线)2.1.1 粗盐的提纯和氯碱工业-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)上海市华东师范大学第三附属中学2022-2023学年高一上学期期中考试化学试题云南省龙陵县第一中学2022-2023学年高一下学期期末考试化学试题
名校
7 . 海水的综合利用是当今的热点话题之一,根据所学知识,回答下列问题:
Ⅰ.通过海水晾晒可得粗盐,粗盐中除含有 外,还含有可溶性的
外,还含有可溶性的 等杂质。
等杂质。
(1)可以通过如下操作进行除杂:①加入稍过量的 溶液;②加入稍过量的
溶液;②加入稍过量的 溶液;③加入稍过量的
溶液;③加入稍过量的 溶液;④加入稀盐酸直至无气泡产生;⑤过滤。其中正确的操作顺序为_______(填标号)。
溶液;④加入稀盐酸直至无气泡产生;⑤过滤。其中正确的操作顺序为_______(填标号)。
Ⅱ.利用海水可以缓解煤燃烧过程中排放的 造成的环境问题,其工艺流程如图所示:
造成的环境问题,其工艺流程如图所示:
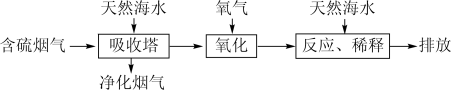
(2)天然海水 吸收含硫烟气后,会溶有
吸收含硫烟气后,会溶有 等分子或离子,需要用氧气进行“氧化”处理,写出
等分子或离子,需要用氧气进行“氧化”处理,写出 参加反应的离子方程式:
参加反应的离子方程式:_______ 。
(3)“氧化”后的海水需用大量天然海水与之混合后才能排放。该操作的主要目的是_______ 。
Ⅲ.海水中溴(以 形式存在)的含量约为
形式存在)的含量约为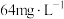 ,从海水中提取溴的工艺流程如下:
,从海水中提取溴的工艺流程如下:
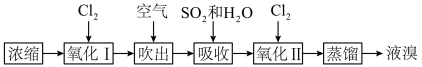
(4)海水中
_______  。
。
(5) 可用热空气“吹出”,热空气的温度一般控制在90℃,理由是
可用热空气“吹出”,热空气的温度一般控制在90℃,理由是_______ 。
(6)蒸馏操作所需要的玻璃仪器有酒精灯、温度计、蒸馏烧瓶、尾接管(牛角管)以及_______ 。
(7)“吸收”过程发生反应的离子方程式为_______ 。
Ⅰ.通过海水晾晒可得粗盐,粗盐中除含有
 外,还含有可溶性的
外,还含有可溶性的 等杂质。
等杂质。(1)可以通过如下操作进行除杂:①加入稍过量的
 溶液;②加入稍过量的
溶液;②加入稍过量的 溶液;③加入稍过量的
溶液;③加入稍过量的 溶液;④加入稀盐酸直至无气泡产生;⑤过滤。其中正确的操作顺序为_______(填标号)。
溶液;④加入稀盐酸直至无气泡产生;⑤过滤。其中正确的操作顺序为_______(填标号)。| A.①②③⑤④ | B.②①③⑤④ | C.③②①④⑤ | D.③②①⑤④ |
Ⅱ.利用海水可以缓解煤燃烧过程中排放的
 造成的环境问题,其工艺流程如图所示:
造成的环境问题,其工艺流程如图所示:
(2)天然海水
 吸收含硫烟气后,会溶有
吸收含硫烟气后,会溶有 等分子或离子,需要用氧气进行“氧化”处理,写出
等分子或离子,需要用氧气进行“氧化”处理,写出 参加反应的离子方程式:
参加反应的离子方程式:(3)“氧化”后的海水需用大量天然海水与之混合后才能排放。该操作的主要目的是
Ⅲ.海水中溴(以
 形式存在)的含量约为
形式存在)的含量约为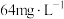 ,从海水中提取溴的工艺流程如下:
,从海水中提取溴的工艺流程如下:
(4)海水中

 。
。(5)
 可用热空气“吹出”,热空气的温度一般控制在90℃,理由是
可用热空气“吹出”,热空气的温度一般控制在90℃,理由是(6)蒸馏操作所需要的玻璃仪器有酒精灯、温度计、蒸馏烧瓶、尾接管(牛角管)以及
(7)“吸收”过程发生反应的离子方程式为
您最近一年使用:0次
名校
8 . 通过海水晾晒可得粗盐,粗盐中除含有 外,还含有
外,还含有 以及泥沙等杂质。制备精盐的各步操作流程如下:
以及泥沙等杂质。制备精盐的各步操作流程如下:
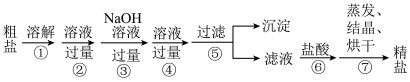
(1)为除去 ,步骤
,步骤 需加入以下三种溶液(用于沉淀的试剂稍过量)加入的顺序为
需加入以下三种溶液(用于沉淀的试剂稍过量)加入的顺序为___________ (填字母)。
A. B.
B. C.
C.
(2)在第③步操作中,选择的除杂试剂不能是 溶液,理由是
溶液,理由是___________ 。
(3)第⑤步操作中,需要的玻璃仪器有___________ 。
 是一种重要的杀菌消毒剂,可通过上述制取的精制食盐水通过以下流程制备:
是一种重要的杀菌消毒剂,可通过上述制取的精制食盐水通过以下流程制备:
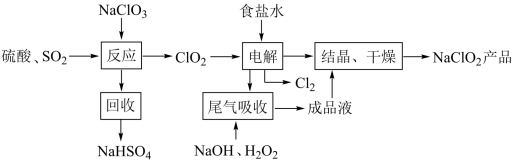
(4) 中
中 的化合价为
的化合价为___________ 。
(5)写出“反应步骤中生成 的化学方程式
的化学方程式___________ 。
(6)“尾气吸收”是吸收“电解”过程排出的少量 ,发生如下反应:
,发生如下反应: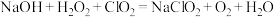
①配平化学方程式,并用单线桥表示电子转移方向和数目___________ 。
②此吸收反应中,氧化产物是___________ ,氧化剂与还原剂的个数比为___________ 。
③比较氧化性:
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(7)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克 的氧化能力。
的氧化能力。 的有效氯含量为
的有效氯含量为___________ g。(计算结果保留两位小数)
 外,还含有
外,还含有 以及泥沙等杂质。制备精盐的各步操作流程如下:
以及泥沙等杂质。制备精盐的各步操作流程如下:
(1)为除去
 ,步骤
,步骤 需加入以下三种溶液(用于沉淀的试剂稍过量)加入的顺序为
需加入以下三种溶液(用于沉淀的试剂稍过量)加入的顺序为A.
 B.
B. C.
C.
(2)在第③步操作中,选择的除杂试剂不能是
 溶液,理由是
溶液,理由是(3)第⑤步操作中,需要的玻璃仪器有
 是一种重要的杀菌消毒剂,可通过上述制取的精制食盐水通过以下流程制备:
是一种重要的杀菌消毒剂,可通过上述制取的精制食盐水通过以下流程制备:
(4)
 中
中 的化合价为
的化合价为(5)写出“反应步骤中生成
 的化学方程式
的化学方程式(6)“尾气吸收”是吸收“电解”过程排出的少量
 ,发生如下反应:
,发生如下反应: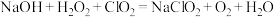
①配平化学方程式,并用单线桥表示电子转移方向和数目
②此吸收反应中,氧化产物是
③比较氧化性:

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(7)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力。
的氧化能力。 的有效氯含量为
的有效氯含量为
您最近一年使用:0次
9 . 海洋是一个巨大的化学资源宝库,其中含量较高的离子有
A. | B. | C. | D. |
您最近一年使用:0次
23-24高一下·全国·课前预习
10 . 海水中盐的开发利用
(1)海水中溶解和悬浮着大量的_____ 和_____ 。海水中含量最多的_____ 两种元素,加上Cl、Na、Mg、S、Ca、K、Br、C、Sr、B、F元素,其总含量超过99%,其他元素为_____ 。虽然海水中元素的种类很多,总储量_____ ,但许多元素的富集程度却_____ 。
(2)海水制盐从海水中制得的氯化钠,可以食用,同时也是生产烧碱、纯碱、钠、氯气、盐酸等的化工原料。
①氯碱工业:电解饱和食盐水,可生产氢氧化钠、氢气和氯气。
化学反应方程式:_____ 。
②制钠和氯气:_____ 。
③制盐酸:_____ 。
④制漂白剂(84消毒液):_____ 。
⑤制纯碱:_____ ;_____ 。
(1)海水中溶解和悬浮着大量的
(2)海水制盐从海水中制得的氯化钠,可以食用,同时也是生产烧碱、纯碱、钠、氯气、盐酸等的化工原料。
①氯碱工业:电解饱和食盐水,可生产氢氧化钠、氢气和氯气。
化学反应方程式:
②制钠和氯气:
③制盐酸:
④制漂白剂(84消毒液):
⑤制纯碱:
您最近一年使用:0次



