名校
1 . 从海水(含 )中提溴
)中提溴 ,常用
,常用 做吸收剂。
做吸收剂。
资料:ⅰ. 在碱性溶液中可转化为
在碱性溶液中可转化为 (有强氧化性)和
(有强氧化性)和 。
。
ⅱ. ,深红棕色液体,易挥发。
,深红棕色液体,易挥发。
(1)向 溶液中滴加酚酞,溶液变红,说明
溶液中滴加酚酞,溶液变红,说明 溶液呈
溶液呈_______ 性。
(2)从海水中提溴的流程示意如下:
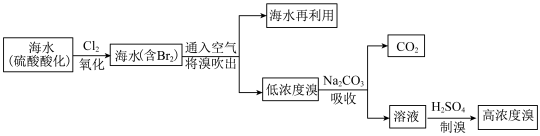
①海水中含大量 、
、 、
、 、
、 、
、 等离子,硫酸酸化能除去的离子是
等离子,硫酸酸化能除去的离子是_______ 。
②“氧化”过程体现出氧化性,
_______  (填“>”或“<”)。
(填“>”或“<”)。
③ 可用热空气吹出,原因是
可用热空气吹出,原因是_______ 。
④低浓度溴中含 、
、 ,吸收过程反应如下:
,吸收过程反应如下:
ⅰ.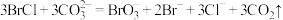
ⅱ._______
⑤“制溴”过程生成 的离子方程式是
的离子方程式是_______ 。
⑥“制溴”过程,用 而不用
而不用 ,可能的原因是
,可能的原因是_______ 。
 )中提溴
)中提溴 ,常用
,常用 做吸收剂。
做吸收剂。资料:ⅰ.
 在碱性溶液中可转化为
在碱性溶液中可转化为 (有强氧化性)和
(有强氧化性)和 。
。ⅱ.
 ,深红棕色液体,易挥发。
,深红棕色液体,易挥发。(1)向
 溶液中滴加酚酞,溶液变红,说明
溶液中滴加酚酞,溶液变红,说明 溶液呈
溶液呈(2)从海水中提溴的流程示意如下:

①海水中含大量
 、
、 、
、 、
、 、
、 等离子,硫酸酸化能除去的离子是
等离子,硫酸酸化能除去的离子是②“氧化”过程体现出氧化性,

 (填“>”或“<”)。
(填“>”或“<”)。③
 可用热空气吹出,原因是
可用热空气吹出,原因是④低浓度溴中含
 、
、 ,吸收过程反应如下:
,吸收过程反应如下:ⅰ.
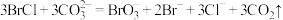
ⅱ.
⑤“制溴”过程生成
 的离子方程式是
的离子方程式是⑥“制溴”过程,用
 而不用
而不用 ,可能的原因是
,可能的原因是
您最近一年使用:0次
2023-06-05更新
|
71次组卷
|
2卷引用:北京市顺义区第一中学2022-2023学年高一下学期月考化学试题
名校
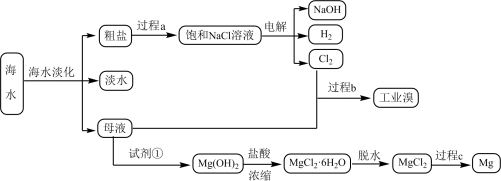
2 . 海水中化学元素的利用是指从海水中提取钠、镁、氯、溴等元素。

(1)海水晒盐使用的盐田法,相当于化学中的___________ 操作。
(2)关于海水的综合利用,以下说法正确的是___________ 。
A.从海水中提溴、镁元素,都包含氧化还原反应
B.利用潮汐发电是将电能转化为动能
C.海域辽阔,所以可以将废水排入海洋
(3)某同学利用食盐进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是___________ 。
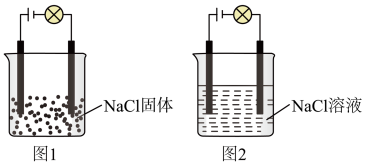
A. 固体不导电,不是电解质
固体不导电,不是电解质
B.电解质本身不一定能导电
C.图2中水是电解质,电离产生大量的
(4)过程 用于海水提溴。主要工业生产流程如下图所示。
用于海水提溴。主要工业生产流程如下图所示。

①向苦卤中通入 ,利用了
,利用了 的
的___________ ,
②吹出塔中通入热空气吹出 ,利用了
,利用了 的
的___________ 。
A.氧化性 B.还原性
C.挥发性,沸点比水低 D.易溶于水
(5)从海水中提取的粗盐精制后,通过电解饱和食盐水得到一系列化工产品。
①请写出电解饱和食盐水的化学方程式___________ 。
②检验阳极产物的方法为___________ 。
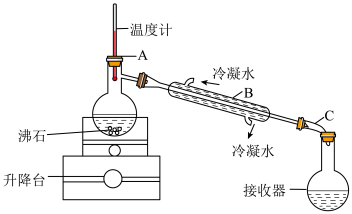
(6)实验室可以利用蒸馏的方法进行海水淡化,可选用如图装置完成。该装置中有一处明显的错误是___________ 。

(1)海水晒盐使用的盐田法,相当于化学中的
(2)关于海水的综合利用,以下说法正确的是
A.从海水中提溴、镁元素,都包含氧化还原反应
B.利用潮汐发电是将电能转化为动能
C.海域辽阔,所以可以将废水排入海洋
(3)某同学利用食盐进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是

A.
 固体不导电,不是电解质
固体不导电,不是电解质B.电解质本身不一定能导电
C.图2中水是电解质,电离产生大量的

(4)过程
 用于海水提溴。主要工业生产流程如下图所示。
用于海水提溴。主要工业生产流程如下图所示。
①向苦卤中通入
 ,利用了
,利用了 的
的②吹出塔中通入热空气吹出
 ,利用了
,利用了 的
的A.氧化性 B.还原性
C.挥发性,沸点比水低 D.易溶于水
(5)从海水中提取的粗盐精制后,通过电解饱和食盐水得到一系列化工产品。
①请写出电解饱和食盐水的化学方程式
②检验阳极产物的方法为
(6)实验室可以利用蒸馏的方法进行海水淡化,可选用如图装置完成。该装置中有一处明显的错误是

您最近一年使用:0次
名校
解题方法
3 . 海水的综合利用。海水的综合利用主要包括海水直接利用,海水淡化和海水中化学元素的利用三个方面。其中,海水中化学元素的利用是指从海水中提取钠、镁、氯、溴等元素。
(1)海水晒盐使用的盐田法,相当于化学中的___________ 操作。
(2)粗盐中存在Ca2+、Mg2+、SO 等可溶性杂质离子,要除去这些离子加入沉淀剂的顺序正确的是___________。
等可溶性杂质离子,要除去这些离子加入沉淀剂的顺序正确的是___________。
①过量的Na2CO3溶液 ②过量的BaCl2溶液 ③过量的NaOH溶液
(3)某同学利用食盐进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是___________。

(4)电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁。下列物质中可以用作镁蒸气的冷却剂的是___________。
(5)过程b用于海水提溴。主要工业生产流程如下图所示。
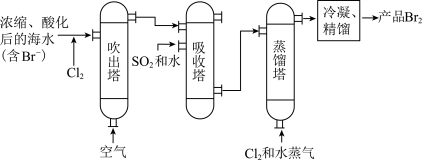
吹出塔中通入热空气吹出Br2,利用了Br2的___________ ,吸收塔中吸收Br2,利用了Br2的___________ 。
A. 氧化性 B. 还原性 C. 挥发性 D. 易溶于水
(6)从海水中提取的粗盐精制后,通过电解饱和食盐水得到一系列化工产品。
①请写出电解饱和食盐水的化学方程式___________ 。
②检验阳极产物时可选用___________ 。
③实验测得产生的H2体积(标准状况下)为5.60mL,若电解后溶液的体积为50.00mL,则溶液中NaOH的物质的量浓度为___________ mol·L-1。
(7)实验室可以利用蒸馏的方法进行海水淡化,可选用如图装置完成。
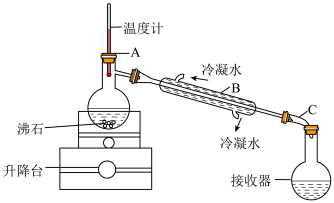
该装置中有一处明显的错误是___________ 。

(1)海水晒盐使用的盐田法,相当于化学中的
(2)粗盐中存在Ca2+、Mg2+、SO
 等可溶性杂质离子,要除去这些离子加入沉淀剂的顺序正确的是___________。
等可溶性杂质离子,要除去这些离子加入沉淀剂的顺序正确的是___________。①过量的Na2CO3溶液 ②过量的BaCl2溶液 ③过量的NaOH溶液
| A.①②③ | B.①③② | C.②①③ | D.③①② |

| A.NaCl固体不导电,不是电解质 |
| B.电解质本身不一定能导电 |
| C.图2中水是电解质,电离产生大量的H+和OH- |
| D.图2中NaCl在电流作用下电离出了大量自由移动的离子 |
| A.Ar | B.CO2 | C.N2 | D.O2 |

吹出塔中通入热空气吹出Br2,利用了Br2的
A. 氧化性 B. 还原性 C. 挥发性 D. 易溶于水
(6)从海水中提取的粗盐精制后,通过电解饱和食盐水得到一系列化工产品。
①请写出电解饱和食盐水的化学方程式
②检验阳极产物时可选用
③实验测得产生的H2体积(标准状况下)为5.60mL,若电解后溶液的体积为50.00mL,则溶液中NaOH的物质的量浓度为
(7)实验室可以利用蒸馏的方法进行海水淡化,可选用如图装置完成。

该装置中有一处明显的错误是
您最近一年使用:0次
4 . 海洋是地球上最大的资源宝库,海水淡化及海水资源的综合利用具有重要意义。回答下列问题:
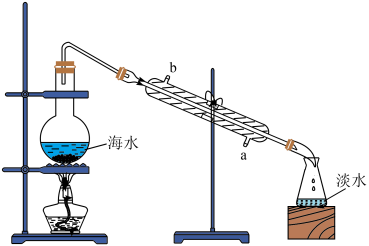
(1)用蒸馏法将海水淡化的装置如图,冷凝管的进水口是___________ (填“a”或“b”)。
(2)海水提溴技术涉及反应: 是利用了
是利用了 的
的___________ (填“氧化性”或“还原性”)。
(3)粗盐中常含有 、
、 、
、 等杂质离子,正确的除杂操作顺序为___________。
等杂质离子,正确的除杂操作顺序为___________。
①加入稍过量的 溶液;②加入稍过量的
溶液;②加入稍过量的 溶液;③加入适量的稀盐酸;④加入稍过量的
溶液;③加入适量的稀盐酸;④加入稍过量的 溶液;⑤过滤。
溶液;⑤过滤。
(4)用电解熔融氯化镁的方法可制取镁,该反应为___________ ;检验 溶液中是否含有
溶液中是否含有 残留的方法是
残留的方法是___________ 。

(1)用蒸馏法将海水淡化的装置如图,冷凝管的进水口是
(2)海水提溴技术涉及反应:
 是利用了
是利用了 的
的(3)粗盐中常含有
 、
、 、
、 等杂质离子,正确的除杂操作顺序为___________。
等杂质离子,正确的除杂操作顺序为___________。①加入稍过量的
 溶液;②加入稍过量的
溶液;②加入稍过量的 溶液;③加入适量的稀盐酸;④加入稍过量的
溶液;③加入适量的稀盐酸;④加入稍过量的 溶液;⑤过滤。
溶液;⑤过滤。| A.④①②③⑤ | B.②①④⑤③ | C.①②⑤③④ | D.①④②⑤③ |
 溶液中是否含有
溶液中是否含有 残留的方法是
残留的方法是
您最近一年使用:0次
解题方法
5 . 已知海水中的溴含量约为65mg·L-1,从海水中提取溴的工业流程如图:
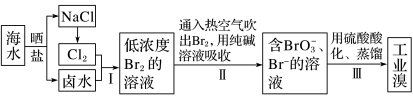
(1)上述步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将其转化成化合态的溴,目的是_______ 。
(2)步骤Ⅱ通入热空气吹出Br2,利用了溴的_______(填字母)。
(3)步骤Ⅱ中涉及的离子反应如下,请配平下列离子方程式,并将配平后的化学计量数写在答题卡相应位置的空格内。________
 Br2+
Br2+ CO
CO =
= BrO
BrO +
+ Br-+
Br-+ CO2↑
CO2↑
(4)上述流程中吹出的溴蒸气也可以先用二氧化硫的水溶液吸收,再用氯气氧化,然后进行蒸馏,则溴与二氧化硫的水溶液反应的离子方程式为_______ 。
(5)下列关于溴的说法正确的是_______(填字母)。

(1)上述步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将其转化成化合态的溴,目的是
(2)步骤Ⅱ通入热空气吹出Br2,利用了溴的_______(填字母)。
| A.氧化性 | B.还原性 | C.挥发性 | D.腐蚀性 |
 Br2+
Br2+ CO
CO =
= BrO
BrO +
+ Br-+
Br-+ CO2↑
CO2↑(4)上述流程中吹出的溴蒸气也可以先用二氧化硫的水溶液吸收,再用氯气氧化,然后进行蒸馏,则溴与二氧化硫的水溶液反应的离子方程式为
(5)下列关于溴的说法正确的是_______(填字母)。
| A.溴及其化合物在医药、农药、染料和阻燃剂生产中有广泛的应用 |
| B.溴与氯在周期表中位于同一主族,单质的氧化性:Br2>Cl2 |
| C.可以用NaOH溶液吸收Br2的尾气 |
| D.溴水中含溴元素的微粒只有Br2 |
您最近一年使用:0次
6 . 海水是人类宝贵的自然资源,从海水中可以提取多种化工原料。如图是有关海水的部分生产工艺流程图。
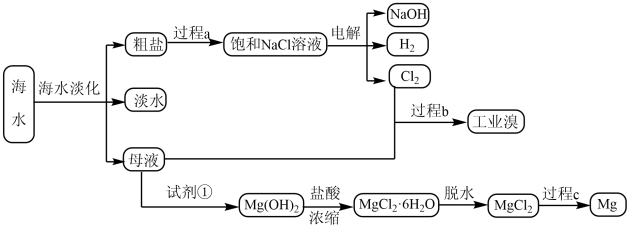
(1)①从海水中获取淡水历史最久的方法是:____ 。
②过程a是粗盐的精制。除去粗盐中的Ca2+、Mg2+、SO 杂质时,粗盐溶解后加入沉淀剂:
杂质时,粗盐溶解后加入沉淀剂:
a.过量的Na2CO3溶液 b.过量的BaCl2溶液 c.过量的NaOH溶液
加入沉淀剂的顺序正确的是____ (填序号)。
A.abc B.bac C.cba
(2)过程b用于海水提溴。主要工业生产流程如图所示。
①吹出塔中通入热空气吹出Br2,利用了Br2的____ ,吸收塔中吸收Br2,利用了Br2的____ (填序号)。
a.氧化性 b.还原性 c.挥发性
②吸收塔中SO2将Br2转化为HBr的化学方程式是____ 。
(3)母液可用于海水提镁。
①为使母液中的MgCl2转化为Mg(OH)2,从原料来源及经济效益角度考虑,试剂①最好选用____ 。
a.氨水 b.氢氧化钙 c.氢氧化钠
②过程c的化学方程式为____ 。

(1)①从海水中获取淡水历史最久的方法是:
②过程a是粗盐的精制。除去粗盐中的Ca2+、Mg2+、SO
 杂质时,粗盐溶解后加入沉淀剂:
杂质时,粗盐溶解后加入沉淀剂:a.过量的Na2CO3溶液 b.过量的BaCl2溶液 c.过量的NaOH溶液
加入沉淀剂的顺序正确的是
A.abc B.bac C.cba
(2)过程b用于海水提溴。主要工业生产流程如图所示。

①吹出塔中通入热空气吹出Br2,利用了Br2的
a.氧化性 b.还原性 c.挥发性
②吸收塔中SO2将Br2转化为HBr的化学方程式是
(3)母液可用于海水提镁。
①为使母液中的MgCl2转化为Mg(OH)2,从原料来源及经济效益角度考虑,试剂①最好选用
a.氨水 b.氢氧化钙 c.氢氧化钠
②过程c的化学方程式为
您最近一年使用:0次
解题方法
7 . 海洋是生命的摇篮,蕴藏着丰富的资源。回答下列问题:
(1)目前海水淡化的主要方法有___________ (填一种)。
(2)从氯碱工业的副产品中能够得到一种含氯消毒剂,有效成分为NaClO,该消毒剂起作用的原理是利用了HClO的___________ (填“强氧化性”或“强还原性”)。
(3)海水提镁工艺流程如图所示:
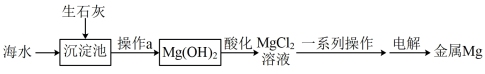
操作a的名称为___________ 。
(4)海水提溴工艺流程如图所示:

①海水中的 被
被 氧化的离子方程式是
氧化的离子方程式是___________ 。
②写出吸收塔中 将
将 转化为HBr的化学方程式:
转化为HBr的化学方程式:___________ 。
(1)目前海水淡化的主要方法有
(2)从氯碱工业的副产品中能够得到一种含氯消毒剂,有效成分为NaClO,该消毒剂起作用的原理是利用了HClO的
(3)海水提镁工艺流程如图所示:

操作a的名称为
(4)海水提溴工艺流程如图所示:

①海水中的
 被
被 氧化的离子方程式是
氧化的离子方程式是②写出吸收塔中
 将
将 转化为HBr的化学方程式:
转化为HBr的化学方程式:
您最近一年使用:0次
名校
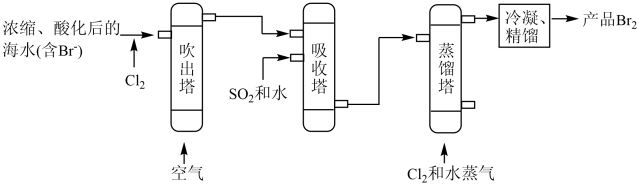
8 . 海水是人类宝贵的自然资源,从海水中可以提取多种化工原料。部分流程如下图。
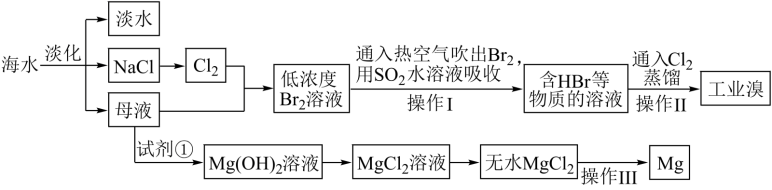
请回答下列问题:
(1)请写出海水淡化的常用方法有_______
A.蒸馏法 B.电渗析法 C.离子交换法
(2)通入热空气吹出Br2,利用了Br2的_______ (填序号),未直接用“含Br2的海水”进行蒸馏得到溴,而是经过“空气吹出”“SO2吸收”“氧化”后再蒸馏,这样操作的意义是_______ 。
a.氧化性 b.还原性 c.挥发性
(3)操作I用SO2水溶液吸收Br2有关反应的化学方程式为_______ 。
(4)写出操作II通氯气后发生的离子方程式_______ 。
(5)为使母液中的MgCl2转化为Mg(OH)2,从原料来源及经济效益角度考虑,试剂①最好选用_______ 。
a.氨水 b.氢氧化钙 c.氢氧化钠
(6)操作III的化学方程式为_______ 。

请回答下列问题:
(1)请写出海水淡化的常用方法有
A.蒸馏法 B.电渗析法 C.离子交换法
(2)通入热空气吹出Br2,利用了Br2的
a.氧化性 b.还原性 c.挥发性
(3)操作I用SO2水溶液吸收Br2有关反应的化学方程式为
(4)写出操作II通氯气后发生的离子方程式
(5)为使母液中的MgCl2转化为Mg(OH)2,从原料来源及经济效益角度考虑,试剂①最好选用
a.氨水 b.氢氧化钙 c.氢氧化钠
(6)操作III的化学方程式为
您最近一年使用:0次
名校
解题方法
9 . 中国有广阔的海岸线,建设发展海洋经济、海水的综合利用大有可为。空气吹出法工艺,是目前“海水提溴”的最主要方法之一,其工艺流程如下图所示,试回答下列问题:
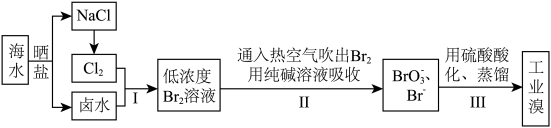
(1)海水日晒得到的盐因为含有较多杂质,称为粗盐。为了得到精制盐,可以用_______ 的办法除去其中的泥沙等不溶物。
(2)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是____________ 。
(3)步骤②通入热空气或水蒸气吹出Br2,利用了溴的________ 。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(4)流程Ⅱ中涉及的离子反应方程式如下,请在下面横线内填入适当的化学计量数:___ Br2+___  =
= ___  +
+___ Br-+___ CO2↑
(5)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的离子方程式:___________________ 。
(6)流程Ⅲ蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因:________________________ 。

(1)海水日晒得到的盐因为含有较多杂质,称为粗盐。为了得到精制盐,可以用
(2)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是
(3)步骤②通入热空气或水蒸气吹出Br2,利用了溴的
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(4)流程Ⅱ中涉及的离子反应方程式如下,请在下面横线内填入适当的化学计量数:
 =
=  +
+(5)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的离子方程式:
(6)流程Ⅲ蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因:
您最近一年使用:0次
2020-10-09更新
|
268次组卷
|
3卷引用:广东省湛江市2018-2019学年高一下学期期末考试化学试题
名校
解题方法
10 . 已知海水中的溴含量约为 65 mg·L-1,从海水中提取溴的工业流程如下:
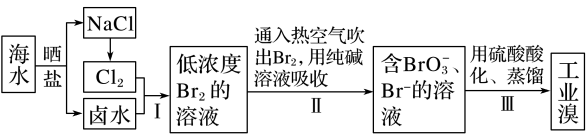
(1)写出步骤Ⅰ的离子方程式________________ 。
(2)步骤Ⅱ通入热空气吹出 Br2,利用了溴的_________________ (填序号)。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在横线上填入正确的化学计量数:______ Br2+______ CO32-=______ BrO3-+______ Br-+______ CO2↑
(4)上述流程中吹出的溴蒸气也可以先用二氧化硫的水溶液吸收,再用氯气氧化,然后进行蒸馏,则溴与二氧化硫的水溶液反应的离子方程式为_______________ 。
(5)实验室分离溴还可以用萃取法,下列可以用作溴的萃取剂的有________________ (填字母)。
A.乙醇 B.四氯化碳 C.醋酸 D.苯

(1)写出步骤Ⅰ的离子方程式
(2)步骤Ⅱ通入热空气吹出 Br2,利用了溴的
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在横线上填入正确的化学计量数:
(4)上述流程中吹出的溴蒸气也可以先用二氧化硫的水溶液吸收,再用氯气氧化,然后进行蒸馏,则溴与二氧化硫的水溶液反应的离子方程式为
(5)实验室分离溴还可以用萃取法,下列可以用作溴的萃取剂的有
A.乙醇 B.四氯化碳 C.醋酸 D.苯
您最近一年使用:0次



