名校
1 . 海水的综合利用一直是研究课题。某地天然海水(主要含Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子),研究用海水吸收燃煤排放的含有SO2烟气的工艺流程如图所示,下列说法中正确的是
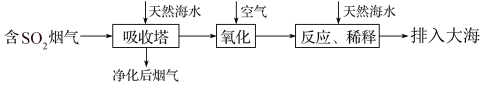

| A.工艺中天然海水显酸性 |
| B.氧化过程中可能发生的离子反应为2SO2+2H2O+O2=4H++2SO42- |
| C.排入大海的溶液与天然海水相比,只有SO42-数量发生了变化 |
| D.若将氧化后的液体进行蒸发结晶,得到的晶体中CaSO4含量最高 |
您最近一年使用:0次
2019-10-30更新
|
228次组卷
|
6卷引用:山东省泰安市第一中学2020届高三10月月考化学试题
名校
2 . 工业上以浓缩海水为原料提取溴的部分流程如下:

下列说法正确的是( )

下列说法正确的是( )
| A.海水需要浓缩,是因为海水中的Br2含量较低 |
| B.热空气的作用是将多余的Cl2吹出 |
| C.反应釜2中发生的反应是5Br-+BrO3-+3H2O=3Br2+6OH- |
| D.吸收塔中发生的反应是3Br2+3CO32-=5Br-+BrO3-+3CO2 |
您最近一年使用:0次
3 . 海洋是资源的宝库,海水中含量最高的金属元素是
| A.Na | B.Ca | C.Mg | D.Cu |
您最近一年使用:0次
4 . 海水是巨大的资源宝库,海水中氯化物的含量相当高,主要是氯化钠,其次是氯化镁、氯化钙和氯化钾等。从海水中提取食盐和溴的过程如下:
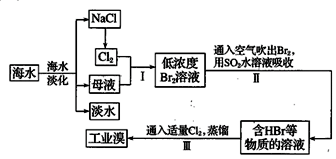
(1)氯原子的结构示意图为____________________ 。
(2)用NaCl为原料生产氯气的化学方程式为___________________________________ 。
(3)步骤Ⅱ中用热空气就可以把Br2吹出来的原因是_____________________________ 。
(4)步骤Ⅱ中用SO2水溶液吸收Br2,可制得HBr和硫酸,试写出该反应的化学方程式_________________________________________________ 。
(5)步骤Ⅲ用氯气提取溴,这是利用了氯气的__________ 性。(填“氧化”或“还原”)。

(1)氯原子的结构示意图为
(2)用NaCl为原料生产氯气的化学方程式为
(3)步骤Ⅱ中用热空气就可以把Br2吹出来的原因是
(4)步骤Ⅱ中用SO2水溶液吸收Br2,可制得HBr和硫酸,试写出该反应的化学方程式
(5)步骤Ⅲ用氯气提取溴,这是利用了氯气的
您最近一年使用:0次
2018-11-25更新
|
242次组卷
|
2卷引用:江苏省沭阳县2018-2019学年高一上学期期中考试化学试题
5 . 粗盐中含有CaCl2、MgCl2、Na2SO4以及泥沙等杂质,请回答粗盐提纯的有关问题:
(1)NaCl既属于_______ (填酸、碱或盐),也属于______ (填强电解质或弱电解质),该分类方法称为_______ ,NaCl溶液中共含有________ 种微粒(包含分子和离子)
(2)为了除去可溶性杂质,可以按以下实验步骤进行提纯:①加过量BaCl2溶液;②加过量NaOH溶液;③加过量Na2CO3溶液;④过滤;⑤加适量盐酸.
其中,在步骤②中主要涉及的离子反应方程式是____________________________ ;步骤①和③能否交换顺序_______ (填能或不能)。
(3)将ag粗盐样品溶于水,经过以上一系列提纯操作之后,实验完毕得到bg精盐(不考虑实验过程中操作引起的损耗),下列说法正确的是___________ 。(NA表示阿伏加德罗常数)
(4)某已滤去泥沙的粗盐经检验不含Na2SO4。该粗盐溶于水配成100mL溶液,加入过量稀NaOH溶液后,过滤得到沉淀Mg(OH)25.8g,滤液中通入CO2,得到如下图(横坐标表示通 入CO2标准状况下的体积,纵坐标表示沉淀的物质的量),回答下列问题:
①b段表示的离子方程式为__________
②100mL溶液中Ca2+的物质的量与所加NaOH的物质的量之比为__________
③P点表示的CO2的体积为__________ (标准状况下)。
(1)NaCl既属于
(2)为了除去可溶性杂质,可以按以下实验步骤进行提纯:①加过量BaCl2溶液;②加过量NaOH溶液;③加过量Na2CO3溶液;④过滤;⑤加适量盐酸.
其中,在步骤②中主要涉及的离子反应方程式是
(3)将ag粗盐样品溶于水,经过以上一系列提纯操作之后,实验完毕得到bg精盐(不考虑实验过程中操作引起的损耗),下列说法正确的是
| A.粗盐中Na+数目为aNA/58.5 | B.精盐中NaCl物质的量为b/58.5mol |
| C.粗盐中NaCl的质量分数为b/a×100% | D.粗盐中关于NaCl的量无法确定 |
(4)某已滤去泥沙的粗盐经检验不含Na2SO4。该粗盐溶于水配成100mL溶液,加入过量稀NaOH溶液后,过滤得到沉淀Mg(OH)25.8g,滤液中通入CO2,得到如下图(横坐标表示通 入CO2标准状况下的体积,纵坐标表示沉淀的物质的量),回答下列问题:

①b段表示的离子方程式为
②100mL溶液中Ca2+的物质的量与所加NaOH的物质的量之比为
③P点表示的CO2的体积为
您最近一年使用:0次
名校
6 . 工业上以浓缩海水为原料提取溴的部分流程如右图:下列说法正确的是
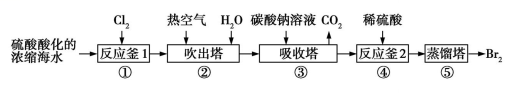

| A.海水需要浓缩,是因为海水中的Br2含量较低 |
| B.热空气的作用是将多余的Cl2吹出 |
| C.吸收塔中发生的反应是3Br2+3CO32-=5Br-+BrO3-+3CO2↑ |
| D.反应釜2中发生的反应是5Br-+BrO3-+3H2O=3Br2+6OH- |
您最近一年使用:0次
2018-08-01更新
|
319次组卷
|
3卷引用:陕西省西安中学2017-2018学年高一下学期期末考试(理)化学试题
解题方法
7 . 从海水中可提取各种化工产品,下图是工业上对海水的一种综合利用的流程图:

(1)过滤时所需要玻璃仪器为烧杯、漏斗和_________ ,补填的玻璃仪器在过滤时,起到了______________ 的作用。
(2)下图为电解食盐水的装置,石墨电极上产生的气体为_________ ;在铁棒周围的溶液里滴加酚酞溶液,溶液变________ 色。
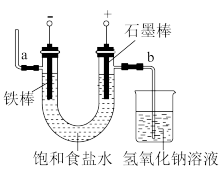
(3)写出电解饱和食盐水的化学方程式:____________________________ 。
(4)下表是某“加碘食盐”包装袋上的部分文字说明.
①经测定,该“加碘食盐”中KIO3的含量为42.8 mg·kg-1。计算每千克“加碘食盐”中KIO3的物质的量为__ mol,该“加碘食盐”的含碘量为__ mg·kg-1。
②将5.0 g该“加碘食盐”溶于水中配成100 mL溶液,该溶液中IO3-离子物质的量浓度为___________ mol·L-1。

(1)过滤时所需要玻璃仪器为烧杯、漏斗和
(2)下图为电解食盐水的装置,石墨电极上产生的气体为

(3)写出电解饱和食盐水的化学方程式:
(4)下表是某“加碘食盐”包装袋上的部分文字说明.
| 配料 | 氯化钠(NaCl)、碘酸钾(KIO3) |
| 含碘量 | 20~40 mg·kg-1 |
| 保质期 | 18个月 |
| 食用方法 | 勿长时间炖炒 |
| 贮藏指南 | 避热、避光、密封、防潮 |
②将5.0 g该“加碘食盐”溶于水中配成100 mL溶液,该溶液中IO3-离子物质的量浓度为
您最近一年使用:0次
2014·河北唐山·二模
解题方法
8 . 海水是巨大的资源宝库,下列说法正确的是
| A.碘元素又称“海洋元素” |
| B.镁是海水中含量最多的金属元素 |
| C.从海水中提取食盐和碘的过程都是物理变化 |
| D.氯碱工业和纯碱工业的原料都有食盐 |
您最近一年使用:0次
解题方法
9 . 中国有广阔的海岸线,海水的综合利用大有可为,海水中溴含量约为65mg/L,从海水中提取Br2的工艺流程如下:
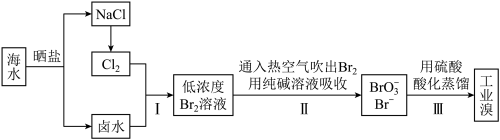
(1)①从海水中获得淡水的方法主要有_________ (填一种)
②我国政府规定食用盐中必须加入一定量的KIO3(碘酸钾),其中碘元素的化合价为_________ 价。
(2)经过化学变化才能从海水中获得的物质是__________(选填字母序号)
(3)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的___________;
(4)请写出步骤Ⅱ中反应的离子反应方程式__________ 。

(1)①从海水中获得淡水的方法主要有
②我国政府规定食用盐中必须加入一定量的KIO3(碘酸钾),其中碘元素的化合价为
(2)经过化学变化才能从海水中获得的物质是__________(选填字母序号)
| A.氯、溴、碘 | B.钠、镁 | C.烧碱、氢气 | D.食盐、淡水 |
| A.氧化性 | B.还原性 | C.挥发性 | D.腐蚀性 |
您最近一年使用:0次
解题方法
10 . 海水资源的利用具有广阔前景。海水中主要离子的含量如下:
(1)以食盐为原料进行生产并综合利用的某些过程如下图所示。

①除去粗盐中的Ca2+、Mg2+和SO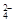 离子,加入沉淀剂a.Na2CO3 b.NaOH c.BaCl2,
离子,加入沉淀剂a.Na2CO3 b.NaOH c.BaCl2,
合理的一种顺序是(填序号)_______________ 。将滤液的pH调至酸性除去的离子是____________ 。
②电解饱和食盐水的化学方程式是_____________________ ;
③侯德榜向饱和食盐水中通入NH3、CO2气体制NaHCO3晶体的化学方程式为___________________ 。
其依据是_______________________________________ 。
④工业上可用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与Cl2制取有效成分为NaClO的消毒液,反应的化学方程式是____________________ 。(碳酸的酸性强于次氯酸)。
(2)利用海水可以提取溴和镁,提取过程如下:

① 从MgCl2溶液中得到MgCl2·6H2O晶体的主要实验操作是_______________ 、洗涤、烘干。从MgCl2·6H2O晶体中得到无水MgCl2的主要方法是
②用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_____________ ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_____________ 。
③依据上述流程,若将5 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为_______ L(忽略Cl2溶解)。
| 成分 | Cl- | Na+ | SO42- | Mg2+ | Ca2+ | HCO3- | Br- |
| 含量/(mg·L-1) | 18980 | 10560 | 2560 | 1272 | 400 | 142 | 64 |
(1)以食盐为原料进行生产并综合利用的某些过程如下图所示。

①除去粗盐中的Ca2+、Mg2+和SO
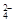 离子,加入沉淀剂a.Na2CO3 b.NaOH c.BaCl2,
离子,加入沉淀剂a.Na2CO3 b.NaOH c.BaCl2,合理的一种顺序是(填序号)
②电解饱和食盐水的化学方程式是
③侯德榜向饱和食盐水中通入NH3、CO2气体制NaHCO3晶体的化学方程式为
其依据是
④工业上可用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与Cl2制取有效成分为NaClO的消毒液,反应的化学方程式是
(2)利用海水可以提取溴和镁,提取过程如下:

① 从MgCl2溶液中得到MgCl2·6H2O晶体的主要实验操作是
②用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为
③依据上述流程,若将5 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为
您最近一年使用:0次



