名校
解题方法
1 . 下列离子在海水中含量最多的是
| A.氯离子 | B.镁离子 | C.铁离子 | D.钙离子 |
您最近一年使用:0次
2020-07-22更新
|
1002次组卷
|
6卷引用:吉林省长春市第二十九中学2019-2020学年高一下学期第三次月考化学(文)试题
吉林省长春市第二十九中学2019-2020学年高一下学期第三次月考化学(文)试题(已下线)2.2.1氯气的性质(基础练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)(已下线)第四章 非金属及其化合物(基础过关)-2020-2021学年高一化学单元测试定心卷(人教版必修1)(已下线)专题2.2.1 氯气的性质(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)吉林省吉化第一高级中学校2021-2022学年高一下学期复课检测化学试题(已下线)【知识图鉴】单元讲练测必修第二册第八单元02基础练
名校
2 . 海水中质量百分含量最高的元素( )
| A.Na | B.K | C.Cl | D.S |
您最近一年使用:0次
名校
3 . 海水中,除了氢、氧元素以外,含量最多的元素是
| A.氯 | B.钠 | C.镁 | D.钙 |
您最近一年使用:0次
2020-07-14更新
|
141次组卷
|
2卷引用:2018年上海市普通高中学业水平化学合格性考试
名校
解题方法
4 . 已知海水中的溴含量约为 65 mg·L-1,从海水中提取溴的工业流程如下:
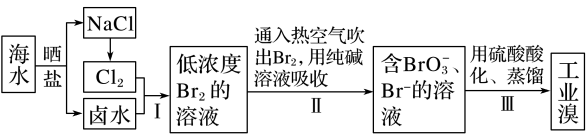
(1)写出步骤Ⅰ的离子方程式________________ 。
(2)步骤Ⅱ通入热空气吹出 Br2,利用了溴的_________________ (填序号)。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在横线上填入正确的化学计量数:______ Br2+______ CO32-=______ BrO3-+______ Br-+______ CO2↑
(4)上述流程中吹出的溴蒸气也可以先用二氧化硫的水溶液吸收,再用氯气氧化,然后进行蒸馏,则溴与二氧化硫的水溶液反应的离子方程式为_______________ 。
(5)实验室分离溴还可以用萃取法,下列可以用作溴的萃取剂的有________________ (填字母)。
A.乙醇 B.四氯化碳 C.醋酸 D.苯

(1)写出步骤Ⅰ的离子方程式
(2)步骤Ⅱ通入热空气吹出 Br2,利用了溴的
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在横线上填入正确的化学计量数:
(4)上述流程中吹出的溴蒸气也可以先用二氧化硫的水溶液吸收,再用氯气氧化,然后进行蒸馏,则溴与二氧化硫的水溶液反应的离子方程式为
(5)实验室分离溴还可以用萃取法,下列可以用作溴的萃取剂的有
A.乙醇 B.四氯化碳 C.醋酸 D.苯
您最近一年使用:0次
名校
解题方法
5 . 海水中化学资源的综合开发利用,已受到各国的高度重视。Br2和Mg等两种单质都可以从海水中提取,如图为提取它们的主要步骤:
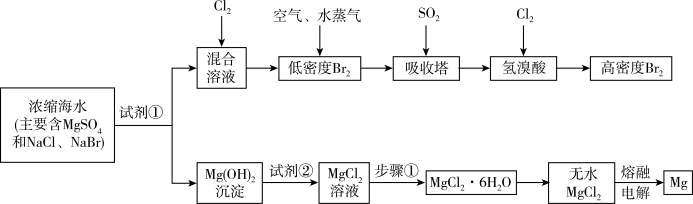
请回答:
Ⅰ.从海水中提取的溴占世界溴年产量的三分之一,主要方法就是上述流程中的空气吹出法。
(1)制取Br2时第一次通入Cl2时发生反应的离子方程式是_________ 。
(2)吸收塔中反应的离子方程式是_______ ,工业生产1mol Br2,理论上需要Cl2的物质的量为______ 。
(3)取10L海水经过提纯浓缩,向吸收塔吸收后的溶液中加入0.100 mol/L AgNO3溶液8.0 mL恰好完全反应,则海水中含溴的含量为______ mg/L(不考虑提纯过程中溴的损失)。
Ⅱ.镁及其合金是用途很广的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的。
(1)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用__________ (写化学式)。
(2)步骤①包括加热、蒸发、冷却、结晶、____________ 。
(3)通电时无水MgCl2在熔融状态下反应的化学方程式是_______________ 。

请回答:
Ⅰ.从海水中提取的溴占世界溴年产量的三分之一,主要方法就是上述流程中的空气吹出法。
(1)制取Br2时第一次通入Cl2时发生反应的离子方程式是
(2)吸收塔中反应的离子方程式是
(3)取10L海水经过提纯浓缩,向吸收塔吸收后的溶液中加入0.100 mol/L AgNO3溶液8.0 mL恰好完全反应,则海水中含溴的含量为
Ⅱ.镁及其合金是用途很广的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的。
(1)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用
(2)步骤①包括加热、蒸发、冷却、结晶、
(3)通电时无水MgCl2在熔融状态下反应的化学方程式是
您最近一年使用:0次
2020-06-05更新
|
326次组卷
|
3卷引用:四川省成都外国语学校2019-2020学年高一下学期期中考试化学试题
四川省成都外国语学校2019-2020学年高一下学期期中考试化学试题(已下线)第08练 自然资源的开发利用-2020年【衔接教材·暑假作业】新高二化学(人教版)河北省安平中学2020-2021学年高一上学期12月月考化学试题
6 . 海水中含量最多的氯化物是
| A.NaCl | B.MgCl2 | C.KCl | D.CaCl2 |
您最近一年使用:0次
2020-04-27更新
|
78次组卷
|
4卷引用:浙江省嘉兴市第五高级中学2019-2020学年高一上学期期中考试化学试题
名校
7 . 海水经过晒盐后得到粗盐和苦卤,粗盐中除含有Ca2+,Mg2+,SO42﹣等可溶性杂质外,还含有泥沙等不溶性杂质,食用的精盐是用粗盐提纯得到,流程如图所示:
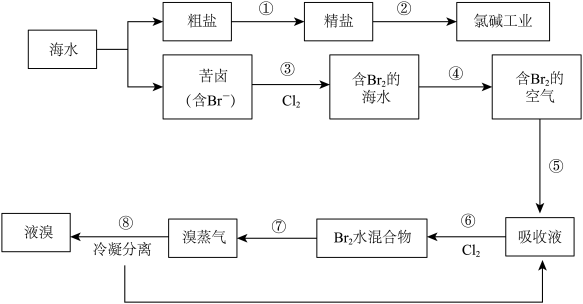
(1)为了除去粗盐中的Ca2+,Mg2+,SO42﹣,采取以下措施:
a.粗盐中含有的 Ca2+、Mg2+,精制过程中为除去这两种离子,发生的离子反应方程式分别为:_____ ,_____ 。
b.若粗盐中SO42﹣含量较高,必须添加钡试剂除去SO42﹣,该钡试剂可以是_____
A.Ba(OH)2
B.Ba(NO3)2
C.BaCl2
D.BaSO4
滴加钡试剂时,需注意(滴加试剂的先后顺序):_____ 。
(2)分离出粗盐后的苦卤还可用于溴元素的提取,在实验室中如何验证苦卤液中含有 Br﹣:_____ 。
(3)在苦卤提溴的过程中,第⑤步骤中可用亚硫酸钠溶液来吸收,则所发生的离子反应方程式为:_____ ,步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度 相差很大的特点进行分离。若在实验室分离上述混合物的分离仪器的名称是_____ ,分离时液 溴从分离器的_____ (填“上口”或“下口”)排出。

(1)为了除去粗盐中的Ca2+,Mg2+,SO42﹣,采取以下措施:
a.粗盐中含有的 Ca2+、Mg2+,精制过程中为除去这两种离子,发生的离子反应方程式分别为:
b.若粗盐中SO42﹣含量较高,必须添加钡试剂除去SO42﹣,该钡试剂可以是
A.Ba(OH)2
B.Ba(NO3)2
C.BaCl2
D.BaSO4
滴加钡试剂时,需注意(滴加试剂的先后顺序):
(2)分离出粗盐后的苦卤还可用于溴元素的提取,在实验室中如何验证苦卤液中含有 Br﹣:
(3)在苦卤提溴的过程中,第⑤步骤中可用亚硫酸钠溶液来吸收,则所发生的离子反应方程式为:
您最近一年使用:0次
名校
8 . 海水的综合利用一直是研究课题。某地天然海水(主要含Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子),研究用海水吸收燃煤排放的含有SO2烟气的工艺流程如图所示,下列说法中正确的是
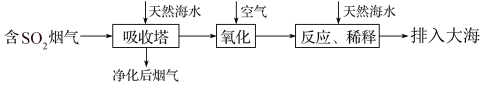

| A.工艺中天然海水显酸性 |
| B.氧化过程中可能发生的离子反应为2SO2+2H2O+O2=4H++2SO42- |
| C.排入大海的溶液与天然海水相比,只有SO42-数量发生了变化 |
| D.若将氧化后的液体进行蒸发结晶,得到的晶体中CaSO4含量最高 |
您最近一年使用:0次
2019-10-30更新
|
228次组卷
|
6卷引用:山东省泰安市第一中学2020届高三10月月考化学试题
9 . 下列说法正确的是
| A.海洋中氯元素含量很大,因此氯元素被称为“海洋元素” |
| B.SO2有漂白性因而可使品红溶液、溴水褪色. |
| C.实验室从海带中提取单质碘的过程:取样→灼烧→溶解→过滤→萃取 |
| D.将植物的秸秆加入沼气发酵池中生成沼气属于生物质能的生物化学转换 |
您最近一年使用:0次
2020-01-05更新
|
169次组卷
|
3卷引用:浙江省9+1高中联盟2020届高三上学期期中考试化学试题
18-19高一·浙江·期末
10 . 海水中有丰富的资源,多种多样的海洋动物、植物、矿藏等。如图是从海水中提取某些物质的示意图。已知:海水中含量最高的几种离子的浓度依次为

请根据以上信息回答下列问题:
(1)写出步骤②的操作名称_______ ;实验室中步骤⑤所需的玻璃仪器除烧杯外,还需要的仪器是___________ 。
(2)D具有杀菌消毒的作用,请写出反应④的离子方程式___________ 。
(3)初步提纯后的粗盐中含有等Ca2+、Mg2+、 等杂质,精制得到精盐的步骤顺序为
等杂质,精制得到精盐的步骤顺序为________ 。(用字母序号填空)
a.加适量盐酸;b.加稍过量的氯化钡溶液,再加稍过量的NaOH溶液;c.过滤;d.蒸发结晶;e.加稍过量碳酸钠溶液
(4)____________ (填“能”或“不能”)用 一种试剂替代步骤②中两种试剂,理由是
一种试剂替代步骤②中两种试剂,理由是________ 。
| 微粒种类 | Cl- | Na+ | Mg2+ |  | Ca2+ |
| 微粒浓度 | 0.55mol·L-1 | 0.47mol·L-1 | 0.054mol·L-1 | 0.027mol·L-1 | 0.01mol·L-1 |

请根据以上信息回答下列问题:
(1)写出步骤②的操作名称
(2)D具有杀菌消毒的作用,请写出反应④的离子方程式
(3)初步提纯后的粗盐中含有等Ca2+、Mg2+、
 等杂质,精制得到精盐的步骤顺序为
等杂质,精制得到精盐的步骤顺序为a.加适量盐酸;b.加稍过量的氯化钡溶液,再加稍过量的NaOH溶液;c.过滤;d.蒸发结晶;e.加稍过量碳酸钠溶液
(4)
 一种试剂替代步骤②中两种试剂,理由是
一种试剂替代步骤②中两种试剂,理由是
您最近一年使用:0次



