名校
解题方法
1 . 海洋资源的利用具有广阔前景。
(1)从海水制得的粗盐含有Ca2+、Mg2+、 等杂质离子,正确的除杂操作顺序为___________
等杂质离子,正确的除杂操作顺序为___________
①加入稍过量的BaCl2溶液;②加入稍过量的Na2CO3溶液;③加入适量的稀盐酸;④加入稍过量的NaOH溶液;⑤过滤。
(2)从海水中提取溴的主要步骤是向浓缩的海水中通入Cl2,将Br-氧化,该反应的离子方程式是______ 。
(3)下图是从海水中提取镁的简单流程。
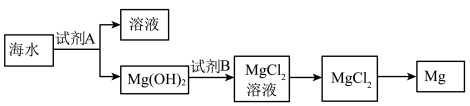
①工业上常用于沉淀Mg2+ 的试剂A是___________ 。
②由无水MgCl2制取Mg的化学方程式是___________ 。
(4)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
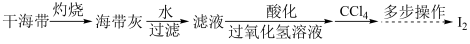
①灼烧海带时所用的主要仪器名称是___________ 。
②向酸化的滤液中加H2O2溶液,写出该反应的离子方程式:___________ 。
(1)从海水制得的粗盐含有Ca2+、Mg2+、
 等杂质离子,正确的除杂操作顺序为___________
等杂质离子,正确的除杂操作顺序为___________①加入稍过量的BaCl2溶液;②加入稍过量的Na2CO3溶液;③加入适量的稀盐酸;④加入稍过量的NaOH溶液;⑤过滤。
| A.④①②③⑤ | B.②①④⑤③ | C.①②⑤③④ | D.①④②⑤③ |
(3)下图是从海水中提取镁的简单流程。

①工业上常用于沉淀Mg2+ 的试剂A是
②由无水MgCl2制取Mg的化学方程式是
(4)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
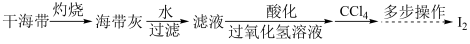
①灼烧海带时所用的主要仪器名称是
②向酸化的滤液中加H2O2溶液,写出该反应的离子方程式:
您最近一年使用:0次
解题方法
2 . 海带提碘过程中以 为溶剂将
为溶剂将 从碘水溶液中提取出来,通过下列实验可从
从碘水溶液中提取出来,通过下列实验可从 的
的 溶液中回收
溶液中回收 。
。

下列说法错误的是
 为溶剂将
为溶剂将 从碘水溶液中提取出来,通过下列实验可从
从碘水溶液中提取出来,通过下列实验可从 的
的 溶液中回收
溶液中回收 。
。
下列说法错误的是
| A.以海带为原料得到碘水溶液的主要实验步骤:取样→灼烧→溶解→过滤 |
B.NaOH溶液与 反应的离子方程式: 反应的离子方程式: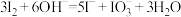 |
| C.过滤需要用到的玻璃仪器有玻璃棒、烧杯和漏斗 |
| D.回收的粗碘可通过升华进行纯化 |
您最近一年使用:0次
解题方法
3 . 当今世界各国充分认识到海洋资源的重要性,海水的综合利用是当今的热点话题之一、
I.利用海水脱硫可以有效地解决煤燃烧过程中排放的SO2造成的一系列环境问题。其工艺流程如图所示:
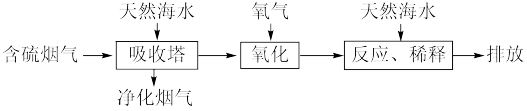
(1)天然海水(pH≈8)吸收含硫的烟气后,会溶有H2SO3、 等分子或离子,需要用氧气进行氧化处理,写出
等分子或离子,需要用氧气进行氧化处理,写出 参加反应的离子方程式
参加反应的离子方程式_______ 。
(2)氧化后的海水需要用大量的天然海水与之混合后才能排放。该操作的主要目的是_______ 。
II.从海水中提纯粗盐后的母液中含有K+、Na+和Mg2+等阳离子。对母液进行一系列的加工可制得金属镁。
(3)从离子反应的角度思考,在母液中加入石灰乳所起的作用是_______ 。
(4)电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁。下列物质中可以用作镁蒸气的冷却剂的是_______(填字母)。
III.海带中含有碘元素。从海带中提取碘的实验过程如下图:

(5)灼烧海带时盛装海带的仪器名称是_______ 。
(6)海带灰中含有硫酸镁、碳酸钠等,在实验步骤_______ (填序号)中实现与碘分离。
(7)写出步骤④反应的离子方程式_______ 。
I.利用海水脱硫可以有效地解决煤燃烧过程中排放的SO2造成的一系列环境问题。其工艺流程如图所示:

(1)天然海水(pH≈8)吸收含硫的烟气后,会溶有H2SO3、
 等分子或离子,需要用氧气进行氧化处理,写出
等分子或离子,需要用氧气进行氧化处理,写出 参加反应的离子方程式
参加反应的离子方程式(2)氧化后的海水需要用大量的天然海水与之混合后才能排放。该操作的主要目的是
II.从海水中提纯粗盐后的母液中含有K+、Na+和Mg2+等阳离子。对母液进行一系列的加工可制得金属镁。
(3)从离子反应的角度思考,在母液中加入石灰乳所起的作用是
(4)电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁。下列物质中可以用作镁蒸气的冷却剂的是_______(填字母)。
| A.O2 | B.N2 | C.Ar | D.水蒸气 |
III.海带中含有碘元素。从海带中提取碘的实验过程如下图:

(5)灼烧海带时盛装海带的仪器名称是
(6)海带灰中含有硫酸镁、碳酸钠等,在实验步骤
(7)写出步骤④反应的离子方程式
您最近一年使用:0次
2022-07-28更新
|
192次组卷
|
2卷引用:山西省晋中市平遥县第二中学校2022-2023学年高二上学期8月质检化学试题
4 . 海洋是一个巨大的资源宝库。在海洋中生长的海带,富含碘元素。某同学设计以下实验方案,从海带中提取 。
。
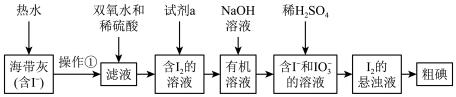
(1)灼烧海带时,需要用到的瓷质实验仪器是___________ 。
(2)如将加双氧水改为加二氧化锰也可达到实验目的,写出向滤液中加入 和稀硫酸发生反应的离子方程式:
和稀硫酸发生反应的离子方程式:___________ 。
(3)试剂a可以是___________ (填字母)。
a.乙醇 b.裂化汽油 c.四氯化碳
(4) 和
和 生成
生成 的离子方程式是
的离子方程式是___________ 。
(5)上图中,含 的溶液经3步转化为
的溶液经3步转化为 的悬浊液,其目的是
的悬浊液,其目的是___________ 。
(6)请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法:___________ 。
 。
。
(1)灼烧海带时,需要用到的瓷质实验仪器是
(2)如将加双氧水改为加二氧化锰也可达到实验目的,写出向滤液中加入
 和稀硫酸发生反应的离子方程式:
和稀硫酸发生反应的离子方程式:(3)试剂a可以是
a.乙醇 b.裂化汽油 c.四氯化碳
(4)
 和
和 生成
生成 的离子方程式是
的离子方程式是(5)上图中,含
 的溶液经3步转化为
的溶液经3步转化为 的悬浊液,其目的是
的悬浊液,其目的是(6)请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法:
您最近一年使用:0次
2022-01-26更新
|
128次组卷
|
2卷引用:山西省怀仁市大地中学高中部2021-2022学年高二下学期第三次月考化学试题
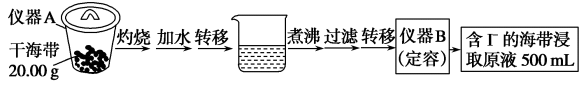
5 . 某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一) 碘含量的测定
实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
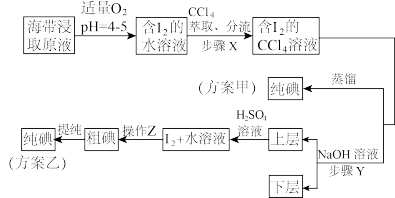
已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
(1)实验(一) 中的仪器名称:仪器A________ , 仪器 B________ 。
(2)①分液漏斗使用前须检漏,检漏方法为__________________ 。
②步骤X中,萃取后分液漏斗内观察到的现象是___________________ 。
③下列有关步骤Y的说法,正确的是________ 。
A 应控制NaOH溶液的浓度和体积
B 将碘转化成离子进入水层
C 主要是除去海带浸取原液中的有机杂质
D NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是________ 。
(3)方案甲中采用蒸馏不合理,理由是________________________ 。
实验(一) 碘含量的测定

实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:

已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
(1)实验(一) 中的仪器名称:仪器A
(2)①分液漏斗使用前须检漏,检漏方法为
②步骤X中,萃取后分液漏斗内观察到的现象是
③下列有关步骤Y的说法,正确的是
A 应控制NaOH溶液的浓度和体积
B 将碘转化成离子进入水层
C 主要是除去海带浸取原液中的有机杂质
D NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是
(3)方案甲中采用蒸馏不合理,理由是
您最近一年使用:0次
2019-07-22更新
|
260次组卷
|
3卷引用:山西省忻州市岢岚县中学2019-2020高二下学期第二次月考化学试题
名校
6 . 从海带中提取碘单质的工艺流程如下。下列关于海水制碘的说法,不正确的是( )
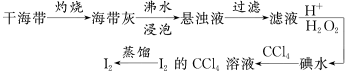

| A.在碘水中加入几滴淀粉溶液,溶液变蓝色 |
| B.实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌 |
| C.含I-的滤液中加入稀硫酸和双氧水后,碘元素发生氧化反应 |
| D.碘水加入CCl4得到I2的CCl4溶液,该操作为“萃取” |
您最近一年使用:0次
2019-07-16更新
|
628次组卷
|
24卷引用:2016-2017学年山西省怀仁一中高二上开学考化学试卷
2016-2017学年山西省怀仁一中高二上开学考化学试卷2015-2016学年河北保定一中高二下期末化学试卷2016-2017学年甘肃省武威六中高二上第一次学段考试化学卷河北省邢台市第八中学2018-2019学年高二上学期期中考试化学试题黑龙江省大庆市铁人中学2018-2019学年高二下学期期末考试化学试题甘肃省天水市第一中学2017-2018学年高二暑假作业检测考试化学试题吉林省延边朝鲜族自治州汪清县第四中学2019-2020学年高二上学期第一次阶段考试化学试题山东济南市历城第二中学2020-2021学年高二上学期开学考试化学试题2016-2017学年湖北省黄冈市蕲春县高一下学期期中考试化学试卷湖北省蕲春县2016-2017学年高一下学期期中考试化学试题四川省树德中学2018届高一下学期开学考试化学试题云南省腾冲市第八中学2017-2018学年高一下学期第一次月考化学试题湖北省黄冈中学2016-2017学年高一下学期期中考试化学试题2017-2018学年人教新版高一化学必修一第四章第二节基础题河北省保定市唐县第一中学2019-2020学年高一上学期期中考试化学试题山东省滕州市第一中学2019-2020学年高一下学期第一次月考化学试题河北省衡水市桃城区第十四中学2019-2020学年高一下学期一调考试化学试题模拟卷04(必考+选考)——2020年秋高三化学开学摸底考试卷(全国通用)(已下线)3.3.2 从海水中提取镁 从海带中提取碘练习(2)——《高中新教材同步备课》(苏教版 必修第一册)江苏省启东中学2021届高三上学期期初考试化学试题湖北省武汉市汉阳、江夏2021-2022学年高一上学期12月联考化学试题福建省建瓯市芝华中学2022-2023学年高一下学期第一次月考化学试题云南省大理市大理第一中学2022-2023学年高一下学期第二次月考化学试题江苏省连云港市灌云高中、灌南惠泽高级中学2023-2024学年高一上学期期中联考化学试卷
名校
7 . 海带中含有丰富的碘,有人设计如下步骤:①将海带灼烧成灰,在灰中加水搅拌;②加四氯化碳充分振荡静置;③通入氯气;④过滤;⑤用分液法分离液体混合物。合理操作的先后顺序是
| A.①②③④⑤ | B.①④②③⑤ |
| C.①②④③⑤ | D.①④③②⑤ |
您最近一年使用:0次
2018-12-09更新
|
183次组卷
|
5卷引用:山西省朔州市怀仁县怀仁一中云东校区2020-2021学年高二9月月考化学试题
山西省朔州市怀仁县怀仁一中云东校区2020-2021学年高二9月月考化学试题【全国百强校】福建省莆田市第一中学2018-2019学年高一上学期期中考试化学试题(已下线)3.3.2 从海水中提取镁 从海带中提取碘练习(1)——《高中新教材同步备课》(苏教版 必修第一册)福建省莆田第十五中学2020-2021学年高一上学期期末考试化学试题(已下线)专题3 从海水中获得的化学物质 综合评价-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)
名校
8 . 海带中提取碘单质,成熟的工艺流程如下
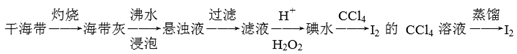
下列关于海水制碘的说法,正确的是

下列关于海水制碘的说法,正确的是
| A.实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌 |
| B.可用酒精萃取碘水中的I2 |
| C.沸水浸泡海带灰的目的是为了加快I-的溶解,并使之溶解更充分 |
| D.含I-的滤液中加入稀硫酸和双氧水后,碘元素发生还原反应 |
您最近一年使用:0次
2018-07-17更新
|
182次组卷
|
3卷引用:山西省朔州市怀仁一中2019-2020学年高二上学期第一次月考化学试卷
真题
名校
9 . 下列有关从海带中提取碘的实验原理和装置能达到实验目的的是
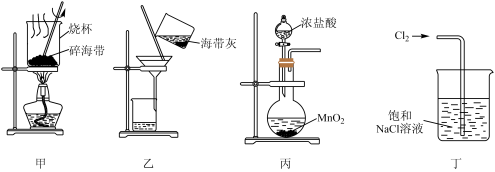

| A.用装置甲灼烧碎海带 |
| B.用装置乙过滤海带灰的浸泡液 |
| C.用装置丙制备用于氧化浸泡液中I−的Cl2 |
| D.用装置丁吸收氧化浸泡液中I−后的Cl2尾气 |
您最近一年使用:0次
2018-06-10更新
|
11698次组卷
|
84卷引用:【全国百强校】山西省临汾第一中学2017-2018学年高二下学期期末考试化学试题
【全国百强校】山西省临汾第一中学2017-2018学年高二下学期期末考试化学试题【全国百强校】山西省山西大学附属中学2018-2019学年高二上学期9月模块诊断化学试题江西省南昌三中2019届高二下期末考试 化学【全国百强校】黑龙江省哈尔滨市第三中学2017-2018学年高二下学期期末考试化学试题云南省腾冲市第八中学2018-2019学年高二上学期期中考试化学试题山西省长治二中2018-2019学年高一下学期第一次月考化学试题【全国百强校】吉林省延边第二中学2018-2019学年高二下学期第二次月考化学试题江西省宜春市万载中学2019-2020学年高二上学期期中考试化学试题(衔接班)广东省2020年普通高中学业水平考试化学合格性考试模拟试题(五)山西省实验中学2019届高三上学期第四次月考化学试题内蒙古巴彦淖尔市乌拉特前旗第一中学2020-2021学年高二下学期期末考试化学试题湖北省武汉市蔡甸区实验高级中学2020-2021学年高二上学期10月联合考试化学试题广东省揭阳市惠来县第一中学2022-2023学年高二上学期期中考试化学试题广东省广州市越秀区2023-2024学年高二上学期开学考试化学试题2018年全国普通高等学校招生统一考试化学(江苏卷)黑龙江省青冈县一中2017-2018学年高一下学期期末考试化学试题(已下线)2018年高考题及模拟题汇编 专题11 化学实验基础江苏省盐城市田家炳中学2019届高三上学期开学考试化学试题陕西省城固县第一中学2019届高三上学期第一次月考化学试题辽宁省沈阳市东北育才学校2019届高三上学期第一次模拟考试化学试题湖北省汉川市第二中学2017-2018学年高一下学期期末考试化学试题甘肃省师范大学附属中学2019届高三上学期第一次月考化学试题辽宁省葫芦岛协作校2019届高三上学期第一次月考化学试题甘肃省武威市第二中学2019届高三上学期第二次(10月)月考化学试题【全国百强校】甘肃省平凉市静宁县第一中学2019届高三上学期第三次模拟考试化学试题江苏师范大学附属实验学校2019届高三上学期10月学情调研化学试题河南省郑州市实验中学2019届高三上学期期中考试化学试题【全国百强校】山东省山东师范大学附属中学2019届高三上学期第五次模拟考试化学试题【市级联考】陕西省榆林市2019届高三下学期高考模拟第三次测试理科综合化学试题吉林省长春汽车经济开发区第三中学2018-2019学年高一下学期4月月考化学试题(已下线)2019年5月20日 《每日一题》 必修2 海带提碘步步为赢 高一化学暑假作业:作业十六 开发利用金属矿物和海水资源黑龙江省大庆市第四中学2018-2019学年高一下学期第三次月考化学试题四川省武胜县烈面中学校2018届高三9月入学考试化学试题湖北省利川市第三中学2019届高三一模化学试题(已下线)专题10.2 物质的分离、提纯、检验与鉴别(练)-《2020年高考一轮复习讲练测》(已下线)专题10.2 物质的分离、提纯、检验与鉴别(讲)-《2020年高考一轮复习讲练测》河南省南阳市2020届高三上学期期中质量评估化学试题(已下线)考点20 化学基础实验——《备战2020年高考精选考点专项突破题集》福建省莆田第二十五中学2020届高三上学期期末考试化学试题2020届人教版高中化学高三专题基础复习专题1《从实验学化学》测试卷上海市宝山区2020届高三上学期第一次模拟考试(等级考)化学试题新疆阿克苏市阿瓦提四中2020届高三上学期第二次月考化学试题(已下线)专题3.6 金属材料和无机非金属材料 海水的开发利用 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》江苏省南通市启东市吕四中学2020届高三第一次质量检测化学试题四川省广安市邻水县四川省邻水中学2019-2020学年高一下学期期中考试化学试题(已下线)第02讲 物质的分离和提纯(精讲)——2021年高考化学一轮复习讲练测四川省成都市龙泉中学2021届高三上学期开学考试化学试题(已下线)第6单元 常见的非金属元素(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷(已下线)小题必刷18 氯及其化合物——2021年高考化学一轮复习小题必刷(通用版)鲁科版(2019)高一必修第二册 第1章 原子结构 元素周期律微项目 海带提碘与海水提溴高一必修第二册(人教2019版)第八章 化学与可持续发展 素养检测高一必修第一册(苏教2019版)专题3 C 高考挑战区 过模拟 2年模拟精编精练江苏省扬州市江都区大桥高级中学2021届高三上学期期初调研化学试题高一必修第一册(苏教2019)专题3 第三单元 海洋化学资源的综合利用3江苏省邗江中学2020-2021学年高一上学期期中考试化学试题山东师范大学附属中学2021届高三上学期期中考试(11月)化学试题江苏省泰州中学2021届高三上学期第二次月考化学试题专题3 第三单元综合拔高练-高中化学苏教2019版必修第一册(人教版2019)必修第二册 第八章 化学与可持续发展 第一节 自然资源的开发利用云南省普洱市景东县第一中学2021届高三上学期期末考试化学试题(已下线)解密11 化学实验(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密11 化学实验(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)重庆市永川景圣中学2020-2021学年高三上学期第二次月考化学试题吉林省通化县综合高级中学2020-2021学年高一下学期期末考试化学试题(已下线)考点30 物质的分离、提纯和检验-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点30 物质的分离、提纯和检验-备战2022年高考化学一轮复习考点帮(浙江专用)内蒙古包头市2022届高三上学期起点调研考试化学试题(已下线)课时52 物质的分离、提纯和检验-2022年高考化学一轮复习小题多维练(全国通用)重庆市开州中学高 2021-2022学年高三上学期10月月考化学试题福建省厦门市湖滨中学2021-2022学年高三上学期期中考试化学试题山东省济南市莱芜第一中学2021-2022学年高三上学期期中考试化学试题福建省厦门市翔安第一中学2021-2022学年高一下学期第一次月考(3月)化学试题湖南省浏阳市第一中学2022届高三下学期期中考试化学试题云南省昭通市永善、绥江县2021-2022学年高一上学期期末考试化学试题山东省菏泽市单县第五中学2021-2022学年高一下学期第一次段考化学(A)试题新疆叶城县第八中学2021-2022学年高三上学期第二次月考化学试题贵州省贵阳市2022-2023学年高三上学期10月质量监测化学试题四川省广安市育才学校2022-2023学年高一上学期9月月考化学试题江苏省扬州中学2022-2023学年高一上学期期中检测化学试题湖南省长沙市同升湖实验学校2022-2023学年高三上学期第三次月考化学试题第四章 非金属及其化合物 第19讲 卤素的性质及提取(已下线)题型46 从海水中提取氯、溴、碘河南省焦作第一中学2023-2024学年高三上学期9月化学模拟测试
名校
10 . 某学习小组按如下实验流程探究海带中碘的制取。
步骤(一)
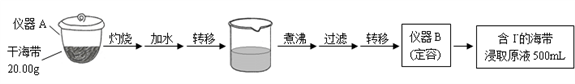
步骤(二)
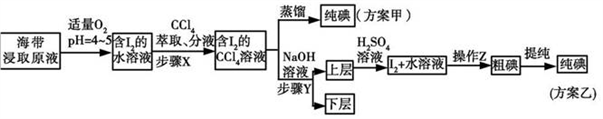
已知:①3I2+6NaOH=5NaI+NaIO3+3H2O;②常温下,碘单质微溶于水,易溶于CCl4。
请回答:
(1)步骤(一)中的仪器名称:仪器A______________ , 仪器 B_______________ 。
(2)①分液漏斗使用前须检漏,检漏方法为__________________________ 。
②步骤X中,萃取后分液漏斗内观察到的现象是_______________________ 。
③下列有关步骤Y的说法,正确的是_______________ 。
A.应控制NaOH溶液的浓度和体积 B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质 D.NaOH溶液可以由乙醇代替
④步骤(二)中操作Z的名称是_____________ 。
(3)方案甲中采用蒸馏不合理,理由是_____________________________________ 。
步骤(一)

步骤(二)

已知:①3I2+6NaOH=5NaI+NaIO3+3H2O;②常温下,碘单质微溶于水,易溶于CCl4。
请回答:
(1)步骤(一)中的仪器名称:仪器A
(2)①分液漏斗使用前须检漏,检漏方法为
②步骤X中,萃取后分液漏斗内观察到的现象是
③下列有关步骤Y的说法,正确的是
A.应控制NaOH溶液的浓度和体积 B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质 D.NaOH溶液可以由乙醇代替
④步骤(二)中操作Z的名称是
(3)方案甲中采用蒸馏不合理,理由是
您最近一年使用:0次



