湖南省常德市第一中学2020-2021学年高一上学期期中考试化学试题
湖南
高一
期中
2020-12-07
571次
整体难度:
适中
考查范围:
认识化学科学、常见无机物及其应用、化学实验基础
一、单选题 添加题型下试题
| A.雾霾天,汽车车灯照出光亮“通路”的现象属于丁达尔效应 |
| B.雾和霾都是混合物 |
| C.防雾霾口罩的原理与过滤、渗析类似,防雾霾效果好的口罩往往呼吸阻力较大 |
D.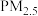 是指直径小于或等于2.5 μm的污染物颗粒,该颗粒直径完全在胶体粒子的直径范围内 是指直径小于或等于2.5 μm的污染物颗粒,该颗粒直径完全在胶体粒子的直径范围内 |
混合物 | 纯净物 | 单质 | 电解质 | |
A | 盐酸 | NaOH | 石墨 | K2SO4 |
B | 空气 | Fe(OH)3胶体 | 铁 | Na2CO3 |
C | 氨水 | CaCl2 | 水银 | NaCl溶液 |
D | CuSO4·5H2O | 明矾 | C70 | NaCl |
| A.A | B.B | C.C | D.D |
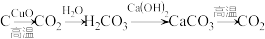
| A.化合、置换、分解、复分解 |
| B.置换、复分解、化合、分解 |
| C.置换、化合、分解、复分解 |
| D.置换、化合、复分解、分解 |
| A.150mL1mol/LNaCl溶液 | B.25mL3mol/LNH4Cl溶液 |
| C.75mL2mol/LMgCl2溶液 | D.75mL2mol/LFeCl3溶液 |
 CuCl2+2FeCl2,则下列判断正确的是( )
CuCl2+2FeCl2,则下列判断正确的是( )| A.该反应是置换反应 |
| B.该反应中FeCl3作还原剂 |
| C.还原性:Cu>Fe2+ |
| D.氧化性:CuCl2>FeCl3 |
A.1mol  的质量为17 的质量为17 |
| B.二氧化碳的摩尔质量为44g |
| C.铁原子的摩尔质量等于它的相对原子质量 |
D.一个钠原子的质量约等于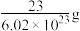 |
| A.并不是所有金属或它们的化合物在灼烧时都会使火焰呈现出特征颜色 |
| B.焰色试验是化学变化 |
| C.实验前后及过程中更换药品时需用稀盐酸将铂丝洗净并灼烧 |
| D.金属钠的焰色为黄色 |
A.Na+、K+、 、 、 |
B.Ba2+、K+、 、Cl- 、Cl- |
C.Cu2+、K+、 、 、 |
D.Na+、K+、Cl-、 |
【知识点】 离子共存 限定条件下的离子共存解读
A. | B.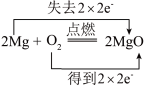 |
C. | D.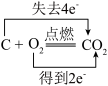 |
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O Fe(OH)3+3H+ Fe(OH)3+3H+ |
| B.用小苏打治疗胃酸过多:NaHCO3+H+=Na++CO2↑+H2O |
C.实验室用浓盐酸与MnO2反应制Cl2:MnO2+4H++2Cl- Cl2↑+Mn2++2H2O Cl2↑+Mn2++2H2O |
| D.用FeCl3溶液腐蚀印刷铜电路板:Fe3++Cu=Fe2++Cu2+ |
【知识点】 离子方程式的正误判断解读 氯气的实验室制法解读 印刷电路板
KCl | K2SO4 | ZnSO4 | ZnCl2 | |
第一份 | 0.3 mol | 0.2 mol | 0.1 mol | - |
第二份 | 0.1 mol | 0.3 mol | - | 0.1 mol |
| A.完全不同 | B.完全相同 |
| C.仅c(K+)相同 | D.仅c(Cl-)相同 |
| A.常温常压下,48 g O3含有的氧原子数为3NA |
| B.1 mol Na与一定量的O2反应生成Na2O和Na2O2,转移的电子数为1.5NA |
| C.4℃时9 mL H2O和标准状况下11.2 L N2含有相同的原子数 |
| D.标准状况下,22.4 L CCl4中含有NA个分子 |
二、 添加题型下试题
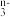 和F2可发生反应RO
和F2可发生反应RO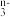 +F2+2OH—=RO
+F2+2OH—=RO +2F—+H2O,从而可知在RO
+2F—+H2O,从而可知在RO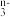 中,元素R的化合价为
中,元素R的化合价为| A.+3价 | B.+4价 | C.+5价 | D.+6价 |
【知识点】 离子反应的发生及书写 化学式与化合价
三、单选题 添加题型下试题
| A.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 |
| B.排水量气,左右液面相平后,未冷却到室温立即读数,所得气体的体积偏大 |
| C.称取2.3gNaCl固体,砝码放在托盘天平的左边,所称量固体药品质量偏小 |
| D.用量筒量取5.0mL浓硫酸,仰视读数,所得到浓硫酸的体积偏大 |
| A.Fe可在Cl2中剧烈燃烧,生成物溶于水后呈现红褐色 |
| B.氯气有毒,为了防止污染环境,多余的氯气可以用饱和NaCl溶液吸收 |
| C.检验HCl气体中是否混有Cl2的方法是将气体通入硝酸银溶液 |
| D.氯气泄漏,可用浸透肥皂液的毛巾捂住口鼻,向高处转移 |
| A.热稳定性:NaHCO3<Na2CO3,在水中的溶解性:NaHCO3>Na2CO3 |
| B.可以用加热的方式除去Na2CO3固体中的NaHCO3杂质 |
| C.等质量的Na2CO3和NaHCO3分别与足量的稀盐酸充分反应后,产生的CO2质量相同 |
| D.可以用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液 |
四、多选题 添加题型下试题

| A.装置①可以用稀硫酸代替稀盐酸 |
| B.装置⑤中石灰水变浑浊后,再点燃酒精灯 |
| C.装置②③中分别盛装饱和 Na2CO3溶液、浓H2SO4 |
| D.装置⑥中有黑色沉淀,发生的反应是PdCl2+CO+H2O=Pd↓+CO2+2HCl |
五、单选题 添加题型下试题
| A.滴有酚酞的NaHCO3溶液呈浅红色,微热后红色加深,是因为NaHCO3分解生成了Na2CO3 |
| B.钠保存在煤油中,是因为煤油不与钠发生反应,钠比煤油密度大,煤油可以使钠隔绝空气和水蒸气 |
| C.用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应 |
| D.钠长期暴露在空气中的产物是Na2CO3,原因是钠与氧气生成的Na2O与水和二氧化碳反应 |

选项 | 实验现象 | 结论 |
A | 滴有KSCN的FeCl2溶液变红色 | HClO具有氧化性 |
B | 滴有酚酞的NaOH溶液褪色 | Cl2具有酸性 |
C | 紫色石蕊溶液先变为红色后褪色 | Cl2具有漂白性 |
D | KI﹣淀粉溶液变蓝色 | Cl2具有氧化性 |
| A.A | B.B | C.C | D.D |
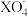 =2X2++5Z2+8H2O②2A2++B2=2A3++2B- ③2B-+Z2=B2+2Z-根据上述反应,判断下列结论中错误的是
=2X2++5Z2+8H2O②2A2++B2=2A3++2B- ③2B-+Z2=B2+2Z-根据上述反应,判断下列结论中错误的是| A.溶液中可发生:Z2+2A2+=2A3++2Z- | B.Z2在③反应中为氧化剂 |
C.氧化性强弱的顺序为: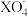 >Z2>B2>A3+ >Z2>B2>A3+ | D.X2+是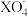 的氧化产物 的氧化产物 |
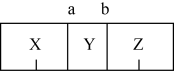
| A.若Y是O2 ,则X可能是CH4 | B.分子数目:X=Z=2Y |
| C.若X是N2,则Z可能是CO | D.气体密度:X=Z=2Y |
【知识点】 阿伏加德罗定律
| A.2.1 g | B.3.6 g | C.7.2 g | D.无法确定 |
 ,取此溶液0.5VL,用水稀释至2VL,则稀释后溶液中Fe3+的物质的量浓度为( )
,取此溶液0.5VL,用水稀释至2VL,则稀释后溶液中Fe3+的物质的量浓度为( )A.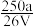 mol·L-1 mol·L-1 | B.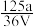 mol·L-1 mol·L-1 | C.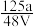 mol·L-1 mol·L-1 | D.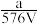 mol·L-1 mol·L-1 |
| A.A与B两种气体的相对分子质量之比为a∶b |
| B.在同温同压的条件下,A与B两种气体的密度之比为b∶a |
| C.同质量的A、B两种气体的分子个数之比为b∶a |
| D.相同条件下,同体积A气体与B气体的质量之比为a∶b |
六、解答题 添加题型下试题
(1)上述反应中氧化剂是
(2)H2SO4在上述反应中表现出来的性质是
A.酸性 B.氧化性 C.吸水性 D.脱水性
II.某溶液中只含有Ba2+、Mg2+、Ag+三种阳离子,现用适量的NaOH溶液、稀盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如图所示:
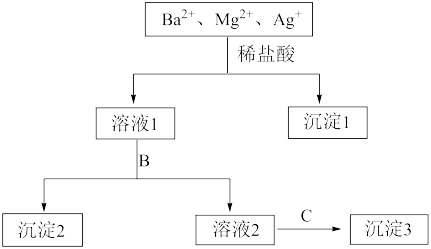
(1)沉淀1的化学式为
(2)若试剂B为Na2SO4溶液,则沉淀2化学式为
(3)若试剂B为NaOH溶液,则生成沉淀2的离子方程式为
(4)如果原溶液中Ba2+、Mg2+、Ag+的浓度均为0.1mol·L-1,且溶液中含有的阴离子只有
 ,则溶液中
,则溶液中 浓度为
浓度为七、计算题 添加题型下试题
(1)等质量的SO2和SO3所含的氧原子个数之比是
(2)4.8 g CH4中所含氢原子个数与
(3)标准状况下,测得1.32 g某气体的体积为0.672 L,则此气体的摩尔质量为
(4)将4 g NaOH溶于水配成250 mL溶液,溶液中NaOH的物质的量浓度为
(5)100 mL 0.3 mol/L Na2SO4溶液和50 mL 0.2 mol/L Al2(SO4)3溶液混合后,溶液中
 的物质的量浓度为
的物质的量浓度为八、解答题 添加题型下试题

请回答下列问题:
(1)G的化学式为
(2)反应①②③④中
(3)写出下列反应的化学方程式:A→B+C+D:
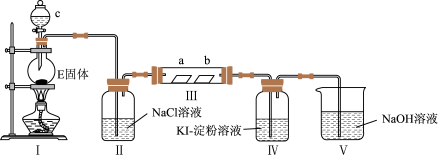

(1)c的仪器名称为:
(2)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在上图装置Ⅱ与Ⅲ之间添加图中的
Ⅱ.某学生设计如下实验装置利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
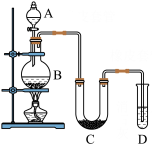
(1)漂白粉将在U形管中产生,其化学反应方程式是
(2)此实验结果所得Ca(ClO)2产率太低。经分析并查阅资料发现主要原因是在U形管中存在两个副反应:
①温度较高时氯气与消石灰反应生成了Ca(C1O3)2,为避免此副反应的发生,可采取的措施是
②试判断另一个副反应,为避免此副反应发生,可采取的措施是
【知识点】 氯气的化学性质 氯气的实验室制法解读 物质性质实验方案的设计解读
九、计算题 添加题型下试题
(1)原固体混合物中 Na2CO3的物质的量:n(Na2CO3)=
(2)V=
Ⅱ.研究性学习小组欲用化学方法测量一个不规则容器的体积。把35.1 g NaCl放入500 mL烧杯中,加入150 mL蒸馏水使之完全溶解,将溶解后的溶液全部转移入不规则容器中,用蒸馏水稀释到完全充满容器,从中取出溶液l00 mL,该溶液恰好与2 L 0.100 mol/L AgNO3的溶液完全反应,则不规则容器的体积是
试卷分析
试卷题型(共 30题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 分散系概念 胶体 | |
| 2 | 0.85 | 分类方法的应用 单质和化合物 非电解质、电解质物质类别判断 | |
| 3 | 0.85 | 四种基本反应类型 碳元素及其化合物 | |
| 4 | 0.85 | 物质的量浓度概念、含义 某溶液与物质的量浓度相关的物理量的判断 物质的量浓度计算-与溶质成分有关的计算 | |
| 5 | 0.85 | 氧化还原反应基本概念 氧化性、还原性强弱的比较 氧化还原反应的应用 氧化还原反应的规律 | |
| 6 | 0.85 | 阿伏加德罗常数 摩尔质量的概念 摩尔质量与相对原子质量区别与联系 | |
| 7 | 0.65 | 焰色试验 | |
| 8 | 0.65 | 离子共存 限定条件下的离子共存 | |
| 9 | 0.65 | 氧化还原反应定义、本质及特征 单线桥、双线桥分析氧化还原反应 氧化还原反应有关计算 氧化还原反应的规律 | |
| 10 | 0.65 | 离子方程式的正误判断 氯气的实验室制法 印刷电路板 | |
| 11 | 0.85 | 物质的量浓度概念、含义 某溶液与物质的量浓度相关的物理量的判断 物质的量浓度计算-溶液混合的有关计算 | |
| 12 | 0.65 | 阿伏加德罗常数的应用 结合气体物质与NA相关推算 结合氧化还原反应知识与NA相关推算 结合物质结构基础知识与NA相关推算 | |
| 14 | 0.65 | 配制一定物质的量浓度的溶液的步骤、操作 配制一定物质的量浓度的溶液实验的误差分析 配制一定物质的量浓度溶液的综合考查 | |
| 15 | 0.85 | 氯气的物理性质 氯气的化学性质 氯气与碱溶液反应 | |
| 16 | 0.85 | 摩尔质量 物质的量有关计算 | |
| 17 | 0.85 | 碳酸钠 氢氧化钠、碳酸钠混合溶液与盐酸反应相关考查 碳酸氢钠的不稳定性 碳酸钠与碳酸氢钠性质的比较 | |
| 19 | 0.4 | 钠单质的保存与用途 过氧化钠 | |
| 20 | 0.65 | 氯气的实验室制法 氯气与还原性化合物的反应 氯气与水的反应 氯气与碱溶液反应 | |
| 21 | 0.65 | 氧化性、还原性强弱的比较 氧化还原反应在生活、生产中的应用 氧化还原反应的规律 | |
| 22 | 0.65 | 阿伏加德罗定律 | |
| 23 | 0.85 | 过氧化钠与水的反应 过氧化钠和二氧化碳反应 过氧化钠的相关计算 | |
| 24 | 0.65 | 根据n=m/M进行相关计算 依据物质的量浓度公式的基础计算 物质的量浓度计算-溶液稀释的有关计算 | |
| 25 | 0.65 | 气体摩尔体积 阿伏加德罗定律 阿伏加德罗定律及其推论 阿伏加德罗定律的应用 | |
| 二、 | |||
| 13 | 0.85 | 离子反应的发生及书写 化学式与化合价 | |
| 三、多选题 | |||
| 18 | 0.65 | 钠的化学性质 镁 物质性质的探究 物质性质实验方案的设计 | |
| 四、解答题 | |||
| 26 | 0.85 | 离子反应在混合物分离、除杂中的应用 离子反应在化合物组成的分析、鉴定的应用 常见氧化剂与还原剂 | 实验探究题 |
| 28 | 0.65 | 氧化还原反应基本概念 钠与水反应原理 过氧化钠与水的反应 碳酸氢钠的不稳定性 | 无机推断题 |
| 29 | 0.65 | 氯气的化学性质 氯气的实验室制法 物质性质实验方案的设计 | 实验探究题 |
| 五、计算题 | |||
| 27 | 0.65 | 气体摩尔体积 根据n=m/M进行相关计算 物质的量浓度计算-溶液混合的有关计算 | |
| 30 | 0.65 | 化学方程式计算中物质的量的运用 碳酸钠与盐酸的反应 碳酸钠、碳酸氢钠混合物的有关求算 物质含量的测定 | |



