内蒙古包钢第一中学2019-2020学年高一上学期10月月考化学试题
内蒙古
高一
阶段练习
2020-03-21
453次
整体难度:
适中
考查范围:
化学实验基础、认识化学科学
内蒙古包钢第一中学2019-2020学年高一上学期10月月考化学试题
内蒙古
高一
阶段练习
2020-03-21
453次
整体难度:
适中
考查范围:
化学实验基础、认识化学科学
一、单选题 添加题型下试题
单选题
|
较易(0.85)
名校
您最近一年使用:0次
2020-09-26更新
|
560次组卷
|
78卷引用:2010年宁夏西吉县回民中学高二下学期期末考试化学试题
(已下线)2010年宁夏西吉县回民中学高二下学期期末考试化学试题(已下线)吉林省长春外国语学校2010-2011学年高一第一次月考理科化学试题(已下线)2010年辽宁省沈阳二中高一上学期10月月考(化学)(已下线)2010年河南省河南大学附中高一上学期期中考试化学卷(已下线)2010年黑龙江牡丹江一中高一上学期期中考试化学试卷(已下线)2010年江苏省南通市高一上学期期中联考化学试卷(已下线)2011-2012学年度黑龙江鹤岗一中高一下学期期中考试化学试卷(已下线)2014届河南省平顶山市部分高中高一上学期期中联考化学试卷(已下线)2013-2014学年云南省玉溪一中高一上学期期中考试化学试卷(已下线)2013-2014学年海南省三亚市一中高一上学期期中考试化学试卷(A)2014-2015学年广东省中山市杨仙逸中学高一上学期月考化学试卷2015-2016学年吉林省扶余市第一中学高一上学期第一次月考化学试卷2015-2016学年重庆市杨家坪中学高一上学期第一次月考化学试卷2015-2016学年海南省文昌中学高一上期中测试化学试卷2016届辽宁省大连市高三上学期高考模拟化学试卷2015-2016学年陕西省安康市石泉中学高一上月考化学试卷2016-2017学年湖北省荆州中学高一上第一次质检化学试卷2016-2017学年内蒙古赤峰二中高一上9月月考化学试卷2016-2017学年河南省师大附中高一上期中化学试卷2016-2017学年黑龙江牡丹江中学高二上期中文化学卷2016-2017学年宁夏银川二中高一上期中化学试卷2016-2017学年辽宁省庄河高级中学高一上期中化学卷2016-2017学年湖南省浏阳一中高一12月月考化学试卷2016-2017学年贵州省都匀第一中学高一(3月)开学质检化学试卷贵州省遵义航天高级中学2016-2017学年高一下学期期中考试理科综合化学试题辽宁省大石桥市第二高级中学2016-2017学年高二学业水平模拟测试化学试题广西宾阳县宾阳中学2017-2018学年高一9月月考化学试题贵州省遵义市航天高级中学2017-2018学年高一上学期第一次(9月)月考理科综合化学试题江西省南昌市第二中学2017-2018学年高一上学期第一次月考化学试题四川省南充高级中学2017-2018学年高一9月月考化学试题甘肃省武威市第六中学2017-2018学年高一上学期第一次学段考试化学试题河南省张家口市涿鹿中学2017-2018学年高一10月化学试题甘肃省武威第十八中学2017-2018学年高一上学期第一次月考化学试题吉林省长春外国语学校2017-2018学年高一上学期期中考试化学试题广西河池市高级中学2017-2018学年高一上学期第一次月考化学试题辽宁省辽河油田第二高级中学2017-2018学年高一上学期第一次月考化学试题湖南辰溪博雅实验学校2018-2019学年高一上学期8月月考化学试题四川省宜宾市南溪区第二中学2018-2019学年高一上学期9月月考化学试题北京市首都师范大学附属中学2018-2019学年高一上学期期中考试化学试题江西省上饶二中2018-2019学年高一上学期期中考试化学试题【校级联考】湖南省浏阳市六校联考2018-2019学年高一上学期期中考试化学试题河南省信阳市罗山高级中学2018-2019学年高一上期期中考试化学试题步步为赢 初高中衔接教材化学暑假作业:第25课时 化学实验基本方法甘肃省武威第十八中学2019-2020学年高一上学期第一次月考化学试题新疆石河子第二中学2019-2020学年高一上学期第一次阶段考试化学试题宁夏青铜峡市高级中学2019-2020学年高一上学期期中考试化学试题广西柳州市柳江中学2019-2020学年高二上学期期中考试化学(文)试题黑龙江省大庆市第四中学2019-2020学年高一上学期第二次月考化学试题西藏自治区拉萨市那曲第二高级中学2019-2020学年高一上学期期中考试化学试题安徽省阜阳市颍上二中2019-2020学年高一上学期第二次段考化学试题黑龙江省牡丹江市第三高级中学2019-2020学年高一上学期期末考试化学试题内蒙古包钢第一中学2019-2020学年高一上学期10月月考化学试题甘肃省兰州市兰州第一中学2019—2020学年高一上学期期末考试化学试题吉林省长春市第二十九中学2019-2020学年高一上学期期末考试化学(文)试题陕西省咸阳市实验中学2019-2020学年高一上学期第一次月考化学试题黑龙江省黑河市嫩江市高级中学2019-2020学年高一下学期第一次月考化学试题山西省朔州市怀仁市第一中学云东校区2019-2020学年高一期末考试化学试题(已下线)3.2.2 硫酸 酸雨及其防治练习(2)——《高中新教材同步备课》(鲁科版 必修第一册)(已下线)4.1.2 硫酸的工业制备 浓硫酸的性质练习(2)——《高中新教材同步备课》(苏教版 必修第一册)四川省自贡市旭川中学2020-2021学年高一上学期开学考试化学试题广东东莞松山湖学校2019-2020学年度高一上学期期中考试化学试题四川省广安市广安中学2020-2021学年高一上学期第一次月考化学试题广西壮族自治区上林县中学2019-2020学年高一下学期期末考试化学(文)试题甘肃省岷县第二中学2020-2021学年高一上学期期中考试化学试题新疆生产建设兵团第四师第一中学2020-2021学年高一上学期期中考试化学试题甘肃省兰州市第四片区2020-2021学年高一上学期期末考试化学试题甘肃省陇南市徽县第三中学2020-2021学年高一上学期期末考试化学试题宁夏银川市长庆高级中学2020-2021学年高一上学期期末考试化学试题新疆乌鲁木齐市第一中学2020-2021学年高一下学期入学检测化学试题河南省汤阴县五一中学2019-2020学年高一下学期期中考试化学试题甘肃省甘南州夏河中学2020-2021学年高一上学期期中考试化学试题甘肃省张掖市2018-2019学年高一上学期期中考试化学试题陕西省西安市建筑科技大学附属中学2021-2022学年高一上学期第一次月考化学试题四川省绵阳东辰国际学校2021-2022学年高一上学期第二次月考(10月)化学试题上海市久隆模范中学2021-2022学年高一上学期期中考试化学试题新疆伊犁新源县2020-2021学年高一11月月考化学试题陕西省宜君县高级中学2021-2022学年高一上学期第一次月考化学试题陕西省西安市鄠邑区第二中学2021-2022学年高一上学期第一次月考化学试题
单选题
|
适中(0.65)
名校
2. 下列说法正确的是
| A.摩尔既是物质的量的单位,又是粒子的数量单位 |
| B.2 mol O2的摩尔质量是64 g/mol |
| C.当摩尔质量以g·mol-1为单位时,在数值上与阿伏加 德罗常数个该物质的微粒的质量总和相等(质量以g为单位) |
| D.1 mol SO2中含有2 mol氧元素 |
您最近一年使用:0次
2019-09-16更新
|
521次组卷
|
3卷引用:河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题
单选题
|
容易(0.94)
名校
解题方法
3. 下列实验操作:①过滤 ②溶解 ③蒸馏 ④取用药品 ⑤萃取 ⑥蒸发 ⑦配制一定浓度的溶液,一定要用到玻璃棒的是
| A.①②④⑥ | B.①②③⑥ | C.①②⑥⑦ | D.①④⑤⑥ |
您最近一年使用:0次
2020-03-17更新
|
97次组卷
|
5卷引用:内蒙古包钢第一中学2019-2020学年高一上学期10月月考化学试题
单选题
|
较易(0.85)
名校
4. 用NA表示阿伏加 德罗常数,下列叙述正确的是
| A.标准状况下,22.4L H2O含有的分子数为1NA |
| B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA |
| C.通常状况下,1NA个CO2分子占有的体积为22.4L |
| D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA |
您最近一年使用:0次
2020-05-18更新
|
3023次组卷
|
191卷引用:2010年江西省南昌三中高一上学期第一次月考(化学)
(已下线)2010年江西省南昌三中高一上学期第一次月考(化学)(已下线)2010年广东省执信中学高一上学期期中考试化学卷(已下线)2010年云南省个旧一中高一上学期期中检测化学卷(已下线)2010年陕西省宝鸡中学高一上学期期中考试化学试卷(已下线)2010年内蒙古赤峰市田家炳中学高一上学期期中考试化学试卷(已下线)2010年青海省青海师大附中高一上学期期中考试化学试卷(已下线)2010年陕西省西安铁一中高一第一学期期中考试化学试卷(已下线)2010—2011学年黑龙江省哈六中高一上学期期末考试化学试卷(已下线)2010—2011学年广东省揭阳一中高一上学期期末考试化学试卷(已下线)2011-2012年辽宁省开原高中高一上学期第一次考试化学试卷(已下线)2011-2012年山东省莒南县三中高一上学期期中考试化学试卷(已下线)2011-2012年山西省平遥中学高一上学期期中考试化学(文)试卷(已下线)2011-2012学年北京市重点中学高二上学期期中考试化学(文)试卷(已下线)2011-2012学年成都市六校协作体高一上学期期中考试化学试卷(已下线)2011-2012学年安徽师大附中高一第一学期期中考查化学试卷(已下线)2011-2012学年云南省蒙自县文澜高级中学高一上学期期中考试化学试卷(已下线)2011-2012学年浙江省嘉兴市八校高一上学期期中联考化学试卷(已下线)2011-2012学年广东省翠园中学高一上学期期中考试化学试卷(已下线)2011-2012学年安徽省桐城十中高一上学期期中考试化学试卷(已下线)2011-2012学年云南省开远四中高一上学期期中考试化学试卷(已下线)2011-2012学年黑龙江省龙东地区高一上学期高中教学联合体期末考试化学试卷(已下线)2011-2012学年云南省玉溪一中高二上学期期末考试化学试卷(已下线)2011-2012学年浙江省岱山大衢中学高一上学期期末考试化学试卷(已下线)2011-2012学年四川省成都铁中高一下学期2月学业检测化学试卷(已下线)2011-12学年福建莆田十八中高一上学期期未测试(A)化学试卷(已下线)2011-2012学年云南蒙自高中高一上学期期末考试化学试卷(已下线)2011-2012学年河南省焦作市高一第一学期期末考试化学试卷(已下线)2011-2012学年河南省郑州市智林学校高一上学期期中考试化学试卷(已下线)2011-2012学年陕西省西安市第一中学高一上学期期中考试化学试卷(已下线)2011-2012学年陕西省富县高级中学高一上学期第二次周检测化学试卷(已下线)2012-2013学年江苏省南京学大教育专修学校高一9月月测化学试卷(已下线)2012-2013学年广东省连州市连州中学高一10月月考化学试卷(已下线)2011-2012学年安徽省合肥一中高一上学期期中考试化学试卷(已下线)2012-2013河南省鄢陵县一中高一第一次考试化学试卷(已下线)2012-2013学年山西省大同市实验中学高一第一次月考化学试卷(已下线)2012-2013学年云南省芒市中学高一上学期期中考试化学试卷(已下线)2012-2013学年江西省九江市修水一中高一第一次段考化学试卷(已下线)2012-2013学年重庆市49中七校联盟高一上学期期中考试化学试卷(已下线)2012-2013学年辽宁省实验中学分校高一12月月考化学试卷(已下线)2012-2013学年辽宁盘锦第二高中高一第二次阶段考试化学试卷(已下线)2012-2013学年吉林长春实验中学高一上学期第一次月考化学试卷(已下线)2012-2013学年广东省龙川一中高一12月月考化学试卷(已下线)2012-2013学年广东省揭阳一中高一上学期期末考试化学试卷(已下线)2012-2013学年广东惠州实验中学高二上期中考试文科化学试卷(已下线)2012-2013学年广东省陆丰市碣石中学高一第四次月考化学试卷(已下线)2012-2013学年福建省清流一中高一第三阶段试化学试卷(已下线)2012-2013学年安徽望江三中高一上期末考试化学试卷(已下线)2012-2013学年河北省石家庄市第一中学高一上学期期中考试化学试卷(已下线)2012-2013学年河北省石家庄市第二实验中学高一上学期期中考化学卷(已下线)2013届广东省揭阳第三中学高一下学期第二次阶段考试文科化学试卷(已下线)2013-2014学年云南省玉溪一中高一上学期期中考试化学试卷(已下线)2013-2014学年山东省临沂市重点中学高一上学期期中考试化学试卷(已下线)2013-2014学年甘肃省嘉峪关市一中高一上学期期中考试化学试卷(已下线)2013-2014学年山东省济宁市嘉祥一中高一12月质检化学试卷(已下线)2013-2014学年江西赣州市四所重点中学高一上学期期末联考化学试卷(已下线)2014届广东阳东广雅中学阳春实验中学上学期期末高一化学试卷(已下线)2013-2014河南省开封高一第一次月考化学试题化学试卷(已下线)2013-2014山西省太原五中高二下学期期中化学(文)试卷(已下线)2014-2015学年山东桓台第二中学高一上学期(10月)检测化学试卷(已下线)2014-2015学年河南省周口中英文学校高一10月月考化学试卷(已下线)2014-2015学年河南郑州市第四十七中学高一上10月月考化学试卷(已下线)2014—2015学年甘肃兰州一中高一上学期期中考试化学卷(已下线)2014-2015学年吉林省长春外国语学校高一上学期期中化学试卷(已下线)2014-2015学年甘肃省高台县一中高一上学期期中化学试卷2014-2015学年浙江省湖州中学高一上学期期中化学试卷2014-2015湖南省边城高级中学高一上学期期中考试化学试卷2015届湖南省益阳市六中高三上学期期中考试化学试卷2014-2015云南省景洪市三中高一上学期期中化学试卷2015届湖南省益阳市第六中学高三上学期期中考试化学试卷2015-2016学年北大附中河南分校高一上9月考化学试卷2016届河北省故城县高级中学高三9月月考化学试卷2015-2016学年福建省龙海市程溪中学高一上学期期中测试化学试卷2015-2016学年山东省桓台二中高一上学期期中测试化学试卷2015-2016学年湖南常德石门第一中学高一上期中化学试卷2015-2016学年安徽省铜陵一中高一上期中测试化学试卷2015-2016学年湖北省枣阳市第七中学高一上学期期中考试化学试卷2015-2016学年河北省正定中学高一上学期期末化学试卷2015-2016学年贵州省凯里一中高一下开学考试化学试卷2015-2016学年辽宁省实验中学高一上12月月考化学试卷2015-2016学年甘肃省嘉峪关一中高一上学期期末化学试卷2015-2016学年广东省汕头市高一下期末化学试卷2016-2017学年河北省定州二中高一上学期第一次月考化学试卷2016-2017学年广西陆川中学高一上9月月考化学试卷2016-2017学年四川省雅安中学高一上第一次月考化学卷2016-2017学年河北正定中学高一上第一次月考化学试卷2016-2017学年湖北省部分重点中学高一上学期期中化学试卷2016-2017学年贵州省安顺平坝第一高级中学高一上期中化学卷2016-2017学年辽宁省沈阳市城郊市重点联合体高一上期中化学卷2016-2017学年广西桂林中学高二上模拟考试化学卷2016-2017学年贵州省都匀第一中学高一(3月)开学质检化学试卷河北省定州中学2016-2017学年高二下学期期中考试化学试题吉林省汪清县第六中学2017-2018学年高一9月月考化学试题黑龙江省饶河县高级中学2017-2018学年高一上学期第一次月考化学试题江西省临川实验学校2017-2018学年高一(普通班)上学期第一次月考化学试题河北省成安县第一中学2016-2017学年高一10月月考化学试题河北省成安一中2017-2018学年高一10月月考化学试题山西省康杰中学2017-2018学年高一上学期期中考试化学试题广东省茂名市第十中学2017-2018学年高一上学期期中考试化学试题甘肃省甘谷县第一中学2017-2018学年高二上学期第二次月考化学试题山西大学附属中学2017-2018学年高一上学期第三次月考(12月)化学试题山西大学附中 2017~2018学年高一上学期第三次月考(12月)化学试题甘肃省嘉峪关市酒钢三中2017-2018学年高二上学期第二次月考化学试题福建省三明市A片区高中联盟校2017-2018学年高一上学期阶段性考试化学试题【全国百强校】湖南省师范大学附属中学2017-2018学年高二下学期期中考试化学试题河南省灵宝三高2017-2018学年高一上学期第三次质量检测化学试题陕西省铜川市煤炭建设公司第一中学2018-2019学年高一上学期10月月考化学试题河南省新乡市新乡县龙泉中学2018-2019学年高一上学期10月月考理科综合化学试题安徽省合肥市第九中学2018-2019学年高一上学期第一次月考化学试题山西省忻州市第二中学2018-2019学年高一上学期10月月考化学试题河南省济源市第四中学2018-2019学年高一上学期第一次质量检查化学试题云南省峨山彝族自治县第一中学2018-2019学年高一上学期期中考试化学试题湖北省利川市第五中学2018-2019学年高一上学期期中模拟考试化学试题江西省上饶市“山江湖”协作体2018-2019学年高一上学期第三次月考化学试题浙江省温州市求知中学2018-2019学年高一上学期第二次月考化学试题广西蒙山县第一中学2017-2018学年高二上学期期末考试化学试题福建省莆田市第八中学2018-2019学年高一下学期期中考试化学试题浙江省温州市求知中学2018-2019学年高一上学期期中考试化学试题2山西省运城市永济涑北中学2019-2020学年高一上学期9月月考化学试卷湖南省邵东县第一中学2019-2020学年高一上学期第一次月考化学试题新疆石河子第二中学2019-2020学年高一上学期第一次阶段考试化学试题新疆维吾尔自治区喀什第二中学2019-2020学年高一9月月考化学试题吉林省榆树市第一高级中学2019-2020学年高一上学期期中考试化学试卷甘肃省兰州市联片办学2019-2020学年高一上学期期中考试化学试题辽宁省大连市2019-2020学年高一上学期期中考试化学试题北京市丰台区2019-2020学年高一上学期期中考试化学(A卷)试题黑龙江省牡丹江市第三高级中学2019-2020学年高二上学期期中考试化学(文)试题湖南省娄底市娄星区2019-2020学年高一上学期期中考试化学试题广西壮族自治区桂林市逸仙中学2019-2020学年高二上学期期中考试化学(文)试题福建省龙海市程溪中学2019-2020学年高一上学期期中考试化学试题福建省永泰县第一中学2019-2020学年高一上学期期中考试化学试题黑龙江省哈尔滨市阿城区龙涤中学2019-2020学年高一上学期第一次段考化学试题湖南省株洲市茶陵县第三中学2019-2020学年高一上学期第三次月考化学试题河南省三门峡市灵宝实验高级中学2019-2020学年高一上学期12月月考化学试题山西省应县第一中学校2019-2020学年高一上学期第四次月考化学试题吉林省长春市榆树市2019-2020学年高一上学期期末考试化学试题宁夏银川市兴庆区长庆高级中学2019-2020学年高一上学期期末考试化学试题2019-2020学年高一上学期期末复习《新题速递·化学》12月(考点06-11)山西省朔州市怀仁第一中学2018-2019学年高一上学期期末考试化学试题湖北省荆州市2019-2020学年高一上学期期末考试化学试题内蒙古包钢第一中学2019-2020学年高一上学期10月月考化学试题甘肃省甘南藏族自治州合作第一中学2019-2020学年高一上学期9月月考化学试题江西省南昌市八一中学2019-2020学年高一下学期开学考试(5月)化学试题湖北省武汉市黄陂区第六中学2019-2020学年高一3月月考化学试卷吉林省长春市第二十九中学2019-2020学年高二上学期期末考试化学试题吉林省吉林地区普通高中友好学校联合体第三十届基础年段2019-2020学年高二下学期期末联考化学试题湖北省黄冈市黄梅国际育才高级中学2019-2020学年高一上学期10月月考化学试题河北省衡水市阜城中学2020-2021学年高二上学期开学考试化学试题湖南省衡阳县第四中学2021届高三8月月考化学试题山西大学附属中学2020-2021学年高上学期10月月考化学试题江西省余干县黄金埠中学2020-2021学年高一上学期第一次月考化学试题山西省太原市山西大学附属中学2020-2021学年高一上学期10月(总第一次)模块诊断化学试题天津市外国语大学附属外国语学校2018-2019学年高一上学期第一次月考化学试题河南省洛阳市第一中学2020-2021学年高一上学期第一次月考化学试题(已下线)【南昌新东方】14. 豫章中学 刘惠文浙江省温州新力量联盟2020-2021学年高一上学期期中联考化学试题宁夏石嘴山第三中学2020-2021学年高一上学期期中考试化学试题广东省汕头市澄海中学2020-2021学年高一上学期期中考试化学试题(已下线)【浙江新东方】在线化学 (9).浙江省金华市曙光学校2020-2021学年高一上学期期中考试化学试题广西岑溪市2020-2021学年高一上学期期中考试化学试题(已下线)【浙江新东方】在线化学20黑龙江嫩江市高级中学2020-2021学年高一上学期第一次月考化学试题甘肃省张掖市2020-2021学年高一上学期期末学业水平质量检测化学试题甘肃省陇南市徽县第三中学2020-2021学年高一上学期期末考试化学试题河南省汤阴县五一中学2019-2020学年高一下学期期中考试化学试题河南省宏力学校2020-2021学年高一上学期期中考试化学试题(已下线)【浙江新东方】【2021.4.27】【宁波】【高一上】【高中化学】【00145】黑龙江省绥化市肇东四中2020-2021学年高二下学期期末化学试题安徽省淮北市树人高级中学2021-2022学年高一上学期第一阶段测试化学试题上海实验高中2021-2022学年高一上学期第一次测试化学试题宁夏唐徕回民中学2021-2022学年高一上学期期中考试化学试题陕西省咸阳市高新一中2021-2022学年高一上学期期中质量检测化学试题宁夏石嘴山市平罗中学2021-2022学年高一上学期期中考试化学试题青海省海南州中学2021-2022学年高一上学期第一次月考化学试题内蒙古巴彦淖尔市临河区第三中学2021-2022学年高一上学期期中考试化学试题新疆和田地区皮山县高级中学2021-2022学年高二下学期期末考试化学试题湖南省长沙县第九中学2021-2022学年高一上学期月考化学试题四川省达州天立学校2022-2023学年高一上学期11月月考化学试题江苏省南通市海安李堡中学2021-2022学年高一上学期期中考试化学试题湖南省株洲市渌口区第三中学2021-2022学年高一上学期期中考试化学试题新疆维吾尔自治区喀什第二中学2022-2023学年高一下学期3月月考化学试题广东省揭阳市揭东第一中学2021-2022学年高一下学期期中考试化学试题广东省揭阳岐山中学2022-2023学年高一下学期4月期中考试化学试题上海市实验学校2021-2022学年高一上学期第一次测试化学试题第5课时 物质的量在化学反应中的应用湖南省邵东市第三中学2023-2024学年高一上学期期中考试化学试题江苏省昆山市第一中学2023-2024学年高一上学期阶段性测试(10月)化学试题湖南省长沙市雅礼中学2023-2024学年高一上学期第三次月考化学试题黑龙江省哈尔滨市第三十二中学校2023-2024学年高一上学期11月期中化学试题河北省石家庄市正定县弘文中学2023-2024学年高一上学期期中考试化学试题河南省信阳市息县第一高级中学2023-2024学年高一上学期第二次阶段性考试化学试卷
单选题
|
较易(0.85)
名校
5. 同温同压下,1 mol H2和1 mol O2,下列有关它们的说法正确的是
| A.质量相同,体积不同 | B.分子数相同,质量不同 |
| C.体积相同,分子数不同 | D.体积相同,原子数不同 |
【知识点】 阿伏加德罗定律的应用解读 物质的量有关计算
您最近一年使用:0次
2018-11-25更新
|
292次组卷
|
9卷引用:【校级联考】湖南省浏阳市六校联考2018-2019学年高一上学期期中考试化学试题
【校级联考】湖南省浏阳市六校联考2018-2019学年高一上学期期中考试化学试题安徽省蚌埠田家炳中学2019-2020学年高一上学期开学考试化学试题内蒙古包钢第一中学2019-2020学年高一上学期10月月考化学试题(已下线)1.2.2 气体摩尔体积 练习(1)——《高中新教材同步备课》(苏教版 必修第一册)贵州省铜仁市伟才学校2020-2021学年高一上学期第三次半月考化学试题黑龙江省哈尔滨市宾县第二中学2020-2021学年高一上学期第三次月考化学试题甘肃省陇南市徽县第三中学2020-2021学年高一上学期期末考试化学试题四川省眉山市仁寿县龙正中学、清水中学2021-2022学年高一上学期期中联考化学试题第2课时 气体摩尔体积
单选题
|
适中(0.65)
名校
6. 下列关于物质的量浓度表述不正确的是
| A.0.3 mol·L-1的Na2SO4溶液中含有Na+和SO42-的物质的量之比为2:1 |
| B.当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol·L-1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol·L-1 |
| C.在通常情况下,22.4L的氯化氢气体中含有的HCl分子数小于NA |
| D.10 ℃时,0.35 mol·L-1的KCl饱和溶液100 mL蒸发掉5 g水,冷却到10 ℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol·L-1 |
您最近一年使用:0次
2019-09-16更新
|
286次组卷
|
2卷引用:河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题
单选题
|
适中(0.65)
名校
解题方法
7. 下列实验过程中 出现的异常情况,其可能原因分析错误的是
| 选项 | 异常情况 | 可能原因分析 |
| A | 蒸发结晶:蒸发皿破裂 | 将溶液蒸干或酒精灯灯芯碰到热的蒸发皿底部 |
| B | 分液:分液漏斗中的液体难以滴下 | 没有打开分液漏斗活塞或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐 |
| C | 萃取:液体静置不分层 | 加入萃取剂的量较多 |
| D | 蒸馏:冷凝管破裂 | 冷凝管没有通水或先加热后通水 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-12-07更新
|
493次组卷
|
39卷引用:2011-2012学年山西省忻州一中高一上学期期中考试化学试卷
(已下线)2011-2012学年山西省忻州一中高一上学期期中考试化学试卷(已下线)2011-2012学年山西省临汾一中高一上学期期中考试化学试卷2015-2016学年湖南省益阳市箴言中学高一9月月考化学试卷2015-2016学年内蒙古奋斗中学高一上9月质检化学试卷2015-2016学年江西省丰城中学高一上学期期中考试化学试卷2015-2016学年贵州省遵义航天中学高一上期末化学试卷2015-2016学年陕西省西安一中高一上学期期末化学试卷2016-2017学年辽宁省瓦房店市高级中学高一上10月月考化学试卷山西大学附属中学2017-2018学年高一上学期10月月考化学试题江西省九江市2017-2018学年高一上学期第一次阶段联考化学试题河南省信阳高级中学2017-2018学年高一10月月考化学试题山西大学附属中学2017-2018学年高一上学期10月模块诊断化学试题山西省师范大学附属中学2017-2018学年高一上学期10月月考化学试题河南省安阳市第三十六中学2018-2019学年高一上学期第一次月考化学试题【全国百强校】江苏省南京市南京师范大学附属中学2017-2018学年高一上学期期中考试化学试题【全国百强校】云南省玉溪市第一中学2018-2019学年高一上学期期中考试化学试题安徽省安庆市桐城中学2019-2020学年高一上学期第一次月考化学试题吉林省实验中学2019-2020学年高一上学期第一次月考化学试题四川省南充高级中学2019-2020学年高一上学期期中考试化学试题(已下线)2019年3月17日《每日一题》二轮复习 每周一测福建省福建师范大学附属中学2019-2020学年高一上学期期中考试化学试题重庆市云阳县江口中学2019-2020学年高一上学期第二次月考化学试题(已下线)【新东方】2020-59内蒙古包钢第一中学2019-2020学年高一上学期10月月考化学试题重庆市育才中学2019-2020学年高一下学期3月月考化学试题(已下线)【南昌新东方】江西省九江市2017-2018学年高一上学期第一次阶段联考化学试题四川绵阳南山中学2019-2020学年高一12月化学考试题广东省中山纪念中学2019-2020学年高一上学期第二次段考化学试题广东东莞松山湖学校2019-2020学年度高一上学期期中考试化学试题河南省洛阳市第一中学2020-2021学年高一上学期第一次月考化学试题陕西省西安市第二十六中学2019-2020学年高一上学期期中考试化学试题内蒙古自治区通辽市科左后旗甘旗卡第二高级中学2020-2021学年高一上学期期中考试化学试题广西壮族自治区南宁市育才实验中学2020-2021学年高一上学期期中考试化学试题(已下线)【南昌新东方】16.2020年11月江西南昌外国语高一期中化学陕西省西安市第一中学2020-2021学年高一上学期12月月考化学试题 (已下线)第04练 研究物质的实验方法-2022年【寒假分层作业】高一化学(苏教版2019必修第一册)课后-1.2.1 有机化合物的分离、提纯-人教2019选择性必修3专题1 有机化学的发展及研究思路 本专题复习提升河北省邯郸市魏县第五中学2022-2023学年高二下学期4月期中考试化学试题
单选题
|
适中(0.65)
名校
解题方法
8. 实验室里需用480mL0.1mol·L-1的硫酸铜溶液,现选取500mL容量瓶进行配制,以下操作正确的是
| A.称取7.68g硫酸铜,加入500mL水 |
| B.称取12.0g胆矾配成500mL溶液 |
| C.称取12.5g胆矾配成500mL溶液 |
| D..称取8.0g硫酸铜,加入500mL水 |
【知识点】 物质的量浓度计算-溶液配制有关计算解读
您最近一年使用:0次
2020-10-31更新
|
420次组卷
|
57卷引用:2010年山西省太原五中高一上学期期中考试化学试卷
(已下线)2010年山西省太原五中高一上学期期中考试化学试卷(已下线)2011届黑龙江省鸡西市第一中学高三第二次模拟考试化学试卷(已下线)2012届陕西省长安一中高三开学第一次考试化学试卷(已下线)2012届甘肃省张掖二中高三9月月考化学试卷(已下线)2011-2012学年黑龙江省鹤岗一中高二下学期期末考试化学试卷(已下线)2012-2013学年海南省洋浦中学高一上学期期末考试化学试卷(已下线)2012-2013学年广东省汕头四中高一上学期期末考试化学试卷(已下线)2013-2014学年河南省漯河市五校高一上学期期中联考化学试卷(已下线)2014届浙江省苍南县巨人中学高三上学期第三次月考化学试卷(已下线)2014高考名师推荐化学CB计算法(已下线)2014秋江苏省东台市三仓中学高一第一学期期中考试化学试卷2015-2016学年北大附中河南分校高一上9月考化学试卷2016届江西省靖安中学高三上学期第一次月考化学试卷2015-2016学年辽宁师大附中高一上10月月考化学试卷 2015-2016学年江苏省海安实验中学高一上学期期中测试化学试卷2017届广西桂林十八中高三上第一次月考化学试卷2017届河北省邯郸市大名一中高三上学期第一次月考化学试卷2016-2017学年河北省邯郸一中高一上入学考试化学试卷2016-2017学年宁夏育才中学高一上第一次月考化学试卷2016-2017学年湖北省部分重点中学高一上学期期中化学试卷2016-2017学年黑龙江大庆铁人中学高一上期中化学卷2016-2017学年广西桂林中学高二上模拟考试化学卷2015-2016学年上海市同济中学高一下学期期中考试化学试卷陕西省黄陵中学2018届高三(普通班)上学期开学考试化学试题河南省长葛市第一高级中学2017-2018学年高一9月质量检测化学试题山西省怀仁县第一中学2018届高三上学期第二次月考化学试题河南省周口市郸城县第一高级中学2017-2018学年高一10月月考化学试题新疆呼图壁县一中2017-2018学年高一上学期期中考试化学试卷北京市衡中清大教育集团2017-2018学年高一上学期期中考试化学试题内蒙古鄂尔多斯市第一中学2017-2018学年高一上学期第三次月考化学试题广东省汕头市金山中学2017-2018学年高一上学期期末考试化学试题2018--2019高中化学《物质的量浓度》专项训练题江苏省东台市创新学校2019届高三上学期9月月考化学试题吉林省白城市第一中学2018-2019学年高一上学期第一次月考化学试题【校级联考】湖南省醴陵二中、醴陵四中2018-2019学年高一上学期期中联考化学试题【校级联考】湖南省浏阳市六校联考2018-2019学年高一上学期期中考试化学试题【全国百强校】吉林省延边市第二中学2018-2019学年高一下学期开学考试化学试题河南省长葛市第一高级中学2019-2020学年高一上学期第一次(9月)月考化学试题2019年10月18日《每日一题》2019-2020学年高一化学人教必修1——一定物质的量浓度溶液的配制甘肃省天水市天水一中2019-2020学年高一上学期第一次月考化学试题湖南省邵东县第一中学2019-2020学年高一上学期第一次月考化学试题福建省建瓯市芝华中学2019-2020学年高一上学期期中考试化学试题辽宁省大连市第八中学2019-2020学年高一上学期12月月考化学试题湖北省恩施州清江外国语学校2019-2020学年高一上学期期末考试化学试题广东省广州市天河区华南师范大学附属中学2020届高三化学专题训练(5)内蒙古包钢第一中学2019-2020学年高一上学期10月月考化学试题(已下线)【南昌新东方】2019 南师附中 高一上第一次月考安徽省阜阳市颍上二中2019-2020学年高一下学期分班考试化学试卷(已下线)1.3.3物质的量浓度练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)(已下线)【南昌新东方】14. 豫章中学 刘惠文(已下线)【南昌新东方】15. 莲塘二中 曹永康.内蒙古自治区通辽市科左后旗甘旗卡第二高级中学2020-2021学年高一上学期期中考试化学试题湖南省新宁县崀山培英学校2020-2021学年高一上学期期中考试化学试题河南省南阳市邓州市第一高级中学校2021-2022学年高一上学期第一次月考化学试题四川省仁寿第—中学校北校区2021-2022学年高一上学期9月月考化学试题浙江省嘉兴市南湖片区2021-2022学年高一上学期期中检测化学试题湖南省邵阳市邵东县第三中学2021--2022届高三上学期期中考试化学试题
单选题
|
适中(0.65)
名校
10. 科学家刚刚发现了某种元素的原子,其质量是ag,一个12C的原子质量是bg,NA是阿伏加 德罗常数的值,下列说法不正确的是( )
| A.该原子的摩尔质量是aNAg/mol |
B.Wg该原子的物质的量是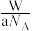 mol mol |
C.该原子的相对原子质量为 |
D.由已知信息可得NA= |
您最近一年使用:0次
2020-03-17更新
|
197次组卷
|
2卷引用:内蒙古包钢第一中学2019-2020学年高一上学期10月月考化学试题
单选题
|
较易(0.85)
名校
解题方法
11. 将质量均为m g的O2、X、Y气体分别充入相同容积的密闭容器中,压强(p)与温度(T)的关系如图所示,则X、Y气体分别可能是
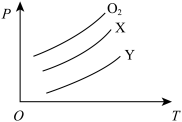

| A.C2H4、CH4 | B.CO2、Cl2 | C.SO2、CO2 | D.CH4、Cl2 |
【知识点】 阿伏加德罗定律及其推论解读 阿伏加德罗定律的应用解读
您最近一年使用:0次
2020-03-17更新
|
326次组卷
|
17卷引用:内蒙古巴彦淖尔市第一中学2017-2018学年高一12月月考化学试题(A卷)
内蒙古巴彦淖尔市第一中学2017-2018学年高一12月月考化学试题(A卷)内蒙古巴彦淖尔市第一中学2017-2018学年高一12月月考化学试题(B卷)【校级联考】安徽省滁州市定远县西片区2018-2019学年高一上学期期中考试化学试题贵州省遵义育新高级中学2018-2019学年高一上学期11月考试化学试题内蒙古自治区呼和浩特市第六中学2018-2019学年高一上学期期末考试化学试题内蒙古鄂尔多斯市第一中学2018-2019学年高二下学期期末考试化学试题云南省景谷一中2018-2019学年高一下学期期末考试化学试题安徽省安庆市桐城中学2019-2020学年高一上学期第一次月考化学试题陕西省延安市第一中学2019-2020学年高一上学期期中考试化学试题河南省鹤壁市高级中学2019-2020学年高一11月月考化学试题河南省濮阳市油田一中2019-2020学年高一11月月考化学试题内蒙古包钢第一中学2019-2020学年高一上学期10月月考化学试题人教版(2019)高一必修第一册第二章 海水中的重要元素 第三节 物质的量 易错疑难集训(二)吉林省辽源市第五中学校2019-2020学年高一上学期第一次月考化学试题福建省漳州市平和县第一中学2020-2021学年高一上学期期中考试化学试题云南省澄江市第一中学2022-2023学年高一上学期期中考试化学试题宁夏吴忠市秦宁中学2021-2022学年高一上学期期中考试化学试题
单选题
|
适中(0.65)
名校
12. 若20g密度为ρg·cm-3的Ca(NO3)2溶液里含1gCa2+,则NO 的物质的量浓度是(mol·L-1)
的物质的量浓度是(mol·L-1)
 的物质的量浓度是(mol·L-1)
的物质的量浓度是(mol·L-1)A.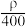 | B. | C.2.5ρ | D.1.25ρ |
您最近一年使用:0次
2019-09-16更新
|
255次组卷
|
4卷引用:2012-2013学年湖北武汉部分重点中学高一上学期期末考试化学试卷
(已下线)2012-2013学年湖北武汉部分重点中学高一上学期期末考试化学试卷河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题云南省昆明市官渡区第一中学2019-2020学年高一10月月考化学试题内蒙古包钢第一中学2019-2020学年高一上学期10月月考化学试题
单选题
|
较易(0.85)
名校
解题方法
13. 为了配制100 mL 1 mol/L NaOH 溶液,其中有下列几种操作,错误的操作是。
①选刚用蒸馏水洗净过的100 mL 容量瓶进行配制
②NaOH 固体在烧杯里刚好完全溶解,立即把溶液转移到容量瓶中
③用蒸馏水洗涤烧杯内壁及玻璃棒2~3次,洗涤液都移入容量瓶中
④使蒸馏水沿着玻璃棒注入容量瓶,直到溶液的凹液面恰好跟刻度相切
⑤由于不慎,液面超过了容量瓶的刻度线,这时采取的措施是使用胶头滴管吸出超过的一部分
①选刚用蒸馏水洗净过的100 mL 容量瓶进行配制
②NaOH 固体在烧杯里刚好完全溶解,立即把溶液转移到容量瓶中
③用蒸馏水洗涤烧杯内壁及玻璃棒2~3次,洗涤液都移入容量瓶中
④使蒸馏水沿着玻璃棒注入容量瓶,直到溶液的凹液面恰好跟刻度相切
⑤由于不慎,液面超过了容量瓶的刻度线,这时采取的措施是使用胶头滴管吸出超过的一部分
| A.①③⑤ | B.①④⑤ | C.②④⑤ | D.③④⑤ |
【知识点】 配制一定物质的量浓度的溶液的步骤、操作解读
您最近一年使用:0次
2020-03-17更新
|
92次组卷
|
5卷引用:陕西省西安中学2018届高三10月月考化学试题
单选题
|
适中(0.65)
名校
解题方法
14. VL Fe2(SO4)3溶液中含有ag SO ,取此溶液0.5VL,用水稀释至2VL,则稀释后溶液中Fe3+的物质的量浓度为( )
,取此溶液0.5VL,用水稀释至2VL,则稀释后溶液中Fe3+的物质的量浓度为( )
 ,取此溶液0.5VL,用水稀释至2VL,则稀释后溶液中Fe3+的物质的量浓度为( )
,取此溶液0.5VL,用水稀释至2VL,则稀释后溶液中Fe3+的物质的量浓度为( )A.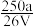 mol·L-1 mol·L-1 | B.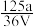 mol·L-1 mol·L-1 | C.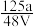 mol·L-1 mol·L-1 | D.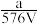 mol·L-1 mol·L-1 |
您最近一年使用:0次
2020-11-13更新
|
820次组卷
|
61卷引用:2010年河南省郑州盛同学校高一上学期第一次月考化学
(已下线)2010年河南省郑州盛同学校高一上学期第一次月考化学(已下线)2011届安徽省蚌埠二中高三第一学期期中考试化学试卷(已下线)2011-2012学年福建省厦门一中高一上学期期中化学试卷(已下线)2011-2012年呼伦贝尔市牙克石林业一中高二下学期期末考试化学试卷(已下线)2014届陕西省西安市第一中学高三上学期期中考试化学试卷(已下线)2014年高考化学苏教版总复习 1-3 溶液的配制及分析练习卷(已下线)2014届山东省实验中学高一上学期期中考试化学试卷 (已下线)2014-2015学年江苏省启东中学高一上学期第一次月考化学试卷2014-2015学年黑龙江省大庆市铁人中学高一期中化学试卷2014-2015云南省腾冲县第六中学高一3月月考化学试卷2016届山东省邹城市第一中学高三上学期10月月考化学试卷2015-2016学年辽宁省大连二十中学高一上学期期中测试化学试卷2015-2016宁夏回族自治银川一中高一上期中考试化学试卷2015-2016学年浙江嘉兴一中高一上10月阶段测化学卷 2015-2016学年广东省普宁一中高一上学期第三次月考化学试卷2016-2017学年吉林省长春市第十一高中高一上学期期初考试化学试卷2018届高三一轮复习化学:考点3-一定物质的量浓度溶液的配制与计算湖北省宜昌市葛洲坝中学2017-2018学年高一9月月考化学试题河北省定州中学2017-2018学年高一(承智班)上学期第一次月考化学试题黑龙江省大庆市第一中学2017-2018学年高一第一次阶段考试化学试题辽宁省抚顺市第十九中学2016-2017学年高一上学期期中考试化学试题内蒙古商都县高级中学2017-2018学年高一上学期期中考试化学试题(已下线)【备战2019年浙江新高考-考点】——考点03 物质的量浓度及溶液的配制【全国百强校】安徽省黄山市屯溪第一中学2018-2019学年高一上学期期中考试化学试题新疆沙雅县第二中学2018-2019学年高一上学期期中考试化学试题湖北省沙市中学2019-2020学年高一上学期期中考试化学试题安徽省滁州市定远县育才学校2019-2020学年高二上学期期中考试(实验班)化学试题山东省济宁市微山县第二中学2019-2020学年高一上学期第三学段质量检测化学试题四川省遂宁市2019-2020学年高一上学期期末教学水平监测化学试题四川广元市剑门关高级中学2019-2020学年高一上学期期末考试化学试题山西省朔州市怀仁第一中学2018-2019学年高一上学期期末考试化学试题山西省河津市第二中学2019-2020学年高一上学期11月月考化学试题内蒙古包钢第一中学2019-2020学年高一上学期10月月考化学试题(已下线)考点01 从实验学化学-2020年【衔接教材·暑假作业】新高三一轮复习化学(已下线)第1单元 化学计量在实验中的应用(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷苏教版(2020)高一必修第一册专题2第二单元突破1 物质的量浓度的有关计算四川省阆中中学2020-2021学年高一上学期开学考试化学试题人教版(2019)高一必修第一册 第二章 专题2 物质的量浓度的有关计算(已下线)1.2.3物质的量在化学实验中的应用(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版)鲁科版(2019)高一必修第一册第1章 认识化学科学 第3节 物质的量 专题1 物质的量浓度的有关计算鲁科版(2019)高一必修第一册第一章第3节 化学中常用的物理量——物质的量 课时3 物质的量浓度(已下线)第一章 从实验学化学(能力提升)-2020-2021学年高一化学单元测试定心卷(人教版必修1)(已下线)期末模拟卷(二)-2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)贵州省思南中学2020-2021学年高一上学期第一次月考化学试题河南省周口市西华县第一高级中学2020-2021学年高一上学期第一次月考化学试题高一必修第一册(苏教2019版)专题2 C 高考挑战区高一必修第一册(苏教2019版)专题2 第二单元 溶液组成的定量研究 课时1 物质的量浓度溶液的配制与分析贵州省毕节市纳雍县第一中学2020-2021学年高一上学期第一次月考化学试题四川省绵阳南山中学实验学校2020-2021学年高二9月月考化学试题(已下线)【南昌新东方】9. 南昌十九中 刘惠文.甘肃省兰州市第一中学2020-2021学年高一上学期期中考试化学(文)试题江西省上饶市横峰中学2020-2021学年高一上学期期中考试化学试题湖南省常德市第一中学2020-2021学年高一上学期期中考试化学试题黑龙江省齐齐哈尔市讷河市拉哈一中2020-2021学年高一上学期12月月考化学试题(已下线)专题02 物质的量在化学实验中的应用(限时精练)-2022届高考化学一轮复习热点题型归纳与变式训练河南省南阳市第一中学校2021-2022学年高一上学期第二次月考化学试题四川省攀枝花市成都外国语学校2021-2022学年高一上学期10月月考化学试题安徽省蚌埠田家炳中学2021-2022学年高一上学期期中考试化学试题河南省商丘市夏邑县第一高级中学2021-2022学年高二下学期6月份月考化学试题黑龙江省虎林市高级中学2022-2023学年高一上学期期中考试化学试题陕西省宝鸡市金台区2023-2024学年高一上学期期中考试化学试题
单选题
|
适中(0.65)
15. 把500 有BaCl2和KCl的混合溶液分成5等份,取一份加入含
有BaCl2和KCl的混合溶液分成5等份,取一份加入含
 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含
硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含
 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
 有BaCl2和KCl的混合溶液分成5等份,取一份加入含
有BaCl2和KCl的混合溶液分成5等份,取一份加入含
 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含
硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含
 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为A.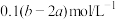 | B. |
C.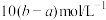 | D.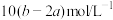 |
【知识点】 物质的量浓度计算-与溶质成分有关的计算解读
您最近一年使用:0次
2019-01-30更新
|
3749次组卷
|
94卷引用:2010年普通高等学校招生全国统一考试理综化学部分(新课标全国I卷)
2010年普通高等学校招生全国统一考试理综化学部分(新课标全国I卷)2010年普通高等学校招生全国统一考试(课标Ⅰ卷)理综化学部分全解全析2010年普通高等学校招生全国统一考试(湖南卷)理综化学部分全解全析2010年高考化学试题分项专题三 物质的量2010年高考化学试题分项专题十四 化学计算(已下线)09~10年宝鸡中学高二下学期期末考试化学卷(已下线)2010年宁夏银川一中高一上学期期中考试化学卷(已下线)2010年湖南师大附中高一上学期期中考试化学试卷(已下线)2010年四川省成都七中高一上学期期中考试化学试卷(已下线)2011届黑龙江省鸡西市第一中学高三第二次模拟考试化学试卷(已下线)2010—2011学年上海交通大学附属中学高二第二学期期末化学试卷(已下线)2011-2012学年云南省昆明一中高一上学期期中考试化学试卷(已下线)2011-2012学年黑龙江省哈三中高一上学期期中考试化学试卷(已下线)2011-2012学年吉林省长春外国语学校高二上学期期中考试化学(理)试卷(已下线)2013-2014学年山东济宁曲阜师大附中高一上学期期中考试化学试卷(已下线)2013-2014学年河南省洛阳市高一上学期期中考试化学试卷(A卷)(已下线)2015届山东省济宁市微山县第一中学高三10月阶段测试化学试卷2014-2015辽宁省实验中学分校高一上学期期中化学试卷2014-2015湖南省益阳六中高一上学期期中考试化学试卷2014-2015学年湖南省益阳市第六中学高一上学期期中考试化学卷2014-2015学年湖北省襄阳市老河口高级中学高二下学期期末化学试卷2016届湖北省仙桃中学高三8月月考(开学摸底)化学试卷2015-2016学年江西省新余一中高一上第一次段考化学试卷2015-2016学年湖南省衡阳一中高一上学期期中测试化学试卷2016届湖北省枣阳二中高三上学期期中考试化学试卷2015-2016学年四川省三台中学高一上第三次月考化学试卷2015-2016学年河南省三门峡市陕州一中高二下第三次月考化学试卷2016-2017学年黑龙江大庆一中高一上开学考试化学卷2016-2017学年河南省漯河中学高一上第一次月考化学卷2016-2017学年湖南省双峰县第一中学高一上第一次月考化学试卷2016-2017学年山西省太原五中高一上10月月考化学试卷2016-2017学年安徽省师大附中高一上期中化学试卷贵州省铜仁市一中2016-2017学年高一上期中化学试卷2016-2017学年黑龙江省鹤岗一中高一上期中化学试卷河北省故城县高级中学2018届高三9月月考化学试题湖南省长沙市实验中学2017-2018学年高一上学期第一次月考化学试题黑龙江省大庆市第一中学2017-2018学年高一第一次阶段考试化学试题山西省怀仁县第一中学2018届高三上学期第二次月考化学试题河南省鹤壁市淇滨高级中学2017-2018学年高一上学期第二次月考化学试题江西省宜春九中2017-2018学年高一上学期第一次月考化学试卷山西省祁县中学2017-2018学年高一12月月考化学试题(已下线)二轮复习 专题16 化学计算方法与技巧 押题专练【全国百强校】江西省南昌市第十中学2017-2018学年高二5月月考化学试题吉林省白城市第一中学2018-2019学年高一上学期第一次月考化学试题山西省长治二中2018-2019学年高一上学期第一次月考化学试题【市级联考】河北省遵化市2018-2019学年高一上学期期中考试化学试题【校级联考】安徽省滁州市定远县西片区2018-2019学年高一上学期期中考试化学试题贵州省黔西县一中2018-2019学年高一第一学期12月考试化学试题贵州省织金县第一中学2018-2019学年高一上学期期中考试化学试题河南省鹤壁市淇县第一中学2018-2019学年高一上学期第三次月考化学试题百所名校联考-从实验学化学云南省文山州广南县第二中学2019-2020学年高二上学期9月份考试化学试题湖北省黄冈市麻城实验高中2019-2020学年高一10月月考试化学试题宁夏石嘴山市第三中学2019-2020学年高一10月月考化学试题黑龙江省大庆市第一中学2019-2020学年高一上学期第一次月考化学试题湖北省荆州开发区滩桥高级中学2019-2020学年高一上学期期中考试化学试题江苏省南通市海安市南莫中学2019-2020学年高一上学期期中考试化学试题湖南省邵东县创新实验学校2019-2020学年高一上学期期中考试化学试题安徽省萧城一中2020届高三第一次月考化学试题四川省达州市宣汉中学2019—2020学年高一上学期月考化学试题(已下线)【新东方】2019新中心五地018高中化学湖北省荆州市沙市区沙市中学2019-2020学年高一化学过关训练10(物质的分类和离子反应)内蒙古包钢第一中学2019-2020学年高一上学期10月月考化学试题(已下线)【新东方】2002-36河南省焦作市沁阳市第一中学2019-2020学年高一上学期12月月考化学试题甘肃省兰州市第五十九中学2019-2020学年高一上学期期中考试化学试题湖南省邵东县第一中学2019-2020学年高二下学期期末考试化学试题(已下线)小题必刷11 物质的量浓度与溶液的配制——2021年高考化学一轮复习小题必刷(通用版)人教版(2019)高一必修第一册 第二章 海水中的重要元素 第三节 物质的量吉林省大安市第一中学校2021届高三上学期第二次月考化学试题(已下线)【浙江新东方】11高一必修第一册(苏教2019)专题2 第二单元 溶液组成的定量研究2湖北省利川市第五中学2019年-2020学年高一上学期期中考试化学试题黑龙江嫩江市高级中学2021届高三上学期第二次月考化学试题新疆北屯高级中学2020-2021学年高一上学期10月月考化学试题黑龙江省鹤岗市第一中学2020-2021学年高二下学期期末考试化学试题(已下线)课时12 物质的量浓度与溶液的配制-2022年高考化学一轮复习小题多维练(全国通用)吉林省长春外国语学校2019-2020学年高二下学期期末考试化学(理)试题吉林省白城市第一中学2021-2022学年高一上学期期中考试化学试题吉林省长春市希望高中2021-2022学年高一上学期期中考试化学试题吉林省长春市第二十九中学2021-2022学年高一上学期第二学程考试化学(理)试题四川省成都市石室中学2020-2021学年高一上学期10月阶段性测试化学试题(已下线)专题讲座(一) 化学计算的常用方法(练)-2023年高考化学一轮复习讲练测(全国通用)黑龙江省哈尔滨师范大学附属中学2022-2023学年高三9月月考化学试题辽宁省锦州市锦州中学2023届高三上学期9月月考化学试题山东省烟台市第二中学2022-2023学年高一上学期10月月考化学试题河南省信阳市2022-2023学年普通高中高三上学期第一次教学质量检测化学试题福建省晋江市第一中学2021-2022学年高一上学期期中考试化学试题四川省宜宾市第四中学校2022-2023学年高一上学期期中考试化学试题四川省达州天立学校2022-2023学年高一上学期11月月考化学试题(已下线)题型8 利用守恒关系的计算-高考必备50个题型作业(十六) 物质的量浓度的有关计算浙江省杭州市缙云中学等4校2022-2023学年高一上学期12月月考化学试题河南省郑州市第四高级中学2023-2024学年高一上学期第一次月考化学试题
单选题
|
较难(0.4)
16. 三种气体 X、Y、Z 的相对分子质量关系为 Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是
| A.原子数相等的三种气体,质量最大是 Z |
| B.若一定条件下,三种气体体积均为2.24L,则它们的物质的量一定均为0.1 mol |
| C.同温同压下,同质量的三种气体,气体密度最小的是X |
| D.同温下,体积相同的两容器分别充agY气体和2agZ气体,则压强之比为1:2 |
您最近一年使用:0次
2022-12-25更新
|
1610次组卷
|
52卷引用:2016届湖北省武汉市高三下学期2月调研理综化学试卷
2016届湖北省武汉市高三下学期2月调研理综化学试卷2016-2017学年江西省南昌二中高一上月考一化学试卷2017届辽宁省沈阳东北育才学校高三上期中模拟化学卷2016届辽宁省葫芦岛市第一高级中学高三上学期第二次周考理综化学试卷河北省“名校联盟”(五校联考)2018届高三上学期教学质量监测(一)化学试题湖北省武汉市部分重点中学2017-2018学年高一上学期期中考试化学试题山东省沂水县第一中学2018届高三下学期第2次模拟化学试题【全国百强校】河北省邢台市第一中学2017-2018学年高二下学期第三次月考化学试题(已下线)【备战2019年浙江新高考-考点】——考点02 物质的量【市级联考】山东省泰安市2019届高三上学期期中考试化学试题【校级联考】安徽省滁州市定远县西片区2018-2019学年高一上学期期中考试化学试题云南省新平县一中2018-2019学年高一上学期12月月考化学试题云南省元江县一中2018-2019学年高一下学期2月份考试化学试题(已下线)2019年7月2日 《每日一题》2020年高考一轮复习-阿伏加德罗定律及其推论的应用河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题四川省广安市邻水县邻水实验学校2019-2020学年高一上学期第一次月考化学试题河北省邯郸市2019-2020学年高一上学期期中考试化学试题内蒙古第一机械制造(集团)有限公司第一中学2019-2020学年高一10月月考化学试题广西南宁市第三中学2019-2020学年高一上学期期中考试化学试题安徽省合肥十中2019-2020学年高一上学期期中考试化学试题云南省云县第一中学2019-2020学年高二12月月考化学试题1内蒙古包钢第一中学2019-2020学年高一上学期10月月考化学试题广东省江门市第一中学2019-2020学年高一上学期10月月考化学试题山西省忻州市第一中学2019-2020学年高一上学期第二次月考化学试题安徽省合肥市肥东县第二中学2020-2021学年高一上学期期末考试化学试题内蒙古呼和浩特市第十六中学2020-2021学年高一上学期第一次质量检测化学试题专题1 第2课时气体摩尔体积-高中化学苏教2019版必修第一册(已下线)解密02 物质的量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密02 物质的量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)课时11 物质的量、气体摩尔体积-2022年高考化学一轮复习小题多维练(全国通用)福建省厦门一中2019-2020学年高一上学期第一次月考(10月)化学试题(已下线)考点02 化学用语和常用化学计量-备战2022年高考化学学霸纠错(全国通用)(已下线)解密02 物质的量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)提升卷02-【新高考新题型】2022年高考化学选择题标准化练习20卷(山东专用)(已下线)解密02 物质的量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)化学-2022年高考押题预测卷02(山东卷)(已下线)必刷卷04-2022年高考化学考前信息必刷卷(山东专用)(已下线)考点02 物质的量 气体摩尔体积-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第04讲 物质的量 气体摩尔体积 (练)-2023年高考化学一轮复习讲练测(新教材新高考)黑龙江省龙西北八校联合体2022-2023学年高三上学期开学考试化学试题河南省南阳市第一中学校2023届高三上学期第二次阶段考试化学试题重庆市万州纯阳中学2022-2023学年高三上学期8月月考化学试题(已下线)专题五 化学常用计量与化学计算-实战高考·二轮复习核心突破山东莒县第一中学2022-2023学年高一上学期12月月考化学试题山东省烟台第一中学2022-2023学年高一上学期月考化学试题山东省烟台第一中学2022-2023学年高一上学期期末调研化学试题安徽省安庆市桐城中学2022-2023学年高一上学期第二次教学质量检测化学试题第二章 物质的量化学实验基本技能 第6讲 物质的量山东省枣庄市第八中学南校2022-2023学年高一1月线上测试化学试题河北省石家庄二中教育集团2022-2023学年度高一年级上学期期末考试化学试题广西浦北中学2023-2024学年高一上学期10月月考化学试题福建省泉州市安溪一中、养正中学、惠安一中、实验中学2023-2024学年高一上学期期中考化学试题
单选题
|
较难(0.4)
17. 标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A.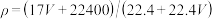 |
B.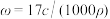 |
C.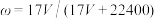 |
D. =1000Vρ/(17V+22400) =1000Vρ/(17V+22400) |
您最近一年使用:0次
2016-12-09更新
|
4917次组卷
|
130卷引用:2010年普通高等学校招生全国统一考试理综化学部分(四川卷)
2010年普通高等学校招生全国统一考试理综化学部分(四川卷)2010年高考化学试题分项专题三 物质的量2010年高考化学试题分项专题十四 化学计算(已下线)2010年重庆一中高一下学期期末考试化学试题(已下线)2010年四川省成都七中高一上学期期中考试化学试卷(已下线)2010—2011学年黑龙江省哈六中高一上学期期末考试化学试卷(已下线)2010—2011学年辽宁省营口市高一上学期期末考试化学试卷(已下线)2011-2012学年浙江省嘉兴一中高一10月份月考化学试卷(已下线)2011-2012年辽宁省开原高中高一上学期第一次考试化学试卷(已下线)2011-2012学年浙江省嘉兴一中高二上学期期中考试化学试卷(已下线)2011-2012学年湖北省黄冈中学高一上学期期中考试化学试卷(已下线)2011-2012学年海南省琼海市嘉积中学高一上学期教学质量检测化学试卷(已下线)2011-2012学年甘肃省兰州市兰炼一中高一上学期期中考试化学试卷(已下线)2011-2012学年四川省成都市树德协进中学高一上学期期中考试化学试卷(已下线)2012-2013学年河北省石家庄市第二实验中学高一上学期期中考化学卷(已下线)2015届广西桂林市第十八中学高三上学期第一次月考化学试卷(已下线)2014-2015学年浙江嘉兴第一中学高一10月月考化学试卷2016届山东省枣庄市第二中学高三9月阶段性学情检测化学试题2016届广西桂林市第十八中学高三第一次月考化学试卷2015-2016学年山西大学附属中学高一上学期第一次月考化学试卷2015-2016学年广东省普宁一中高一上学期第三次月考化学试卷2015-2016学年四川省双流中学高一下入学考试化学试卷2015-2016学年广西桂林十八中高二下开学测化学试卷2015-2016学年河北省保定市高一上学期期末化学试卷2016-2017学年河北省邯郸一中高一上入学考试化学试卷2016-2017学年黑龙江牡丹江高级中学高一9月月考化学卷2017届湖北省大冶一中高三上学期8月月考化学试卷2017届福建省南安一中高三暑假阶段性考试化学试卷2016-2017学年宁夏育才中学高一上第一次月考化学试卷2016-2017学年河南省南阳一中高一上第一次月考化学卷2016-2017学年河北省定州二中高一上10月月考化学试卷2017届陕西省师范大学附属中学高三上学期第二次模考化学试卷山西省怀仁县第一中学(两校区)2016-2017学年高二下学期期末考试化学试题2018版化学(苏教版)高考总复习专题一对接高考精练--物质的量浓度及其溶液的配制山西省忻州市第一中学2016-2017学年高一必修一:第1章从实验学化学同步练习化学试题河南省南阳市第一中学2018届高三上学期第二次考试化学试题江西省新余市第一中学2018届高三毕业年级第二次模拟考试化学试题江西省崇义中学2017-2018学年高一上学期第一次月考化学试题湖南省长沙市实验中学2017-2018学年高一上学期第一次月考化学试题湖南省长沙市第一中学2017-2018学年高一上学期第一次阶段性检测化学试题黑龙江省哈尔滨市第三中学2017-2018学年高一上学期第一次验收考试化学试题新疆阿克苏市农一师中学2017-2018学年高一上学期第一次月考化学试题河南省周口市郸城县第一高级中学2017-2018学年高一10月月考化学试题河南省商丘市第一高级中学2017-2018学年高一上学期第一次月考化学试题天津市静海县第一中学2018届高三9月学生学业能力调研考试化学试题河南省中原名校(即豫南九校)2017-2018学年高一上学期期中联考化学试题安徽省定远重点中学2017-2018学年高一上学期期末考试化学试题陕西省西安市第一中学2017-2018学年高一上学期期末考试化学试题湖北省黄冈中学2017-2018学年高一上学期第一次月考化学试题【全国百强校】江西省新余市第一中学2017-2018学年高二下学期第三次段考化学试题【全国百强校】内蒙古集宁一中(东校区)2017-2018学年高二下学期期末考试化学试题黑龙江省青冈县一中2017-2018学年高二下学期期末考试化学试题(已下线)解密02 化学常用计量——备战2018年高考化学之高频考点解密安徽省肥东县高级中学2019届高三上学期8月调研考试化学试题(已下线)学科网2019年高考化学一轮复习讲练测1.2 物质的量浓度 测2018--2019高中化学《物质的量浓度》专项训练题【全国百强校】新疆维吾尔自治区乌鲁木齐市第一中学2019届高三上学期第一次月考(9月)化学试题湖南省岳阳县第一中学、汨罗市一中2018-2019学年高一上学期10月联考化学试题河南省豫西名校2018-2019学年高一上学期第一次联考化学试题湖南省长沙市周南梅溪湖中学2018-2019学年高一下学期一模检测化学试题河南省永城高中2018-2019学年高一上学期第一次月考化学试题【全国百强校】山西省太原市第五中学2018-2019学年高一上学期10月月考化学试题【全国百强校】山西省山西大学附属中学2018-2019学年高一上学期10月模块诊断化学试题【全国百强校】辽宁省实验中学2018-2019学年高一上学期期中考试化学试题【全国百强校】甘肃省平凉市静宁县第一中学2019届高三上学期第三次模拟考试化学试题安徽省阜阳市第三中学2018-2019学年高一上学期小期末考试(期末模拟)化学试题【全国百强校】内蒙古自治区乌兰察布市集宁区第一中学2018-2019学年高一上学期期末考试化学试题河北省大名县第一中学2018-2019学年高二(普通班)5月月考化学试题【全国百强校】吉林省延边第二中学2018-2019学年高二下学期第二次月考化学试题贵州省铜仁第一中学2018-2019学年高二下学期期末考试化学试题(已下线)专题1.2 物质的量浓度(讲)-《2020年高考一轮复习讲练测》吉林省乾安县七中2017-2018学年高一上学期期中考试化学试卷河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题黑龙江省鹤岗市第一中学2019-2020学年高一第一次月考化学试题河南省林州市第一中学2019-2020学年高一10月月考化学试题安徽省六安市舒城中学2019-2020学年高一上学期第一次月考化学试题2020届高三化学一轮复习 基本概念物质的量(过关检测)山西运城市康杰中学2019-2020学年高一上学期期中考试化学试题四川省遂宁市第二中学2019-2020学年高一上学期期中考试化学试题宁夏回族自治区石嘴山市第三中学2019-2020学年高一上学期期中考试化学试题内蒙古翁牛特旗乌丹第一中学2019-2020学年高一上学期期中考试化学试题山西省朔州市怀仁县第一中学2018-2019学年高一上学期第三次月考化学试题2020届高三化学化学二轮复习——高考常考题:质量分数、物质的量浓度的相关计算【精编25题】广西壮族自治区来宾市金秀县民族中学2019-2020学年高一上学期期末考试化学试题内蒙古包钢第一中学2019-2020学年高一上学期10月月考化学试题广西壮族自治区来宾市忻城县民族中学2019-2020学年高一上学期期末考试化学试题黑龙江省哈尔滨市第一中学2019-2020 学年高二下学期期末考试化学试题(已下线)2.2.2化学反应的计算 练习(2)——《高中新教材同步备课》(苏教版 必修第一册)(已下线)第1单元 化学计量在实验中的应用(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷鲁科版(2019)高一必修第一册第1章 认识化学科学 总结检测高一必修第一册(鲁科2019)第1章第3节 化学中常用的物理量——物质的量广东省深圳市外国语学校2021届高三第一次月考化学试题陕西省渭南高级中学2019-2020学年高一上学期第一次月考化学试题山西大学附属中学2020-2021学年高上学期10月月考化学试题四川省成都外国语学校2020-2021学年高一上学期10月月考化学试题甘肃省天水市第一中学2020-2021学年高一上学期第一学段考试化学试题(已下线)【新东方】【2019】【高一上】【期中考】【JEZ】【化学】【栾子豪制作】(已下线)【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二6月阶段性测试化学试题山西省太原市山西大学附属中学2020-2021学年高一上学期10月(总第一次)模块诊断化学试题四川省遂宁市射洪中学校2020-2021学年高一上学期第一次月考化学试题甘肃省临夏中学2020-2021学年高一上学期期中考试化学试题江西省上饶市横峰中学2020-2021学年高一上学期期中考试化学试题内蒙古自治区赤峰市第二实验中学2020-2021学年高一上学期10月月考化学试题四川省广元市川师大万达中学2020-2021学年高一上学期期中考试化学试题甘肃省天水市第三中学2020-2021学年高一上学期期中考试化学试题(已下线)【浙江新东方】绍兴qw72江西省南昌市八一中学、洪都中学等七校2020-2021学年高一上学期期末联考化学试题(已下线)专题03 溶液——备战2021年高考化学纠错笔记黑龙江省鹤岗市第一中学2020-2021学年高二下学期期中考试化学试题(已下线)专题02 物质的量在化学实验中的应用(热点讲义)-2022届高考化学一轮复习热点题型归纳与变式训练(已下线)课时12 物质的量浓度与溶液的配制-2022年高考化学一轮复习小题多维练(全国通用)四川省遂宁市射洪中学2021-2022学年高一上学期第一次月考化学试题山东省济南市商河县第三中学2022届高三10月月考化学试题广东省湛江市第二十一中学2022届高三9月第二次月考化学试题上海实验高中2021-2022学年高一上学期第一次测试化学试题辽宁省实验中学分校2017-2018学年高一上学期期中考试化学试题北京市第二十中学2021-2022学年高一上学期期中考试化学试题辽宁省沈阳市东北育才学校2020届高三上学期第一次模拟考试化学试题上海市黄浦区大同中学2021-2022学年高一上学期期中考试化学试题上海外国语大学附属外国语学校松江云间中学2021-2022学年高一上学期10月测试化学试题黑龙江省大庆中学2021-2022学年高一上学期期末考试化学试题北京市汇文中学2021-2022学年高一上学期期末考试化学试卷(已下线)第02讲 物质的量浓度与溶液的配制(练)-2023年高考化学一轮复习讲练测(全国通用)黑龙江省哈尔滨师范大学附属中学2021-2022学年高一下学期期末考试化学试题(已下线)2.2.2 物质的量浓度相关计算(好题帮)-备战2023年高考化学一轮复习考点帮(新教材新高考)黑龙江省齐齐哈尔市八校联合体2022-2023学年高三上学期期中考试化学试题黑龙江省实验中学2022-2023学年高一上学期期中测试化学试题上海市浦东新区上海中学东校2022-2023学年高一上学期第一次阶段性素质评估化学试题上海市实验学校2021-2022学年高一上学期第一次测试化学试题甘肃省兰州第一中学2023-2024学年高一上学期12月月考化学试题
单选题
|
适中(0.65)
名校
解题方法
18. 一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入8molN2,右边充入CO和CO2的混合气体共64g时,隔板处于如图位置(保持温度不变),下列说法正确的是


| A.右边CO和CO2分子数之比为1:3 |
| B.右边CO的质量为14g |
| C.右边气体密度是相同条件下氧气密度的2倍 |
| D.若改变右边CO和CO2的充入量而使隔板处于距离右端1/3 处,若保持温度不变,则前后两次容器内的压强之比为5:6 |
【知识点】 阿伏加德罗定律及其推论解读 根据n=m/M进行相关计算解读
您最近一年使用:0次
2020-03-17更新
|
119次组卷
|
3卷引用:内蒙古包钢第一中学2019-2020学年高一上学期10月月考化学试题
二、填空题 添加题型下试题
填空题
|
适中(0.65)
名校
19. I.自然界中的物质绝大多数以混合物的形式存在,为了便于研究和利用,常需对混合物进行分离和提纯。下列A、B、C、D是中学常见的混合物分离或提纯的装置。
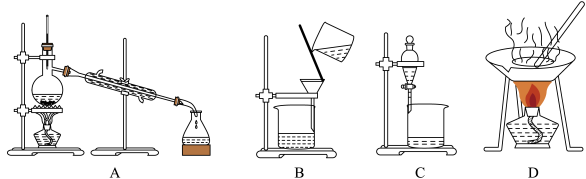
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D 填入适当的空格中。
(1)碳酸钙悬浊液中分离出碳酸钙__________ ;
(2)氯化钠溶液中分离出氯化钠___________ ;
(3)分离39%的乙醇溶液___________ ;
(4)分离溴的氯化钠溶液____________ ;
Ⅱ.利用“化学计量在实验中的应用”的相关知识进行填空
已知某饱和氯化钠溶液体积为VmL,溶液密度为d g/cm3,质量分数为w,物质的量浓度为c mol/L,溶液中含NaCl的质量为m g。
(1)用m、V表示溶液的物质的量浓度是_________
(2)用w、d表示溶液的物质的量浓度是_________
(3)用c、d表示溶液的质量分数是__________

请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D 填入适当的空格中。
(1)碳酸钙悬浊液中分离出碳酸钙
(2)氯化钠溶液中分离出氯化钠
(3)分离39%的乙醇溶液
(4)分离溴的氯化钠溶液
Ⅱ.利用“化学计量在实验中的应用”的相关知识进行填空
已知某饱和氯化钠溶液体积为VmL,溶液密度为d g/cm3,质量分数为w,物质的量浓度为c mol/L,溶液中含NaCl的质量为m g。
(1)用m、V表示溶液的物质的量浓度是
(2)用w、d表示溶液的物质的量浓度是
(3)用c、d表示溶液的质量分数是
您最近一年使用:0次
三、解答题 添加题型下试题
解答题-实验探究题
|
较易(0.85)
名校
解题方法
20. 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)称取粗盐


 滤液
滤液
 精盐
精盐
(1)第①步中,操作A是________ ,第⑤步中,操作B用到的玻璃仪器是________ 。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)_________ 。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是_________ 。
(4)判断BaCl2已过量的方法是___________ 。
(5)下列是某学生设计操作A后混合液中Cl-、SO42-的检验步骤请根据内容填空:
①首先检验_________ 离子,应先加入过量的_____________ 。
②将所得混合物_________ (填操作名称),然后在滤液中加入试剂_________ 检验另一离子。



 滤液
滤液
 精盐
精盐(1)第①步中,操作A是
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是
(4)判断BaCl2已过量的方法是
(5)下列是某学生设计操作A后混合液中Cl-、SO42-的检验步骤请根据内容填空:
①首先检验
②将所得混合物
您最近一年使用:0次
四、计算题 添加题型下试题
计算题
|
适中(0.65)
名校
解题方法
21. 有关物质的量的计算是中学化学的重要部分,请回答下列有关物质的量的计算问题。
(1)等质量的O2和O3所含分子个数比为________ ,所含原子个数比为_______ 。
(2)设NA为阿伏加 德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是__________ (用含NA的式子表示)。
(3)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为__________ 。
(4)标准状况下,将V L A气体(摩尔质量为M g/mol)完全溶于0.1 L水(密度1 g/cm3)中,所得溶液的密度为d g/mL,则此溶液的物质的量浓度为_______ mol/L。
(5)100mL0.3mol/LNa2SO4溶液和50mL0.2mol/LAl2(SO4)3溶液混合后(溶液体积保持不变),溶液中SO42-的物质的量浓度为____________ 。
(1)等质量的O2和O3所含分子个数比为
(2)设NA为阿伏加 德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是
(3)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为
(4)标准状况下,将V L A气体(摩尔质量为M g/mol)完全溶于0.1 L水(密度1 g/cm3)中,所得溶液的密度为d g/mL,则此溶液的物质的量浓度为
(5)100mL0.3mol/LNa2SO4溶液和50mL0.2mol/LAl2(SO4)3溶液混合后(溶液体积保持不变),溶液中SO42-的物质的量浓度为
您最近一年使用:0次
五、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
名校
解题方法
22. 实验室用固体烧碱配制0.5mol/L的NaOH溶液490mL,用质量分数为98%,密度为1.84 g/cm3的浓硫酸配制0.6mol/L的硫酸溶液500mL。请回答下列问题:
(1)计算需要NaOH固体质量_________ g。
(2)有以下仪器:①烧杯 ②药匙 ③250mL容量瓶 ④500mL容量瓶 ⑤玻璃棒⑥托盘天平 ⑦量筒。配制以上两种溶液必须使用的玻璃仪器_________ (填序号),还缺少的仪器是_________ 。
(3)定容的具体操作方法是:________
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为______ mL,如果实验室有15mL、20mL、50mL量筒,应选用__________ mL量筒最好。
(5)配制过程中,下列操作会引起结果偏高的是__________ (填序号)
①未洗涤烧杯、玻璃棒
②称量NaOH的时间太长
③定容时俯视刻度
④容量瓶不干燥,含有少量蒸馏水
⑤NaOH溶液未冷却至室温就转移到容量瓶
⑥量取浓硫酸时,仰视量筒刻度线
(1)计算需要NaOH固体质量
(2)有以下仪器:①烧杯 ②药匙 ③250mL容量瓶 ④500mL容量瓶 ⑤玻璃棒⑥托盘天平 ⑦量筒。配制以上两种溶液必须使用的玻璃仪器
(3)定容的具体操作方法是:
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为
(5)配制过程中,下列操作会引起结果偏高的是
①未洗涤烧杯、玻璃棒
②称量NaOH的时间太长
③定容时俯视刻度
④容量瓶不干燥,含有少量蒸馏水
⑤NaOH溶液未冷却至室温就转移到容量瓶
⑥量取浓硫酸时,仰视量筒刻度线
您最近一年使用:0次
2020-03-17更新
|
103次组卷
|
2卷引用:内蒙古包钢第一中学2019-2020学年高一上学期10月月考化学试题
试卷分析
整体难度:适中
考查范围:化学实验基础、认识化学科学
试卷题型(共 22题)
题型
数量
单选题
18
填空题
1
解答题
2
计算题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 仪器使用与实验安全 实验安全 | |
| 2 | 0.65 | 物质的量的含义 摩尔 摩尔质量的概念 摩尔质量与相对原子质量区别与联系 | |
| 3 | 0.94 | 仪器使用与实验安全 化学实验基础操作 蒸馏与分馏 过滤 | |
| 4 | 0.85 | 阿伏加德罗常数的应用 22.4L/mol适用条件 气体物质与NA相关的推算 | |
| 5 | 0.85 | 阿伏加德罗定律的应用 物质的量有关计算 | |
| 6 | 0.65 | 溶解度、饱和溶液的概念 22.4L/mol适用条件 依据物质的量浓度公式的基础计算 物质的量浓度计算-与溶质成分有关的计算 | |
| 7 | 0.65 | 仪器使用与实验安全 化学实验基础操作 蒸馏与分馏 萃取和分液 | |
| 8 | 0.65 | 物质的量浓度计算-溶液配制有关计算 | |
| 9 | 0.65 | 离子共存 离子反应的实际应用 离子反应在混合物分离、除杂中的应用 离子反应在化合物组成的分析、鉴定的应用 | |
| 10 | 0.65 | 阿伏加德罗常数的含义 摩尔质量的概念 根据n=m/M进行相关计算 | |
| 11 | 0.85 | 阿伏加德罗定律及其推论 阿伏加德罗定律的应用 | |
| 12 | 0.65 | 根据n=m/M进行相关计算 依据物质的量浓度公式的基础计算 物质的量浓度计算-与溶质成分有关的计算 电离方程式 | |
| 13 | 0.85 | 配制一定物质的量浓度的溶液的步骤、操作 | |
| 14 | 0.65 | 根据n=m/M进行相关计算 依据物质的量浓度公式的基础计算 物质的量浓度计算-溶液稀释的有关计算 | |
| 15 | 0.65 | 物质的量浓度计算-与溶质成分有关的计算 | |
| 16 | 0.4 | 22.4L/mol适用条件 阿伏加德罗定律及其推论 物质的量有关计算 根据n=N/NA的相关计算 | |
| 17 | 0.4 | 物质的量浓度的基础计算 物质的量浓度与溶质成分有关的计算 | |
| 18 | 0.65 | 阿伏加德罗定律及其推论 根据n=m/M进行相关计算 | |
| 二、填空题 | |||
| 19 | 0.65 | 物质的量有关计算 物质的量浓度的计算 物质分离、提纯的常见物理方法 蒸馏与分馏 | |
| 三、解答题 | |||
| 20 | 0.85 | 离子反应在混合物分离、除杂中的应用 物质分离、提纯的常见化学方法 过滤 离子的检验 | 实验探究题 |
| 22 | 0.65 | 依据物质的量浓度公式的基础计算 配制一定物质的量浓度的溶液的步骤、操作 配制一定物质的量浓度的溶液实验的误差分析 配制一定物质的量浓度的溶液实验的仪器 | 实验探究题 |
| 四、计算题 | |||
| 21 | 0.65 | 阿伏加德罗定律及其推论 物质的量有关计算 以N=m·NA/M为中心的有关基本粒子的推算 物质的量浓度计算-溶液混合的有关计算 | |




 、OH-三种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来。下列实验操作的操作顺序中,正确的是
、OH-三种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来。下列实验操作的操作顺序中,正确的是

