河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题
河北
高一
阶段练习
2019-09-18
560次
整体难度:
适中
考查范围:
认识化学科学、化学实验基础、化学反应原理、常见无机物及其应用、有机化学基础、化学与STSE
河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题
河北
高一
阶段练习
2019-09-18
560次
整体难度:
适中
考查范围:
认识化学科学、化学实验基础、化学反应原理、常见无机物及其应用、有机化学基础、化学与STSE
一、未知 添加题型下试题
二、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
2. 若20g密度为ρg·cm-3的Ca(NO3)2溶液里含1gCa2+,则NO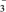 的物质的量浓度是(mol·L-1)
的物质的量浓度是(mol·L-1)
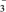 的物质的量浓度是(mol·L-1)
的物质的量浓度是(mol·L-1)A.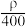 | B. | C.2.5ρ | D.1.25ρ |
您最近一年使用:0次
2019-09-16更新
|
255次组卷
|
4卷引用:2012-2013学年湖北武汉部分重点中学高一上学期期末考试化学试卷
(已下线)2012-2013学年湖北武汉部分重点中学高一上学期期末考试化学试卷河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题云南省昆明市官渡区第一中学2019-2020学年高一10月月考化学试题内蒙古包钢第一中学2019-2020学年高一上学期10月月考化学试题
单选题
|
容易(0.94)
名校
解题方法
3. 铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见的物质,四种物质间的反应关系如图所示,图中两圆相交部分①、②、③、④表示物质间的反应,其中对应的四种反应类型正确的是
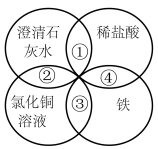

| A.复分解反应、复分解反应、化合反应、置换反应 |
| B.复分解反应、置换反应、复分解反应、置换反应 |
| C.复分解反应、复分解反应、置换反应、置换反应 |
| D.分解反应、复分解反应、置换反应、置换反应 |
您最近一年使用:0次
2020-09-22更新
|
1735次组卷
|
24卷引用:河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题
河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题辽宁省六校协作体2019-2020学年高一10月月考联考化学试题福建省平潭县新世纪学校2019-2020学年高一上学期第一次月考化学试题2019年10月21日《每日一题》2019-2020学年高一化学人教必修1——简单分类方法及应用云南省文山马关实验高级中学2019-2020学年高一期末考试化学试题黑龙江省黑河市嫩江市高级中学2019-2020学年高一下学期第一次月考化学试题(已下线)专题01 物质的分类及转化(核心素养卷)——【新教材精创】2019-2020学年高中化学新教材知识讲学苏教版(2020)高一必修第一册专题1第一单元 物质及其反应分类人教版(2019)高一必修第一册第一章 物质及其变化 第一节 物质的分类及转化课时2 物质的转化人教版(2019)高一必修第一册 第一章 第一节 课时2 物质的转化(已下线)1.1.1 物质的分类(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)(已下线)1.1.2 物质的转化(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)(已下线)第二章 化学物质及其变化(能力提升)-2020-2021学年高一化学单元测试定心卷(人教版必修1)(已下线)1.1.1 物质的分类-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)(已下线)第1章 章末检测-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)高一必修第一册(鲁科2019)第2章第1节 元素与物质分类(已下线)2.1.1 简单分类法及其应用(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版)浙江省金华市云富高级中学2020-2021学年高一上学期第一次月考化学试题河北省唐山市路北区第十一中学2020-2021学年高一上学期第一次月考化学试题高一必修第一册(苏教2019版)专题1 第一单元 物质及其反应的分类高一必修第一册(苏教2019)专题1 第一单元 物质及其反应的分类(已下线)【浙江新东方】【2020】【高一上】【期中】【hd-lp414】【化学】黑龙江省哈尔滨市第三十二中学2020-2021学年高一上学期期末考试化学试题湖北省南漳县第二中学2021-2022学年高一上学期期中考试化学试题
单选题
|
较易(0.85)
名校
4. 物质的量浓度相同的NaCl、MgCl2、AlCl3三种物质的溶液,当溶液的体积比为3∶2∶1 时,它们与同一浓度的AgNO3溶液恰好反应,则消耗的AgNO3溶液的体积比是
| A.3∶4∶3 | B.1∶1∶1 | C.1∶2∶3 | D.3∶2∶1 |
【知识点】 物质的量浓度计算-与溶质成分有关的计算解读
您最近一年使用:0次
2018-01-04更新
|
317次组卷
|
6卷引用:北京101中学2017-2018学年高一上学期期中考试化学试题
单选题
|
适中(0.65)
名校
5. 下列事实与胶体性质无关的是 ( )
| A.水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染 |
| B.将植物油倒入水中用力搅拌形成油水混合物 |
| C.一束平行光线射入蛋白质溶液里,从侧面可以看到一条光亮的通路 |
| D.氢氧化铁胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解 |
您最近一年使用:0次
2019-01-30更新
|
973次组卷
|
5卷引用:山东省济南市2010届高三第一次模拟考试化学试卷
(已下线)山东省济南市2010届高三第一次模拟考试化学试卷(已下线)2011-2012年呼伦贝尔市牙克石林业一中高二下学期期末考试化学试卷河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题广东省江门市第一中学2019-2020学年高一上学期10月月考化学试题上海市控江中学2022-2023学年高一上学期期中考试化学试题
单选题
|
适中(0.65)
名校
6. 某实验小组只领取下列仪器和用品:铁架台、铁夹、铁圈、三角架、石棉网、烧杯、漏斗、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、火柴、滤纸。不能进行的实验操作是
| A.蒸发 | B.萃取 | C.过滤 | D.蒸馏 |
您最近一年使用:0次
2019-09-16更新
|
287次组卷
|
20卷引用:2010年云南省个旧一中高一上学期期中检测化学卷
(已下线)2010年云南省个旧一中高一上学期期中检测化学卷(已下线)2010年陕西省宝鸡中学高一上学期期中考试化学试卷(已下线)2011-2012学年云南省玉溪一中高一上学期期中考试化学试题试卷(已下线)2011-2012学年河南省卫辉市第一中学高一上学期期中考试化学试卷(已下线)2011-12学年福建莆田十八中高一上学期期未测试(A)化学试卷(已下线)2011-2012学年陕西省西安市第一中学高一上学期期中考试化学试卷(已下线)2012-2013学年福建省永定县湖雷中学高一入学教育考试化学试卷(已下线)2014-2015学年甘肃省高台县一中高一上学期期中化学试卷2014-2015学年云南省曲靖市陆良县二中高一下学期期中化学试卷2016-2017学年广西桂林十八中高一上开学考试化学卷吉林省桦甸市第八高级中学2018-2019学年高一第一次月考化学试题河南省新乡市第七中学2018-2019学年高一上期第一次月考化学试题湖北省利川市第五中学2018-2019学年高一上学期期中模拟考试化学试题河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题浙江省杭州市西湖高级中学2019-2020学年高一10月月考化学试题黑龙江省伊春市伊美区第二中学2019-2020学年高一上学期第一次月考化学试题湖北省黄冈市黄梅国际育才高级中学2019-2020学年高一上学期期中考试化学试题(已下线)【南昌新东方】4.进贤一中 田荣达江西省南昌市进贤县第一中学2020-2021学年高一上学期第一次月考化学试题云南省昭通市镇雄县泼机中学2021-2022学年高一上学期第一次月考化学试题
单选题
|
适中(0.65)
名校
解题方法
7. 经测定,一瓶气体中只含有C、O两种元素,通常情况下这瓶气体不可能是
| A.一种化合物 | B.一种单质和一种化合物的混合物 |
| C.两种化合物 | D.两种单质 |
【知识点】 无机物质的分类
您最近一年使用:0次
2021-03-08更新
|
570次组卷
|
32卷引用:2010年浙江余姚中学高一上学期期中考试化学试卷
(已下线)2010年浙江余姚中学高一上学期期中考试化学试卷(已下线)2010年浙江余姚中学高一上学期期中考试化学试卷(实验班)(已下线)2011-2012学年河南省郑州市智林学校高一10月月考化学试卷(已下线)2011-2012学年海南省琼海市嘉积中学高一上学期教学质量检测化学试卷(已下线)2011-2012学年山东省卧龙学校高一上学期期中模块检测化学试卷(已下线)2013-2014学年江西省景德镇市高一上学期期中考试化学试卷(已下线)2015届广东省湛江市第二中学高一第一学期期中考试化学试卷山东省菏泽市第一中学老校区2018-2019学年高一上学期10月月考化学试题【全国百强校】北京市第四中学2018-2019学年高一上学期期中考试化学试题步步为赢 初高中衔接教材化学暑假作业:第5课时 用分类的方法研究物质河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题2.1.1 元素与物质的关系 物质分类与物质性质练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)福建省三明市第一中学2019-2020学年高一上学期第一次月考化学试题(已下线)【新东方】高中化学5021山东省泰安肥城市2018-2019学年高一上学期期中考试化学试题高一必修第一册(鲁科2019)第1章第1节 元素与物质分类 方法帮(已下线)【浙江新东方】15高一必修第一册(苏教2019)专题1 第一单元 物质及其反应的分类天津市滨海新区汉沽第六中学2020-2021学年高一上学期第一次月考化学试题河北省石家庄市康福外国语学校2021届高三上学期期中考试化学试题河北省邯郸市六校联考2020-2021学年高一上学期10月月考化学试题(已下线)易错专题01 物质分类中的误区-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)山东省枣庄滕州市2021-2022学年高一上学期期中考试化学试题福建省福州第二中学2021-2022学年高一上学期期中考试化学试题江苏省响水中学2022-2023学年高一新生暑期 8月检测化学试题黑龙江省龙西北八校联合体2022-2023学年高一上学期第一次月考化学试题河北省石家庄藁城新冀明中学2021-2022学年高一上学期第一次月考化学试题(已下线)第一章 物质及其变化(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)辽宁省沈阳市第五中学2022-2023高一上学期10月月考化学试题广东省河源市源城区城东学校2022-2023学年高一上学期10月月考化学试题江西省抚州市2022-2023学年高一上学期学业质量监测化学试题河北省廊坊市第八中学2023-2024学年高一上学期10月月考化学试题
单选题
|
适中(0.65)
名校
8. 下列说法正确的是
| A.摩尔既是物质的量的单位,又是粒子的数量单位 |
| B.2 mol O2的摩尔质量是64 g/mol |
| C.当摩尔质量以g·mol-1为单位时,在数值上与阿伏加 德罗常数个该物质的微粒的质量总和相等(质量以g为单位) |
| D.1 mol SO2中含有2 mol氧元素 |
您最近一年使用:0次
2019-09-16更新
|
521次组卷
|
3卷引用:河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题
单选题
|
适中(0.65)
名校
9. 用NA表示阿伏加德罗常数的值。下列判断错误的是( )
| A.NA个H+的质量为1 g |
| B.2 L 0.5 mol/L Na2SO4溶液中含NA个Na+ |
| C.32 g O2中含有2NA个氧原子 |
| D.标准状况下,1 mol H2O中含有NA个分子 |
您最近一年使用:0次
2016-10-26更新
|
315次组卷
|
10卷引用:2014-2015湖南省郴州市湘南中学高一上学期期中考试化学试卷
2014-2015湖南省郴州市湘南中学高一上学期期中考试化学试卷2015-2016学年广东省惠阳高级中学高一上学期期中测试化学试卷2015-2016学年山东省济南一中高一上10月月考化学卷2016-2017学年武汉钢铁集团公司第三子弟中学高一上月考化学试卷山东省济南外国语学校2017-2018学年高一10月月考化学试题湖北省孝感市八校2017-2018学年高一上学期期末考试化学试题【全国县级联考】江西省上饶县高中2017-2018学年高一下学期期末考试化学试题【全国百强校】河北省衡水市武邑中学2018-2019学年高一上学期第一次月考化学试题河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题江西省南昌市新建区第一中学2019—2020学年高一上学期第一次月考化学试题
单选题
|
适中(0.65)
名校
10. 由K2SO4、Al2(SO4)3、KAl(SO4)2形成的混合溶液,其中Al3+的物质的量浓度为0.4 mol·L-1,SO42-的物质的量浓度为0.7 mol·L-1,则此溶液中K+的物质的量浓度(mol·L-1)为
| A.0.1 | B.0.15 | C.0.2 | D.0.25 |
您最近一年使用:0次
2019-09-16更新
|
544次组卷
|
2卷引用:河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题
单选题
|
较易(0.85)
名校
解题方法
11. 朱自清先生在《荷塘月色》中写道。“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”月光穿过薄雾所形成的种种美景的本质原因是
| A.光是一种胶体 |
| B.雾是一种胶体 |
| C.薄雾中的小水滴颗粒大小约为10-9 m~10-7 m |
| D.发生丁达尔效应 |
您最近一年使用:0次
2021-09-17更新
|
2863次组卷
|
118卷引用:2011-2012学年浙江省台州中学高一上学期期中考试化学试卷
(已下线)2011-2012学年浙江省台州中学高一上学期期中考试化学试卷(已下线)2014秋浙江省杭州地区六校高一上学期期中考试化学试卷2014-2015内蒙古赤峰市宁城县高一上学期期末考试化学试卷2015-2016学年安徽省蚌埠二中高一上期中测试化学试卷2015-2016学年江西省九江第一中学高一上学期期中测试化学试卷2015-2016学年湖北航天高中、安陆二中等五校高一上期中化学试卷2016-2017学年四川省成都市龙泉中学等五校高一上期中化学试卷吉林省榆树一中2017-2018学年高一上学期期中考试化学试题广东省韶关市2017-2018学年高一化学上学期期中试题浙江省温州中学2017-2018学年高一上学期期中考试化学试题安徽省合肥市第六中学2017-2018学年高一上学期期中考试化学试题福建省华安县第一中学2017-2018学年高一年上学期第二次月考(12月)化学试题黑龙江省七台河中学2017-2018学年高一上学期期末化学试题吉林省延边州敦化县2017-2018学年高一上学期期末考试化学试题云南省峨山彝族自治县第一中学2017-2018学年高二上学期期末考试化学试题陕西省延安市实验中学大学区校际联盟2017-2018学年高一上学期期末考试(B)化学试题山东师范大学附属中学2017-2018学年高一上学期第二次学分认定(期末)考试化学试题人教版高中化学必修一 第二章化学物质及其变化 单元测试题【全国百强校】辽宁省葫芦岛市第一高级中学2018-2019学年高一上学期第一次月考理科综合化学试题吉林省舒兰市第一高级中学校2018-2019学年高一上学期期中考试化学试题吉林省舒兰市一中2018-2019学年高一上学期期中考试化学试题【全国百强校】吉林省实验中学2019届高三上学期期中考试化学试题吉林省长春市第一五O中学2018-2019学年高一上学期期中考试化学试题【全国百强校】云南省云天化中学2018-2019学年高一上学期期中考试化学试题【全国百强校】河北省辛集中学2018-2019学年高一上学期期中考试化学试题河南省安阳市第二中学2018-2019学年高一上学期期中考试化学试题安徽省阜阳市第三中学2018-2019学年高一下学期开学考试化学试题山西省灵丘县一中2017-2018学年高一上学期期中考试化学试卷河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题黑龙江省哈尔滨市第六中学2020届高三上学期第二次调研考试(10月)化学试题山东省济宁市鱼台县第一中学2019-2020学年高一10月月考化学试题江苏省苏州市震泽中学2019-2020学年高一上学期第一次月考(非杨班)化学试题河南省许昌高级中学2019-2020学年高一10月月考化学试题天津市塘沽一中2019-2020学年高一上学期期中考试化学试题山东省济南外国语学校三箭分校2019-2020学年高一上学期期中考试化学试题山东省济南外国语学校2019-2020学年高一上学期期中考试化学试题河北省张家口市宣化一中张北一中2019-2020学年高一上学期期中考试化学试题四川省宜宾市第三中学校2019-2020学年高一上学期10月月考化学试题陕西省安康市2019-2020学年高一上学期期中考试化学试题宁夏回族自治区银川市宁夏大学附中2020届高三上学期第三次月考理综化学试题湖北省荆门市2019-2020学年高一上学期期末学业水平选择性考试阶段性检测化学试题福建省南安市侨光中学2019-2020学年高一上学期第二次阶段考试化学试题(已下线)【新东方】2020-32广西崇左市2019-2020学年高一上学期期末考试化学试题云南省云天化中学2019-2020学年高一下学期开学考试化学试题山东省泰安肥城市2018-2019学年高一上学期期中考试化学试题江西省萍乡七中2019-2020学年高一上学期期中考试化学试题广东省江门市第一中学2019-2020学年高一上学期10月月考化学试题河北省保定市易县中学2019-2020学年高一下学期期中考试化学试题甘肃省兰州市第五十八中学2019-2020学年高一上学期期中考试化学试题(已下线)【南昌新东方】江西省九江一中2015-2016学年高一上学期期中化学试题广东省江门市第二中学2019-2020学年高一上学期第二次考试(期中)化学试题人教版(2019)高一必修第一册第一章 物质及其变化 第一节 物质的分类及转化课时1 物质的分类(已下线)1.1.2 胶体的性质-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)河北省唐山市路北区第十一中学2020-2021学年高一上学期第一次月考化学试题高一必修第一册(苏教2019版)专题1 第三单元 物质的分散系河北省沧州市第三中学2020-2021学年高一上学期期中考试化学试题江西省新钢中学2020-2021学年度高一上学期第一次段考化学试题山东省章丘市第一中学2020-2021学年高一10月月考化学试题天津市第二十一中学2020-2021学年高一上学期期中检测化学试题江西省赣州市南康中学2020-2021学年高一上学期第二次月考化学试题(已下线)【浙江新东方】11辽宁省大连市普兰店区第三十八中学2020-2021学年高一上学期第三次月考化学试题安徽省安庆市第一中学2020-2021学年高一上学期期中考试化学试题宁夏回族自治区固原市原州区固原市第一中学2020-2021学年高一上学期期中考试化学试题吉林省油田高级中学2020-2021学年高一上学期期初考试化学试题辽宁省大连市一〇三中学2021届高三上学期第二阶段模拟考试化学试题江苏省徐州市2020-2021学年高一上学期期中考试化学试题专题1 第三单元物质的分散系-高中化学苏教2019版必修第一册河南省许昌市第三中学2020-2021学年高一上学期期末考试化学试题黑龙江省讷河市拉哈一中2020-2021学年高一下学期3月月考化学试题云南省文山州砚山县第三高级中学2020-2021学年高一上学期期中考试化学试题河北省石家庄市第十七中学2020-2021学年高一上学期期中考试化学试题天津市和平区2021届高三一模考试化学试题(已下线)【浙江新东方】【2021.4.27】【宁波】【高一上】【高中化学】【00138】(已下线)【浙江新东方】【2021.4.27】【宁波】【高一上】【高中化学】【00149】云南省丽江市玉龙纳西族自治县田家炳民族中学2020-2021学年高一下学期第一次月考化学(文)试题云南省孟连傣族拉祜族佤族自治县第一中学2020-2021学年高一上学期期中考试化学(文)试题云南省孟连傣族拉祜族佤族自治县第一中学2020-2021学年高一上学期期中考试化学(理)试题云南省玉溪市江川区第二中学2020-2021学年高一下学期期中考试化学试题黑龙江省安达市重点高中2020-2021学年高二下学期7月月考化学试题黑龙江省安达市重点高中2020-2021学年高二下学期期末考试化学试题 (已下线)第03讲 物质的分类及变化(练) — 2022年高考化学一轮复习讲练测(新教材新高考)黑龙江省牡丹江市第十五中学2020-2021学年高二下学期期末考试化学试题河南省镇平县第一高级中学2020-2021学年高一上学期第二次月考化学试题江苏省南京市第二十九中学2020-2021学年高一上学期10月月考化学试卷江西省金溪县第一中学2021-2022学年高一上学期第一次月考化学试题北京市朝阳区中国人民大学附属中学朝阳学校2019-2020学年高一上学期10月月考化学试卷广东省揭阳普宁市华侨中学2021-2022学年高一上学期第一次月考化学试题(已下线)2.1.2 胶体-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)江苏省泰州市泰州中学2021-2022学年高一上学期第一次月度检测化学试题山东省聊城市阳谷县第三中学2021-2022学年高一上学期10月月考化学试题黑龙江省哈尔滨市第六中学2021-2022学年高一上学期10月月考化学试题重庆市长寿中学校2021-2022学年高一10月月考化学试题福建省福州第一中学2021-2022学年高一上学期期中考试化学试题辽宁省沈阳市第二十中学2021-2022学年高一上学期10月月考试化学试题河南省濮阳市油田第一中学2021年高一上学期第一次月考化学试题河南省商丘市第一高级中学2021-2022学年高一上学期期中考试化学试题湖南省长沙市湖南师范大学附属中学2021-2022学年高一上学期期末考试化学试题湖南省长沙市南雅中学2022-2023学年高一上学期第一次月考化学试题山东省菏泽市牡丹区曹州实验中学2022-2023学年高一上学期10月份阶段性测试化学试题浙江省余姚中学2022-2023学年高一上学期10月月考化学试题 山东省枣庄市第五中学2022-2023学年高一11月线上测试化学试题四川省广安代市中学校2020-2021学年高一下学期入学考试化学试题新疆巴音郭楞蒙古自治州第一中学2022-2023学年高一上学期期中化学试卷宁夏银川市景博中学2021-2022学年高一上学期期中考试化学试题江苏省盐城市东台创新高级中学2021-2022学年高一11月份月检测化学试题黑龙江省鹤岗市绥滨县第一中学2021-2022年度高一上学期期中考试化学试题上海市曹杨第二中学2022-2023学年高一上学期总结性评价化学试题上海市民立中学2022-2023学年高一上学期期末考试化学试题四川省宜宾市叙州区第一中学校2022-2023学年高一下学期开学考试化学试题山东省济宁邹城市第二中学2023-2024学年高一上学期10月月考化学试题江苏省南京市第九中学2023-2024学年高一上学期10月阶段学情调研化学试题陕西省宝鸡市金台区2023-2024学年高一上学期期中考试化学试题河北省石家庄市第二十四中学2023-2024学年高一上学期期中考试化学试题北京市第一六一中学2023-2024学年高一上学期期中考试化学试题海南省海口观澜湖华侨学校2023-2024学年高一上学期11月期中考试化学试题陕西省延安市黄陵县职业教育中心2023-2024学年高一上学期1月期末化学试题
单选题
|
适中(0.65)
名校
12. 如图是10mL量筒的一部分,数字xy之间相差2 mL,若x=5,则量筒所盛液体的体积是


| A.4.4 mL | B.3.8 mL | C.3.6 mL | D.4.7 mL |
您最近一年使用:0次
2019-09-16更新
|
173次组卷
|
3卷引用:河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题
单选题
|
适中(0.65)
名校
13. 对于易燃、易爆、有毒的化学物质,往往会在其包装上面贴上危险警告标签。下面所列物质,贴错了包装标签的是
| 选项 | A | B | C | D |
| 物质 | 苛性钠 | 酒精 | 苏打 | 硝酸铵 |
| 标签 |  |  |  |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较易(0.85)
名校
解题方法
14. 为了除去粗盐中的Ca2+、Mg2+、SO 及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤②加过量NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液。下列操作顺序中最合适的是
及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤②加过量NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液。下列操作顺序中最合适的是
 及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤②加过量NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液。下列操作顺序中最合适的是
及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤②加过量NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液。下列操作顺序中最合适的是| A.①④②⑤③ | B.④①②⑤③ | C.②⑤④①③ | D.⑤②④③① |
您最近一年使用:0次
2021-07-01更新
|
241次组卷
|
37卷引用:2012年人教版高中化学必修一1.1 化学实验基本方法练习卷
(已下线)2012年人教版高中化学必修一1.1 化学实验基本方法练习卷(已下线)2015届甘肃省天水市第一中学高一上学期期中考试化学试卷2015-2016学年吉林省吉林五十五中高一上学期期中测试化学试卷2016-2017学年青海省湟中县第一中学高一上月考一化学试卷贵州省贵阳清镇北大培文学校2017-2018学年高一9月月考化学试题江苏省泰州市第二中学2018-2019学年高一上学期期中考试化学试题河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题青海省海东市第二中学2019-2020学年高一上学期第一次月考化学试题吉林省长春市第七中学2019-2020学年高一上学期第一次月考化学试题山西运城市康杰中学2019-2020学年高一上学期期中考试化学试题湖北省宜昌市葛洲坝中学2019-2020学年高一上学期期中考试化学试题黑龙江省大庆市东风中学2019-2020学年高一上学期期中考试化学试题云南省曲靖市罗平县第一中学2019-2020学年高一上学期期中考试化学试题广东省郁南县连滩中学2019-2020学年高一上学期期中考试化学试题吉林省通化市梅河口市博文学校2019-2020学年高一上学期第一次月考化学试题吉林省长春市兴华中学2019-2020学年高一上学期期中考试化学试题甘肃省张掖市肃南县第一中学2019--2020学年高一上学期期中考试化学试题四川省宜宾市南溪区第二中学2019-2020学年高二上学期期末考试化学试题四川省乐山市第四中学2019-2020学年高一下学期期中考试化学试题新疆实验中学2019-2020学年高一上学期期中考试化学试题鲁科版(2019)高一必修第一册第二章第2节 电解质的电离 离子反应 课时2 离子反应河南省三门峡市第一高级中学2020-2021学年高一上学期9月月考化学试题四川省新津中学2020-2021学年高一10月月考化学试题甘肃省临夏中学2020-2021学年高一上学期第一次月考化学试题河南省确山县第二高级中学2020-2021学年高一上学期第一次月考化学试题四川省遂宁市安居区2020-2021学年高一上学期期中考试化学试题内蒙古自治区奈曼旗第一中学2020-2021学年高一上学期期中考试化学试题四川省冕宁中学2020-2021学年高一上学期期中考试化学试题江苏省镇江市镇江中学2019-2020学年高一上学期期中考试化学试题山西省运城市高中联合体2020-2021学年高一下学期3月调研测试化学试题广东省普宁市华美实验学校2020-2021学年高一下学期期中考试化学试题广东省普宁市2020-2021学年高一下学期期中考试化学试题黑龙江省漠河市高级中学2021-2022学年高一上学期第一次月考化学试题(已下线)高中化学-高二上-14云南省曲靖市富源县第一中学2020-2021学年高一下学期期中考试化学试题广东省梅州市梅雁中学2022-2023学年高一下学期3月月考化学试题广东省惠州市龙门县高级中学2021-2022学年高一下学期期中考试化学试题
单选题
|
适中(0.65)
名校
15. 下列实验操作:①过滤 ②溶解 ③蒸馏 ④取用药品 ⑤萃取 ⑥配制一定浓度的溶液,一定要用到玻璃棒的是
| A.①②⑥ | B.②③⑥ | C.③④⑥ | D.④⑤⑥ |
您最近一年使用:0次
2016-12-09更新
|
330次组卷
|
11卷引用:2012-2013学年陕西省宝鸡中学高二下学期期末考试化学试卷
(已下线)2012-2013学年陕西省宝鸡中学高二下学期期末考试化学试卷2015-2016学年山西省临汾二中高一上学期期末化学试卷甘肃省武威市第一中学2017-2018学年高一上学期期末考试化学试题吉林省长春外国语学校2017-2018学年高一上学期期末考试化学(文)试题【全国百强校】河北省衡水市武邑中学2018-2019学年高一上学期第一次月考化学试题【校级联考】甘肃省宁县2018-2019学年高一上学期期末联考化学试题河南省淮阳县陈州高级中学2018-2019学年高一上学期期末考试化学试题河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题广东省北京师范大学东莞石竹附属学校2019-2020学年高一10月月考化学试题宁夏吴忠中学校2019-2020学年高一下学期第一次月考化学试题云南省楚雄天人中学2019-2020学年高一上学期9月月考化学试题
单选题
|
适中(0.65)
名校
解题方法
16. 离子方程式Ba2++SO42-=BaSO4↓它可能表示( )
①可溶性钡盐溶液与可溶性硫酸盐溶液之间的反应
②氢氧化钡溶液与可溶性硫酸盐溶液之间的反应
③稀硫酸与可溶性钡盐溶液之间的反应
④氢氧化钡溶液与稀硫酸反应
①可溶性钡盐溶液与可溶性硫酸盐溶液之间的反应
②氢氧化钡溶液与可溶性硫酸盐溶液之间的反应
③稀硫酸与可溶性钡盐溶液之间的反应
④氢氧化钡溶液与稀硫酸反应
| A.①② | B.①②④ | C.②③ | D.①②③ |
【知识点】 离子反应的发生条件解读 离子方程式的正误判断解读
您最近一年使用:0次
2019-12-07更新
|
248次组卷
|
15卷引用:河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题
河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题辽宁省六校协作体2019-2020学年高一10月月考联考化学试题安徽省滁州市定远县育才学校2019-2020学年高一上学期期中考试(普通班)化学试题安徽安庆宿松县第二中学2019-2020学年高一11月月考化学试题甘肃省兰州师范大学附属中学2019-2020学年高一上学期期中考试化学试题吉林省汪清县第六中学2020-2021学年高一上学期期中考试化学试题云南省普洱市景东彝族自治县第一中学2020-2021学年高一上学期1月考化学试题河北省石家庄市第二中学西校区2020-2021学年高一上学期10月月考化学试题甘肃省民勤县第四中学2021-2022学年高一上学期第一次月考化学试题湖北省巴东一中2020-2021学年高一上学期第三次月考化学试题黑龙江省齐齐市拜泉县第一中学2021-2022学年高一上学期期中考试化学试题陕西省咸阳市武功县普集高级中学2022-2023学年高一上学期第一次月考化学试题浙江省台州市书生中学2022-2023学年高一上学期第一次月考化学试题黑龙江省齐齐哈尔市恒昌中学校2022-2023学年高一上学期11月期中检测化学试题甘肃省兰州市第五十五中学2023-2024学年高一上学期11月月考化学试题
单选题
|
适中(0.65)
名校
17. 如果Mg2+、M、Fe3+和Cl-四种离子以物质的量之比1∶3∶2∶2共存于同一溶液,那么M可能是
| A.CO32- | B.NO3- | C.OH- | D.SO42- |
您最近一年使用:0次
2019-09-16更新
|
255次组卷
|
2卷引用:河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题
单选题
|
适中(0.65)
名校
18. 下列叙述中正确的是
| A.在熔融状态下或溶解于水时能导电的物质叫做电解质 |
| B.强电解质的溶液导电性一定很强 |
| C.Na2O的水溶液导电是因为它与水反应生成了氢氧化钠而导电,因此Na2O是非电解质 |
| D.NaHCO3是弱酸的酸式盐,但它是强电解质 |
您最近一年使用:0次
2019-09-16更新
|
557次组卷
|
5卷引用:河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题
单选题
|
适中(0.65)
名校
解题方法
19. 在反应X+2Y=R+2M中,已知R和M的摩尔质量之比为22:9,当l.6gX与Y完全反应后,生成4.4gR,则在此反应中Y和M的质量之比为
| A.23:9 | B.16:9 | C.32:9 | D.46:9 |
您最近一年使用:0次
2019-12-13更新
|
478次组卷
|
35卷引用:2011-2012学年福建省晋江市季延中学高一上学期期中考试化学试卷
(已下线)2011-2012学年福建省晋江市季延中学高一上学期期中考试化学试卷(已下线)2011-2012学年内蒙古巴市一中高一上学期10月月考化学试卷(已下线)2014-2015学年福建三明市一中高一上第一次月考化学试卷2016届江西省金溪县第一中学高三上学期第一次月考化学试卷2015-2016学年广东省宝安第一外国语学校高一上期中考试化学试卷黑龙江省哈尔滨市师大附中2016-2017学年高一10月月考化学卷2016-2017学年湖北省随州一中高一上10月月考化学试卷吉林省长春市外国语学校2017-2018学年高一上学期第一次月考(理)化学试题四川省邻水实验学校2017-2018学年高一上学期第一次月考化学试题福建省三明市第一中学2017-2018学年高一上学期第一次月考化学试题云南省腾冲市第八中学2017-2018学年高一上学期期中考试化学试题安徽省合肥三十二中2017-2018学年高一上第一次月考化学试题安徽省师范大学附属中学高一创新班上学期9月单元测试化学试题【全国百强校】安徽省合肥市第六中学2018-2019学年高一上学期第一次段考化学试题安徽省合肥市第六中学2018-2019学年高二上学期第一次段考化学试题广东省深圳市高级中学2018-2019学年高一上学期期中考试化学试题山西省吕梁育星中学2018-2019学年高二下学期期末考试化学试题河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题贵州省思南中学2019-2020学年高一9月摸底考试化学试题上海复兴高级中学2017-2018学年高一上第一次月(10月)考化学试题江西省南昌市第十中学2019-2020学年高一上学期期中考试化学试题广东省中山市第一中学2019-2020学年高一上学期第二次段考化学试题深圳市第二高级中学2019-2020学年高一上学期第一学段考试化学试题湖北省荆州市沙市区沙市中学2019-2020学年高一化学过关训练9《化学计量在实验中的应用》江西省九江市同文中学2019-2020学年度高一下学期期初考试化学试题黑龙江省哈尔滨师范大学青冈实验中学校2019-2020学年高一10月月考化学试题高一必修第一册(苏教2019版)专题1 C 高考挑战区广西蒙山县蒙山中学2020-2021学年高一上学期第一次月考化学试题(已下线)2.3.1 物质的量的单位---摩尔(精练)--2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)(已下线)【南昌新东方】13. 2020 高一上 莲塘二中 期中 程秀丽甘肃省武威第一中学2020-2021学年高一上学期期中考试化学试题甘肃省靖远县第四中学2022届高三上学期第一次检测化学试题河北省沧州市第一中学2021-2022学年高一上学期第一次月考化学试题天津市耀华中学2022-2023学年高一上学期期中考试化学试题上海市格致中学2023-2024学年高一上学期10月月考化学试题
单选题
|
适中(0.65)
名校
解题方法
20. 完成下列实验所需选择的装置或仪器都正确的是( )
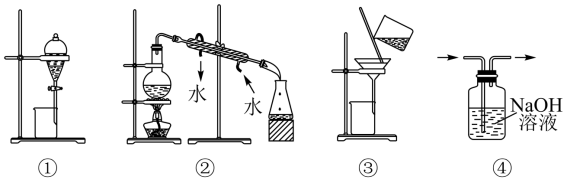

| A.分离植物油和氯化钠溶液选用① |
| B.除去氯化钠晶体中混有的氯化铵晶体选用② |
| C.分离四氯化碳中的溴单质选用③ |
| D.除去二氧化碳气体中的氯化氢气体选用④ |
您最近一年使用:0次
2019-12-31更新
|
333次组卷
|
49卷引用:2013-2014学年山东济宁曲阜师大附中高一上学期期中考试化学试卷
(已下线)2013-2014学年山东济宁曲阜师大附中高一上学期期中考试化学试卷2016-2017学年江苏省清江中学高一上期中化学试卷2016-2017学年内蒙古杭锦后旗奋斗中学高一期中化学试卷宁夏育才中学2017-2018学年高一9月月考化学试题河北省成安县第一中学2016-2017学年高一10月月考化学试题河北省成安一中2017-2018学年高一10月月考化学试题河北省石家庄市第一中学2017-2018学年高一上学期期中考试化学试题福建省南安第一中学2017-2018学年高一上学期期中考试化学试题高中化学人教版 必修1 第一章 从实验学化学 1.化学实验基本方法 混合物的分离和提纯(一)【全国百强校】贵州省铜仁市思南中学2018-2019学年高一上学期第一次月考化学试题【全国百强校】山西省怀仁县第一中学2018-2019学年高一上学期第一次月考化学试题2【全国百强校】山西省怀仁县第一中学2018-2019学年高一上学期第一次月考化学试题1【全国百强校】福建省莆田市第一中学2018-2019学年高一上学期第一次月考化学试题甘肃省张掖市第二中学2018-2019学年高一上学期10月月考化学试题(已下线)2018年10月16日 《每日一题》人教必修1-混合物的分离与提纯【全国百强校】重庆市江津中学2018-2019学年高一上学期第一次阶段考试(10月)化学试题河南省永城高中2018-2019学年高一上学期第一次月考化学试题【市级联考】山东省潍坊市2018-2019学年高一上学期模块监测(期中)化学试题广东省深圳市高级中学2018-2019学年高一上学期期中考试化学试题云南省梁河县第一中学2018-2019学年高一上学期期中考试化学试题广东省韶关市新丰县第一中学2018-2019学年高一上学期期中考试化学试题江西省九江市同文中学2018-2019学年高一上学期期中考试化学试题山东省济宁市微山县第一中学2018-2019学年高一上学期10月月考化学试题江西省奉新县第一中学2018-2019学年高一上学期第三次月考化学试题黑龙江省齐齐哈尔八中2018-2019学年高一上学期期末考试化学试题(已下线)2019年8月31日 《每日一题》 必修1 周末培优河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题甘肃省张掖市山丹县第一中学2019-2020学年高一9月月考化学试题甘肃省甘谷第一中学2019-2020学年高一上学期第一次月考化学试题2019年10月15日《每日一题》2019-2020学年高一化学人教必修1——混合物的分离与提纯安徽省合肥市金汤白泥乐槐六校2019-2020学年高一上学期第一次联考化学试题福建省泉州市永春华侨中学2019-2020学年高一上学期第一次月考化学试题宁夏银川一中2019-2020学年高一上学期期中考试化学试题广东省深圳外国语学校2019-2020学年度高一上学期期中考试化学试题黑龙江省海林市朝鲜族中学2019-2020学年高一上学期期中考试化学试题江苏省宿迁市北大附属宿迁实验学校2019-2020学年高一上学期期中考试化学试题(已下线)2019年12月17日《每日一题》人教版(必修1)—— 混合物的分离与提纯宁夏回族自治区顶级名校2019-2020学年高一上学期12月考试化学试题湖南省株洲市攸县三中2019-2020学年高一上学期第一次月考化学试题江苏省上冈高级中学2018-2019学年高一上学期期中考试化学试题安徽省太和第一中学2021届高三上学期第一次校本教材反馈测试化学试题江苏省宿迁市沭阳县修远中学2020-2021学年高一上学期10月月考化学试题宁夏长庆高级中学2020-2021学年高一上学期第一次月考化学试题甘肃省兰州市第一中学2020-2021学年高一上学期期中考试化学(文)试题宁夏长庆高级中学2020-2021学年高一上学期期中考试化学试题1江苏省镇江正兴学校2020-2021学年高一上学期期中考试化学试题江苏省镇江市实验高级中学2020-2021 学年高一上学期期中考试化学试题(已下线)练习1 从实验学化学-2020-2021学年【补习教材·寒假作业】高一化学(人教版)江苏省徐州市树恩高级中学2021-2022学年高一上学期期中测试化学试题
单选题
|
较难(0.4)
21. 三种气体 X、Y、Z 的相对分子质量关系为 Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是
| A.原子数相等的三种气体,质量最大是 Z |
| B.若一定条件下,三种气体体积均为2.24L,则它们的物质的量一定均为0.1 mol |
| C.同温同压下,同质量的三种气体,气体密度最小的是X |
| D.同温下,体积相同的两容器分别充agY气体和2agZ气体,则压强之比为1:2 |
您最近一年使用:0次
2022-12-25更新
|
1610次组卷
|
52卷引用:2016届湖北省武汉市高三下学期2月调研理综化学试卷
2016届湖北省武汉市高三下学期2月调研理综化学试卷2016-2017学年江西省南昌二中高一上月考一化学试卷2017届辽宁省沈阳东北育才学校高三上期中模拟化学卷2016届辽宁省葫芦岛市第一高级中学高三上学期第二次周考理综化学试卷河北省“名校联盟”(五校联考)2018届高三上学期教学质量监测(一)化学试题湖北省武汉市部分重点中学2017-2018学年高一上学期期中考试化学试题山东省沂水县第一中学2018届高三下学期第2次模拟化学试题【全国百强校】河北省邢台市第一中学2017-2018学年高二下学期第三次月考化学试题(已下线)【备战2019年浙江新高考-考点】——考点02 物质的量【市级联考】山东省泰安市2019届高三上学期期中考试化学试题【校级联考】安徽省滁州市定远县西片区2018-2019学年高一上学期期中考试化学试题云南省新平县一中2018-2019学年高一上学期12月月考化学试题云南省元江县一中2018-2019学年高一下学期2月份考试化学试题(已下线)2019年7月2日 《每日一题》2020年高考一轮复习-阿伏加德罗定律及其推论的应用河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题四川省广安市邻水县邻水实验学校2019-2020学年高一上学期第一次月考化学试题河北省邯郸市2019-2020学年高一上学期期中考试化学试题内蒙古第一机械制造(集团)有限公司第一中学2019-2020学年高一10月月考化学试题广西南宁市第三中学2019-2020学年高一上学期期中考试化学试题安徽省合肥十中2019-2020学年高一上学期期中考试化学试题云南省云县第一中学2019-2020学年高二12月月考化学试题1内蒙古包钢第一中学2019-2020学年高一上学期10月月考化学试题广东省江门市第一中学2019-2020学年高一上学期10月月考化学试题山西省忻州市第一中学2019-2020学年高一上学期第二次月考化学试题安徽省合肥市肥东县第二中学2020-2021学年高一上学期期末考试化学试题内蒙古呼和浩特市第十六中学2020-2021学年高一上学期第一次质量检测化学试题专题1 第2课时气体摩尔体积-高中化学苏教2019版必修第一册(已下线)解密02 物质的量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密02 物质的量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)课时11 物质的量、气体摩尔体积-2022年高考化学一轮复习小题多维练(全国通用)福建省厦门一中2019-2020学年高一上学期第一次月考(10月)化学试题(已下线)考点02 化学用语和常用化学计量-备战2022年高考化学学霸纠错(全国通用)(已下线)解密02 物质的量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)提升卷02-【新高考新题型】2022年高考化学选择题标准化练习20卷(山东专用)(已下线)解密02 物质的量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)化学-2022年高考押题预测卷02(山东卷)(已下线)必刷卷04-2022年高考化学考前信息必刷卷(山东专用)(已下线)考点02 物质的量 气体摩尔体积-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第04讲 物质的量 气体摩尔体积 (练)-2023年高考化学一轮复习讲练测(新教材新高考)黑龙江省龙西北八校联合体2022-2023学年高三上学期开学考试化学试题河南省南阳市第一中学校2023届高三上学期第二次阶段考试化学试题重庆市万州纯阳中学2022-2023学年高三上学期8月月考化学试题(已下线)专题五 化学常用计量与化学计算-实战高考·二轮复习核心突破山东莒县第一中学2022-2023学年高一上学期12月月考化学试题山东省烟台第一中学2022-2023学年高一上学期月考化学试题山东省烟台第一中学2022-2023学年高一上学期期末调研化学试题安徽省安庆市桐城中学2022-2023学年高一上学期第二次教学质量检测化学试题第二章 物质的量化学实验基本技能 第6讲 物质的量山东省枣庄市第八中学南校2022-2023学年高一1月线上测试化学试题河北省石家庄二中教育集团2022-2023学年度高一年级上学期期末考试化学试题广西浦北中学2023-2024学年高一上学期10月月考化学试题福建省泉州市安溪一中、养正中学、惠安一中、实验中学2023-2024学年高一上学期期中考化学试题
单选题
|
适中(0.65)
名校
22. 下列关于物质的量浓度表述不正确的是
| A.0.3 mol·L-1的Na2SO4溶液中含有Na+和SO42-的物质的量之比为2:1 |
| B.当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol·L-1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol·L-1 |
| C.在通常情况下,22.4L的氯化氢气体中含有的HCl分子数小于NA |
| D.10 ℃时,0.35 mol·L-1的KCl饱和溶液100 mL蒸发掉5 g水,冷却到10 ℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol·L-1 |
您最近一年使用:0次
2019-09-16更新
|
286次组卷
|
2卷引用:河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题
单选题
|
适中(0.65)
名校
23. 将等体积、等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合,反应的离子方程式正确的是
| A.HCO3-+OH-=CO32-+H2O |
| B.2HCO3-+Ba(OH)2=BaCO3↓+2H2O+CO32- |
| C.HCO3-+Ba2++OH-=H2O+BaCO3↓ |
| D.2HCO3-+Ba2++2OH-=2H2O+BaCO3↓+CO32- |
【知识点】 离子反应的发生及书写
您最近一年使用:0次
2016-12-09更新
|
559次组卷
|
5卷引用:2011届上海市十校高三下学期第二次联考化学试卷
(已下线)2011届上海市十校高三下学期第二次联考化学试卷(已下线)2014-2015学年四川省邛崃市高一上学期半期考试化学试卷江西省宜春九中2017-2018学年高一上学期期中考试化学试卷河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题(已下线)上海市宝山区2012届高三上学期期末质量监测化学试题
单选题
|
较难(0.4)
24. 标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A.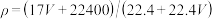 |
B.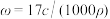 |
C.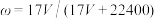 |
D. =1000Vρ/(17V+22400) =1000Vρ/(17V+22400) |
您最近一年使用:0次
2016-12-09更新
|
4917次组卷
|
130卷引用:2010年普通高等学校招生全国统一考试理综化学部分(四川卷)
2010年普通高等学校招生全国统一考试理综化学部分(四川卷)2010年高考化学试题分项专题三 物质的量2010年高考化学试题分项专题十四 化学计算(已下线)2010年重庆一中高一下学期期末考试化学试题(已下线)2010年四川省成都七中高一上学期期中考试化学试卷(已下线)2010—2011学年黑龙江省哈六中高一上学期期末考试化学试卷(已下线)2010—2011学年辽宁省营口市高一上学期期末考试化学试卷(已下线)2011-2012学年浙江省嘉兴一中高一10月份月考化学试卷(已下线)2011-2012年辽宁省开原高中高一上学期第一次考试化学试卷(已下线)2011-2012学年浙江省嘉兴一中高二上学期期中考试化学试卷(已下线)2011-2012学年湖北省黄冈中学高一上学期期中考试化学试卷(已下线)2011-2012学年海南省琼海市嘉积中学高一上学期教学质量检测化学试卷(已下线)2011-2012学年甘肃省兰州市兰炼一中高一上学期期中考试化学试卷(已下线)2011-2012学年四川省成都市树德协进中学高一上学期期中考试化学试卷(已下线)2012-2013学年河北省石家庄市第二实验中学高一上学期期中考化学卷(已下线)2015届广西桂林市第十八中学高三上学期第一次月考化学试卷(已下线)2014-2015学年浙江嘉兴第一中学高一10月月考化学试卷2016届山东省枣庄市第二中学高三9月阶段性学情检测化学试题2016届广西桂林市第十八中学高三第一次月考化学试卷2015-2016学年山西大学附属中学高一上学期第一次月考化学试卷2015-2016学年广东省普宁一中高一上学期第三次月考化学试卷2015-2016学年四川省双流中学高一下入学考试化学试卷2015-2016学年广西桂林十八中高二下开学测化学试卷2015-2016学年河北省保定市高一上学期期末化学试卷2016-2017学年河北省邯郸一中高一上入学考试化学试卷2016-2017学年黑龙江牡丹江高级中学高一9月月考化学卷2017届湖北省大冶一中高三上学期8月月考化学试卷2017届福建省南安一中高三暑假阶段性考试化学试卷2016-2017学年宁夏育才中学高一上第一次月考化学试卷2016-2017学年河南省南阳一中高一上第一次月考化学卷2016-2017学年河北省定州二中高一上10月月考化学试卷2017届陕西省师范大学附属中学高三上学期第二次模考化学试卷山西省怀仁县第一中学(两校区)2016-2017学年高二下学期期末考试化学试题2018版化学(苏教版)高考总复习专题一对接高考精练--物质的量浓度及其溶液的配制山西省忻州市第一中学2016-2017学年高一必修一:第1章从实验学化学同步练习化学试题河南省南阳市第一中学2018届高三上学期第二次考试化学试题江西省新余市第一中学2018届高三毕业年级第二次模拟考试化学试题江西省崇义中学2017-2018学年高一上学期第一次月考化学试题湖南省长沙市实验中学2017-2018学年高一上学期第一次月考化学试题湖南省长沙市第一中学2017-2018学年高一上学期第一次阶段性检测化学试题黑龙江省哈尔滨市第三中学2017-2018学年高一上学期第一次验收考试化学试题新疆阿克苏市农一师中学2017-2018学年高一上学期第一次月考化学试题河南省周口市郸城县第一高级中学2017-2018学年高一10月月考化学试题河南省商丘市第一高级中学2017-2018学年高一上学期第一次月考化学试题天津市静海县第一中学2018届高三9月学生学业能力调研考试化学试题河南省中原名校(即豫南九校)2017-2018学年高一上学期期中联考化学试题安徽省定远重点中学2017-2018学年高一上学期期末考试化学试题陕西省西安市第一中学2017-2018学年高一上学期期末考试化学试题湖北省黄冈中学2017-2018学年高一上学期第一次月考化学试题【全国百强校】江西省新余市第一中学2017-2018学年高二下学期第三次段考化学试题【全国百强校】内蒙古集宁一中(东校区)2017-2018学年高二下学期期末考试化学试题黑龙江省青冈县一中2017-2018学年高二下学期期末考试化学试题(已下线)解密02 化学常用计量——备战2018年高考化学之高频考点解密安徽省肥东县高级中学2019届高三上学期8月调研考试化学试题(已下线)学科网2019年高考化学一轮复习讲练测1.2 物质的量浓度 测2018--2019高中化学《物质的量浓度》专项训练题【全国百强校】新疆维吾尔自治区乌鲁木齐市第一中学2019届高三上学期第一次月考(9月)化学试题湖南省岳阳县第一中学、汨罗市一中2018-2019学年高一上学期10月联考化学试题河南省豫西名校2018-2019学年高一上学期第一次联考化学试题湖南省长沙市周南梅溪湖中学2018-2019学年高一下学期一模检测化学试题河南省永城高中2018-2019学年高一上学期第一次月考化学试题【全国百强校】山西省太原市第五中学2018-2019学年高一上学期10月月考化学试题【全国百强校】山西省山西大学附属中学2018-2019学年高一上学期10月模块诊断化学试题【全国百强校】辽宁省实验中学2018-2019学年高一上学期期中考试化学试题【全国百强校】甘肃省平凉市静宁县第一中学2019届高三上学期第三次模拟考试化学试题安徽省阜阳市第三中学2018-2019学年高一上学期小期末考试(期末模拟)化学试题【全国百强校】内蒙古自治区乌兰察布市集宁区第一中学2018-2019学年高一上学期期末考试化学试题河北省大名县第一中学2018-2019学年高二(普通班)5月月考化学试题【全国百强校】吉林省延边第二中学2018-2019学年高二下学期第二次月考化学试题贵州省铜仁第一中学2018-2019学年高二下学期期末考试化学试题(已下线)专题1.2 物质的量浓度(讲)-《2020年高考一轮复习讲练测》吉林省乾安县七中2017-2018学年高一上学期期中考试化学试卷河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题黑龙江省鹤岗市第一中学2019-2020学年高一第一次月考化学试题河南省林州市第一中学2019-2020学年高一10月月考化学试题安徽省六安市舒城中学2019-2020学年高一上学期第一次月考化学试题2020届高三化学一轮复习 基本概念物质的量(过关检测)山西运城市康杰中学2019-2020学年高一上学期期中考试化学试题四川省遂宁市第二中学2019-2020学年高一上学期期中考试化学试题宁夏回族自治区石嘴山市第三中学2019-2020学年高一上学期期中考试化学试题内蒙古翁牛特旗乌丹第一中学2019-2020学年高一上学期期中考试化学试题山西省朔州市怀仁县第一中学2018-2019学年高一上学期第三次月考化学试题2020届高三化学化学二轮复习——高考常考题:质量分数、物质的量浓度的相关计算【精编25题】广西壮族自治区来宾市金秀县民族中学2019-2020学年高一上学期期末考试化学试题内蒙古包钢第一中学2019-2020学年高一上学期10月月考化学试题广西壮族自治区来宾市忻城县民族中学2019-2020学年高一上学期期末考试化学试题黑龙江省哈尔滨市第一中学2019-2020 学年高二下学期期末考试化学试题(已下线)2.2.2化学反应的计算 练习(2)——《高中新教材同步备课》(苏教版 必修第一册)(已下线)第1单元 化学计量在实验中的应用(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷鲁科版(2019)高一必修第一册第1章 认识化学科学 总结检测高一必修第一册(鲁科2019)第1章第3节 化学中常用的物理量——物质的量广东省深圳市外国语学校2021届高三第一次月考化学试题陕西省渭南高级中学2019-2020学年高一上学期第一次月考化学试题山西大学附属中学2020-2021学年高上学期10月月考化学试题四川省成都外国语学校2020-2021学年高一上学期10月月考化学试题甘肃省天水市第一中学2020-2021学年高一上学期第一学段考试化学试题(已下线)【新东方】【2019】【高一上】【期中考】【JEZ】【化学】【栾子豪制作】(已下线)【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二6月阶段性测试化学试题山西省太原市山西大学附属中学2020-2021学年高一上学期10月(总第一次)模块诊断化学试题四川省遂宁市射洪中学校2020-2021学年高一上学期第一次月考化学试题甘肃省临夏中学2020-2021学年高一上学期期中考试化学试题江西省上饶市横峰中学2020-2021学年高一上学期期中考试化学试题内蒙古自治区赤峰市第二实验中学2020-2021学年高一上学期10月月考化学试题四川省广元市川师大万达中学2020-2021学年高一上学期期中考试化学试题甘肃省天水市第三中学2020-2021学年高一上学期期中考试化学试题(已下线)【浙江新东方】绍兴qw72江西省南昌市八一中学、洪都中学等七校2020-2021学年高一上学期期末联考化学试题(已下线)专题03 溶液——备战2021年高考化学纠错笔记黑龙江省鹤岗市第一中学2020-2021学年高二下学期期中考试化学试题(已下线)专题02 物质的量在化学实验中的应用(热点讲义)-2022届高考化学一轮复习热点题型归纳与变式训练(已下线)课时12 物质的量浓度与溶液的配制-2022年高考化学一轮复习小题多维练(全国通用)四川省遂宁市射洪中学2021-2022学年高一上学期第一次月考化学试题山东省济南市商河县第三中学2022届高三10月月考化学试题广东省湛江市第二十一中学2022届高三9月第二次月考化学试题上海实验高中2021-2022学年高一上学期第一次测试化学试题辽宁省实验中学分校2017-2018学年高一上学期期中考试化学试题北京市第二十中学2021-2022学年高一上学期期中考试化学试题辽宁省沈阳市东北育才学校2020届高三上学期第一次模拟考试化学试题上海市黄浦区大同中学2021-2022学年高一上学期期中考试化学试题上海外国语大学附属外国语学校松江云间中学2021-2022学年高一上学期10月测试化学试题黑龙江省大庆中学2021-2022学年高一上学期期末考试化学试题北京市汇文中学2021-2022学年高一上学期期末考试化学试卷(已下线)第02讲 物质的量浓度与溶液的配制(练)-2023年高考化学一轮复习讲练测(全国通用)黑龙江省哈尔滨师范大学附属中学2021-2022学年高一下学期期末考试化学试题(已下线)2.2.2 物质的量浓度相关计算(好题帮)-备战2023年高考化学一轮复习考点帮(新教材新高考)黑龙江省齐齐哈尔市八校联合体2022-2023学年高三上学期期中考试化学试题黑龙江省实验中学2022-2023学年高一上学期期中测试化学试题上海市浦东新区上海中学东校2022-2023学年高一上学期第一次阶段性素质评估化学试题上海市实验学校2021-2022学年高一上学期第一次测试化学试题甘肃省兰州第一中学2023-2024学年高一上学期12月月考化学试题
单选题
|
适中(0.65)
名校
25. 一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入8molN2,右边充入CO和CO2的混合气体共64g时,隔板处于如图位置(保持温度不变),下列说法正确的是
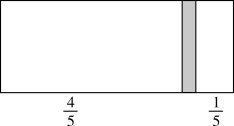

| A.左边CO和CO2分子数之比为1:3 |
| B.右边CO的质量为14g |
| C.右边气体密度是相同条件下氧气密度的2倍 |
D.若改变右边CO和CO2的充入量而使隔板处于距离右端 处,若保持温度不变,则前后两次容器内的压强之比为5:6 处,若保持温度不变,则前后两次容器内的压强之比为5:6 |
您最近一年使用:0次
2019-09-16更新
|
489次组卷
|
7卷引用:重庆市第一中学2017-2018学年高一上学期期中考试化学试题
三、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
名校
26. 下图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制240 mL 1.0 mol/L的稀硫酸。可供选用的仪器有:①玻璃棒;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦胶头滴管。请回答下列问题:

(1)配制上述稀硫酸时,还缺少的仪器有______________ (写仪器名称);
(2)标签所示浓硫酸的物质的量浓度为__________________
(3)配制240 mL 1.0 mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为______ ,量取硫酸时应选用以下_____ 规格的量筒(填选项)。
A.10 mL B.25 mL C.50 mL D.100 mL
(4)根据计算结果,进行如下实验操作:①用量筒量取计算所需体积的浓硫酸;②向量筒中加入少量蒸馏水,并用玻璃棒搅拌;③立即将稀释后的溶液转入容量瓶中;④然后将蒸馏水沿玻璃棒注入容量瓶直至刻度线;⑤把容量瓶盖盖紧,上下颠倒摇匀。
你认为上述实验中错误的操作是______________________________ (填序号)
(5)经过测定,某同学配制的稀硫酸浓度偏高,则可能的原因是_______ (填序号)
①用量筒量取浓硫酸时,仰视刻度线②容量瓶用蒸馏水洗涤后未经干燥③洗涤烧杯内壁后将洗涤液弃去④转移溶液时,不慎有少量溶液洒出⑤定容时,俯视容量瓶刻度线⑥定容、摇匀后发现溶液的凹液面低于刻度线

(1)配制上述稀硫酸时,还缺少的仪器有
(2)标签所示浓硫酸的物质的量浓度为
(3)配制240 mL 1.0 mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为
A.10 mL B.25 mL C.50 mL D.100 mL
(4)根据计算结果,进行如下实验操作:①用量筒量取计算所需体积的浓硫酸;②向量筒中加入少量蒸馏水,并用玻璃棒搅拌;③立即将稀释后的溶液转入容量瓶中;④然后将蒸馏水沿玻璃棒注入容量瓶直至刻度线;⑤把容量瓶盖盖紧,上下颠倒摇匀。
你认为上述实验中错误的操作是
(5)经过测定,某同学配制的稀硫酸浓度偏高,则可能的原因是
①用量筒量取浓硫酸时,仰视刻度线②容量瓶用蒸馏水洗涤后未经干燥③洗涤烧杯内壁后将洗涤液弃去④转移溶液时,不慎有少量溶液洒出⑤定容时,俯视容量瓶刻度线⑥定容、摇匀后发现溶液的凹液面低于刻度线
您最近一年使用:0次
解答题-工业流程题
|
适中(0.65)
名校
27. 某工厂的工业废水中含有Fe3+、Cu2+、SO42-等离子,为了减少污染并变废为宝,工厂计划从该废水中回收金属铜并得到硫酸亚铁(Fe+2FeCl3=3FeCl2)。生产流程如下图所示(所加试剂均为过量)请回答:
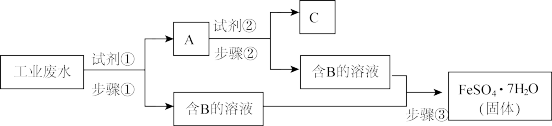
(1)试剂①应该是___________ ,A 中含有的物质是_________ (填物质的名称)。
(2)步骤①采取的操作为__________ ,步骤③中还需分离提纯方法是蒸发浓缩、______ 。
(3)写出步骤②中发生的离子方程式:________________________________________
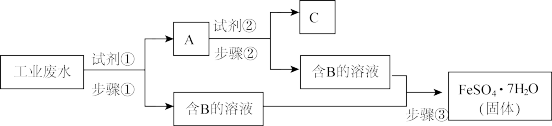
(1)试剂①应该是
(2)步骤①采取的操作为
(3)写出步骤②中发生的离子方程式:
您最近一年使用:0次
四、计算题 添加题型下试题
计算题
|
较难(0.4)
名校
28. 物质的量是高中化学常用的物理量,请完成以下有关计算。
(1)含0.3 mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是___________ 。
(2)___________ g H2O2所含原子数与0.2molH3PO4所含原子数相等。
(3)质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是____________ 。
(4)如果规定,1mol粒子集合体所含的粒子数与0.024kg 12C中所含的碳原子数相同。那么将36.5gHCl溶于水中配成溶液500mL,则溶液的浓度为_____________ mol/L。
(5)同温同压下,某容器充满氧气重116g,若充满二氧化碳重122g,现充满某气体重114g,则该气体的摩尔质量为___________
(1)含0.3 mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是
(2)
(3)质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是
(4)如果规定,1mol粒子集合体所含的粒子数与0.024kg 12C中所含的碳原子数相同。那么将36.5gHCl溶于水中配成溶液500mL,则溶液的浓度为
(5)同温同压下,某容器充满氧气重116g,若充满二氧化碳重122g,现充满某气体重114g,则该气体的摩尔质量为
您最近一年使用:0次
五、填空题 添加题型下试题
填空题
|
容易(0.94)
名校
29. 某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示。
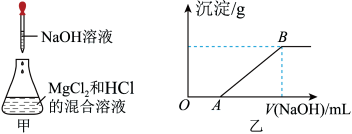
请回答下列问题。
(1)溶解MgCl2固体所用的玻璃仪器有________ (填字母)。
a. 天平 b. 烧杯 c. 漏斗 d. 玻璃棒
(2)OA段反应的化学方程式为_____________________________________ 。
(3)AB段反应的化学方程式为________________________________________ 。
(4)在B点对应的溶液中滴加AgNO3溶液,观察到的现象是______________________ ,反应的离子方程式为___________________________________________ 。

请回答下列问题。
(1)溶解MgCl2固体所用的玻璃仪器有
a. 天平 b. 烧杯 c. 漏斗 d. 玻璃棒
(2)OA段反应的化学方程式为
(3)AB段反应的化学方程式为
(4)在B点对应的溶液中滴加AgNO3溶液,观察到的现象是
您最近一年使用:0次
2019-12-25更新
|
2884次组卷
|
19卷引用:2.2.2 离子反应及其发生的条件
(已下线)2.2.2 离子反应及其发生的条件高中化学人教版 必修1 第二章 化学物质及其变化 2.离子反应 离子反应及其发生的条件2018年高一化学(人教版)必修1综合题型练习卷:离子反应(已下线)【走进新高考】(人教版必修一)2.2.2 离子反应——离子反应及其发生的条件 同步练习02【全国百强校】吉林省长春外国语学校2018-2019学年高一上学期期中考试化学试题安徽省青阳县第一中学2018-2019学年高一上学期期中考试化学试题(已下线)2018年12月30日——《每日一题》高一人教必修1- 每周一测甘肃省孟坝中学2018-2019学年高一上学期期中考试化学试题1.2离子反应练习题河北省秦皇岛一中2019-2020学年高一上学期第一次月考化学试题贵州省贵阳市第六中学2019—2020学年高一上学期期中考试化学试题吉林省长春市东北师大附中净月校区2019-2020学年高一12月月考化学试题(已下线)1.2.2 离子反应 练习(1)——《高中新教材同步备课》(人教版 必修第一册)(已下线)专题03 离子反应(核心素养卷)——【新教材精创】2019-2020学年高中化学新教材知识讲学(已下线)第二章 化学物质及其变化(基础过关)-2020-2021学年高一化学单元测试定心卷(人教版必修1)人教版(2019)高一必修第一册 第一章 物质及其变化 章末综合检测卷甘肃省天水市田家炳中学2021-2022学年高一上学期第一阶段考试化学试卷安徽省黄山市屯溪第一中学2021-2022学年高一上学期期中考试化学试题黑龙江省黑河市第九中学2021--2022学年高一上学期期中考试化学试题
六、解答题 添加题型下试题
解答题-无机推断题
|
较易(0.85)
名校
解题方法
30. A、B、C、D 四种可溶性盐,其阳离子分别是 Na+、Ba2+、Cu2+、Ag+中的某一种, 阴离子分别是 Cl-、 、
、 、
、 中的某一种。现做以下实验:
中的某一种。现做以下实验:
①将四种盐各取少量,分别溶于盛有 5mL 蒸馏水的四支试管中,只有 B 盐溶液呈蓝色。
②分别向 4 支试管中加入 2mL 稀盐酸,发现 A 盐溶液中产生白色沉淀,C 盐溶液中有较多气泡产生,而 D 盐溶液无明显现象。
(1)根据上述事实,推断这四种盐的化学式分别为:A_____ 、B_____ 、C_____ 、D_____ 。
(2)写出下列反应的离子方程式:
①C+D_____ ;
②B+D_____ ;
③C+HCl→气体_____ 。
 、
、 、
、 中的某一种。现做以下实验:
中的某一种。现做以下实验:①将四种盐各取少量,分别溶于盛有 5mL 蒸馏水的四支试管中,只有 B 盐溶液呈蓝色。
②分别向 4 支试管中加入 2mL 稀盐酸,发现 A 盐溶液中产生白色沉淀,C 盐溶液中有较多气泡产生,而 D 盐溶液无明显现象。
(1)根据上述事实,推断这四种盐的化学式分别为:A
(2)写出下列反应的离子方程式:
①C+D
②B+D
③C+HCl→气体
您最近一年使用:0次
2020-11-22更新
|
197次组卷
|
7卷引用:成都龙泉第二中学2019-2020学年高二上学期入学考试化学试题
试卷分析
整体难度:适中
考查范围:认识化学科学、化学实验基础、化学反应原理、常见无机物及其应用、有机化学基础、化学与STSE
试卷题型(共 30题)
题型
数量
未知
1
单选题
24
解答题
3
计算题
1
填空题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、未知 | |||
| 1 | 0.85 | 离子反应的发生条件 离子共存 物质共存 限定条件下的离子共存 | 未知 |
| 二、单选题 | |||
| 2 | 0.65 | 根据n=m/M进行相关计算 依据物质的量浓度公式的基础计算 物质的量浓度计算-与溶质成分有关的计算 电离方程式 | |
| 3 | 0.94 | 四种基本反应类型 | |
| 4 | 0.85 | 物质的量浓度计算-与溶质成分有关的计算 | |
| 5 | 0.65 | 胶体的性质和应用 | |
| 6 | 0.65 | 常用仪器及使用 蒸发与结晶 蒸馏与分馏 萃取和分液 | |
| 7 | 0.65 | 无机物质的分类 | |
| 8 | 0.65 | 物质的量的含义 摩尔 摩尔质量的概念 摩尔质量与相对原子质量区别与联系 | |
| 9 | 0.65 | 阿伏加德罗常数 物质的量有关计算 | |
| 10 | 0.65 | 依据物质的量浓度公式的基础计算 物质的量浓度计算-溶液混合的有关计算 电离方程式 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 | |
| 11 | 0.85 | 分散系概念及其分类 | |
| 12 | 0.65 | 常用仪器及使用 化学实验基础操作 | |
| 13 | 0.65 | 硝酸盐的不稳定性 乙醇燃烧的相关计算 实验安全 | |
| 14 | 0.85 | 离子反应在混合物分离、除杂中的应用 物质分离、提纯的常见化学方法 海水中盐的开发及利用 | |
| 15 | 0.65 | 仪器使用与实验安全 化学实验基础操作 | |
| 16 | 0.65 | 离子反应的发生条件 离子方程式的正误判断 | |
| 17 | 0.65 | 无附加条件的离子共存 限定条件下的离子共存 离子反应在化合物组成的分析、鉴定的应用 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 | |
| 18 | 0.65 | 电解质、非电解质概念 非电解质、电解质物质类别判断 物质水溶液的导电性 强电解质与弱电解质 | |
| 19 | 0.65 | 根据n=m/M进行相关计算 化学方程式计算中物质的量的运用 | |
| 20 | 0.65 | 物质分离、提纯的常见物理方法 物质分离、提纯的常见化学方法 | |
| 21 | 0.4 | 22.4L/mol适用条件 阿伏加德罗定律及其推论 物质的量有关计算 根据n=N/NA的相关计算 | |
| 22 | 0.65 | 溶解度、饱和溶液的概念 22.4L/mol适用条件 依据物质的量浓度公式的基础计算 物质的量浓度计算-与溶质成分有关的计算 | |
| 23 | 0.65 | 离子反应的发生及书写 | |
| 24 | 0.4 | 物质的量浓度的基础计算 物质的量浓度与溶质成分有关的计算 | |
| 25 | 0.65 | 阿伏加德罗定律及其推论 阿伏加德罗定律的应用 根据n=N/NA进行相关计算 根据n=m/M进行相关计算 | |
| 三、解答题 | |||
| 26 | 0.65 | 配制一定物质的量浓度的溶液的步骤、操作 配制一定物质的量浓度的溶液实验的误差分析 配制一定物质的量浓度的溶液实验的仪器 配制一定物质的量浓度溶液的综合考查 | 实验探究题 |
| 27 | 0.65 | 离子方程式的书写 物质分离、提纯综合应用 蒸发与结晶 过滤 | 工业流程题 |
| 30 | 0.85 | 离子方程式的书写 离子反应在化合物组成的分析、鉴定的应用 铜盐的用途 离子的检验 | 无机推断题 |
| 四、计算题 | |||
| 28 | 0.4 | 阿伏加德罗常数的含义 根据n=N/NA进行相关计算 根据n=m/M进行相关计算 依据物质的量浓度公式的基础计算 | |
| 五、填空题 | |||
| 29 | 0.94 | 离子反应的发生条件 离子方程式的书写 常用仪器及使用 | |



